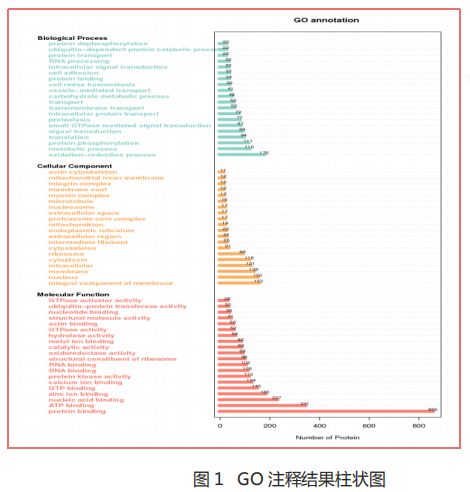
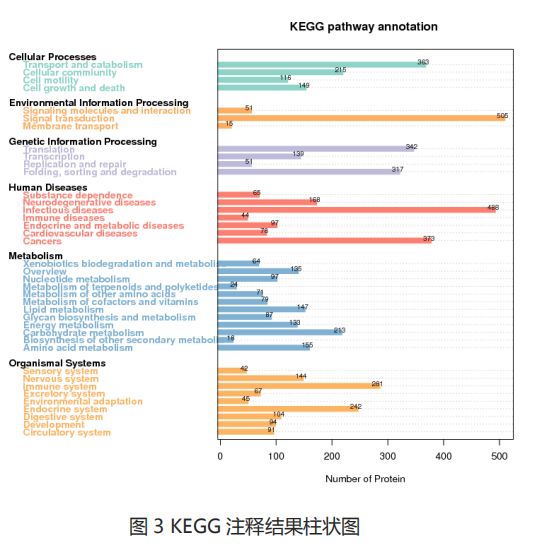
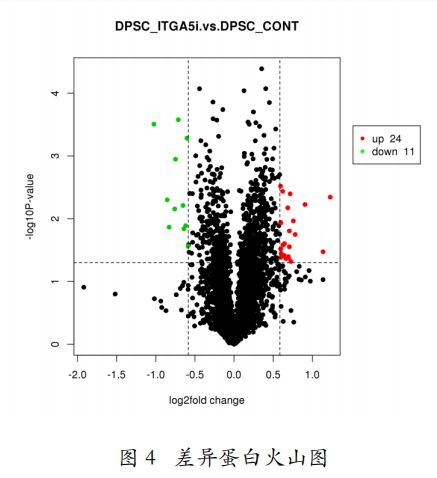
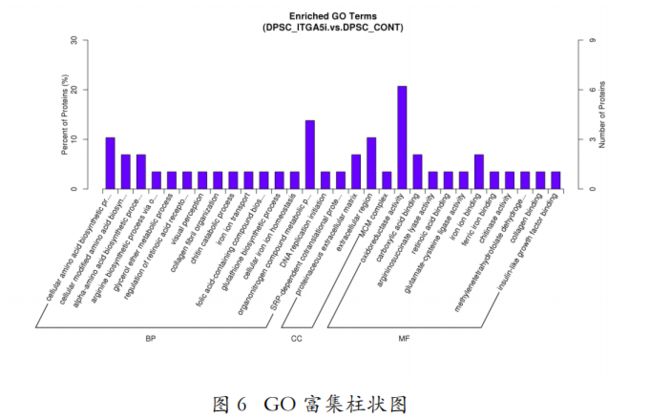
- 第三十篇 维度建模:从理论到落地的企业级实践
随缘而动,随遇而安
数据库sql数据仓库大数据数据库架构
目录一、维度建模核心理论体系1.1Kimball方法论四大支柱1.2关键概念对比矩阵二、四步建模法全流程解析2.1选择业务过程(以电商为例)2.2声明原子粒度(订单案例)2.3维度设计规范时间维度(含财年逻辑)SCDType2完整实现(Hudi)2.4事实表类型与设计三、企业级建模实战:电商用户分析3.1业务矩阵分析3.2模型实现代码四、高级建模技巧4.1多星型模式关联4.2大数据场景优化五、性能
- TK矩阵系统:高效管理与智能化操作平台
m0_74891046
矩阵
随着TikTok等社交媒体平台的快速发展,短视频创作和内容运营逐渐成为互联网行业的重要组成部分。为了帮助内容创作者、品牌运营商以及数据分析人员更高效地管理多个TikTok账号并优化运营策略,TK矩阵系统提供了一种全新的解决方案,结合了先进的软件技术与硬件设施,旨在简化操作流程,提高工作效率。TK矩阵系统概述TK矩阵系统是一款集成软件与硬件的综合平台,专为TikTok内容管理和数据采集设计。系统使用
- 编程语言选择分析:C#、Rust、Go 与 TypeScript 编译器优化
互联网搬砖老肖
工具使用原力计划c#rustgolang
编程语言选择分析:C#、Rust、Go与TypeScript编译器优化在讨论编程语言的选择时,特别是针对微软的C#和Rust,以及谷歌的Go语言,以及微软试图通过Go来拯救TypeScript编译器的问题,我们可以从多个角度来分析和理解。首先,我们来逐一分析这些语言的特点和它们各自的应用场景。1.C#C#是微软开发的一种面向对象的编程语言,它是.NET框架的核心部分。C#广泛用于Windows应用
- AI实干家:HK深度体验-【外2篇-香港“千年地契”解析之政策背景、优势与投资传承特点】
SZ0771
人工智能
香港的“千年地契”通常指999年租期的地契,这种超长租期在香港土地历史上确实存在,但在现代政策下已不常见。以下从香港土地政策、税收政策、投资价值和家庭传承角度,详细分析“千年地契”与普通租期地契的区别,并探讨太平山物业的情况。一、香港“千年地契”是什么?定义与历史背景香港的“千年地契”实际上是指999年租期的地契,而非真正的永久业权(Freehold)。在法律和实际操作中,999年租期被视为“准永
- LeetCode热题100JS(59/100)第十一天|46|78|17|39|22
Alicesflower
LeetCode热题100JSleetcodejavascript算法
46.全排列题目链接:46.全排列难度:中等刷题状态:2刷新知识:解题过程思考示例1:输入:nums=[1,2,3]输出:[[1,2,3],[1,3,2],[2,1,3],[2,3,1],[3,1,2],[3,2,1]题解分析参考题解链接:全排列放下1刷过程/***@param{number[]}nums*@return{number[][]}*///varpermute=function(num
- 生成式对抗网络在人工智能艺术创作中的应用与创新研究
辛迎蕌
人工智能
摘要本文深入探究生成式对抗网络(GAN)在人工智能艺术创作领域的应用与创新。通过剖析GAN核心原理,阐述其在图像、音乐、文学等艺术创作中的实践,分析面临的挑战与创新方向,呈现GAN对艺术创作模式的变革,为理解人工智能与艺术融合发展提供全面视角。一、引言在人工智能与艺术深度融合的时代浪潮中,生成式对抗网络(GAN)作为一项突破性技术,为艺术创作带来了全新的可能性。它打破传统创作边界,以独特的对抗学习
- 知识图谱在人工智能语义理解与推理中的关键作用及发展研究
@王威&
人工智能
摘要本文聚焦知识图谱,深入剖析其在人工智能语义理解与推理中的核心作用。阐述知识图谱的构建原理、表示方法,分析其在自然语言处理、智能问答系统、推荐系统等多领域助力语义理解与推理的应用,探讨面临的挑战并展望未来发展方向,全面呈现知识图谱对人工智能发展的重要价值与深远影响。一、引言在人工智能追求更精准理解和处理人类语言与知识的进程中,知识图谱成为关键技术。它以结构化形式组织海量知识,揭示实体间复杂关系,
- AI实干家:HK深度体验-【第3篇-香港、新加坡、深圳、上海、首尔五座城市在金融数据维度的对比分析】
SZ0771
人工智能大数据
以下是香港、新加坡、深圳、上海、首尔五座城市在金融数据维度的对比分析,涵盖货币流通量、存货款规模、资本市场活跃度、国际贸易、外资及外汇储备等关键指标,结合最新公开数据及全球金融中心排名动态:一、货币流通量(M0-M1-M2)由于城市层面货币供应量(M0、M1、M2)数据通常由国家统一统计,以下以金融机构本外币存款余额(反映广义货币M2的存量规模)为主要参考:城市本外币存款余额(2024年末)增速(
- 计算属性set方法没被执行的原因
伊小小小凡
web前端基础vue.js前端javascript
计算属性set方法没被执行的原因在Vue.js中,computed属性的set方法通常在计算属性的值被显式设置时执行。然而,在某些情况下,set方法可能不会被执行。以下是这些情况的详细分析:没有显式设置计算属性的值只有在显式地给计算属性赋值时,set方法才会被触发。如果只是读取计算属性的值,set方法不会执行。//定义计算属性computed:{fullName:{get(){returnthis
- Bell-1量子计算机分析:开启量子计算2.0时代的创新引擎
Allen_Lyb
行业智库分析与报告量子计算与量子学习量子计算
Bell-1量子计算机:开启量子计算2.0时代的创新引擎一、引言1.1研究背景在当今科技飞速发展的时代,量子计算作为前沿领域,正深刻地改变着科技格局,引领新一轮科技革命与产业变革。自20世纪80年代量子计算概念被提出以来,历经多年的理论探索与技术攻坚,已取得了众多突破性进展。从最初理论设想的提出,到逐步构建出量子计算机,每一次进展都吸引着全球科学界和产业界的高度关注,其发展历程见证了人类对计算能力
- 消息中间件:RabbitMQ、Kafka 和 Redis如何选择?一文让您了解!
写bug如流水
架构设计rabbitmqkafkaredis中间件
RabbitMQ、Kafka和Redis是三种常见的消息中间件,它们各自具有不同的特点和适用的场景。以下是对它们使用场景及选择的分析:1.RabbitMQRabbitMQ是一个基于AMQP(AdvancedMessageQueuingProtocol)的消息队列系统,主要用于消息传递和任务分发,具有可靠的消息传递机制。使用场景:复杂的路由机制:RabbitMQ支持多种交换器类型(如fanout、d
- 拼多多根据ID取商品详情原数据API接口的开发、运用与收益
前端后端运维数据挖掘api
拼多多作为中国电商市场的重要参与者,通过开放平台提供了丰富的API接口,其中根据ID取商品详情原数据的API接口尤为重要。该接口允许开发者通过编程方式获取商品的详细信息,为电商数据分析、竞品分析、价格监测、商品推荐等多个领域带来了丰富的应用场景和显著的收益。本文将深入解析拼多多根据ID取商品详情原数据API接口的开发、运用与收益,并提供相关的代码示例。一、拼多多商品详情API接口的开发拼多多开放平
- 深入分析串口使用rs485功能的内部机制之使用gpio控制传输方向读取rs485温湿度传感器数据(第一期)
@曙光,
linux网络嵌入式
前言首先这是一篇涉及内核分析的,学习这篇文章最好是打开内核源码跟着我的分析去看,我参考的内核源码是linux5.4内核,也可以辅助ai去分析。ModbusRTU读取rs485温湿度传感器使用ModbusRTU读取rs485温湿度传感器有俩种方法,第一种采用gpio控制数据的传输方向:高电平表示主发从收,低电平表示主收从发。第二种采用硬件流控的方法使用串口的rts引脚和cts引脚自动控制收发方向,接
- Win NAS 的数据传输原理分析,超级详细!
DeepSeek+NAS
家用NASWinNAS飞牛NAS人工智能安卓NAS
WinNAS是一款运行在Windows系统上的NAS服务,允许用户通过手机客户端远程访问和管理电脑上的文件。为了实现这一功能,WinNAS与手机之间的数据传输过程涉及多个步骤,具体取决于手机和WinNAS电脑所处的网络环境。以下是整个数据传输过程的详细说明:1.权限认证与连接建立无论手机和WinNAS电脑是否在同一个局域网内,手机客户端在访问WinNAS之前,都需要先通过耘想公司的云服务器进行权限
- react 技术栈请问该如何优化 DOM 大小
混血哲谈
react.js前端前端框架
针对React应用中DOM大小过大的问题,以下是详细的优化方案和具体操作步骤,帮助你提升Lighthouse性能评分和用户体验:一、问题根源分析DOM大小过大(如超过1500个节点或深度超过32层)会导致:渲染性能下降:浏览器解析和渲染DOM的时间增加。内存占用过高:大量DOM节点占用更多内存,影响低端设备表现。交互延迟:事件监听器绑定过多节点时,响应变慢。常见原因:未优化的列表渲染(如长列表一次
- YOLOv12优化:图像去噪 | AAAI2025 Transformer |一种基于Transformer的盲点网络(TBSN)架构 ,结合空间和通道自注意力层来增强网络能力
AI小怪兽
YOLOv12魔术师YOLOtransformer深度学习人工智能python
提出了一种基于Transformer的盲点网络(TBSN)架构,通过分析和重新设计Transformer运算符以满足盲点要求。TBSN遵循扩张BSN的架构原则,并结合空间和通道自注意力层来增强网络能力。如何使用:1)结合C3k2二次创新使用;2)结合A2C2f二次创新使用;亮点包括:1.提出了一种新的基于Transformer的盲点网络(TBSN)架构;2.引入了知识蒸馏策略来提高计算效率;3.在
- 图像识别技术与应用课后总结(20)
一元钱面包
人工智能
图像分割概念图像分割是把图像中不同像素划分到不同类别,预测目标轮廓,属于细粒度分类。比如将图像里不同物体、背景等区分开来,就像把一幅画里的各个元素精准归类。应用场景人像抠图:能精准分离人物和背景,用于图片编辑、影视制作等,比如去除照片背景换背景。医学组织提取:在医学影像(如CT、MRI图像)中分离出不同组织,辅助疾病诊断、手术规划等。遥感图像分析:分析卫星或航空遥感图像时,区分土地、植被、建筑等不
- jieba库词频统计_jieba分词器(应用及字典的补充)及文档高频词提取实战
袁圆园建建
jieba库词频统计
jieba分词器是Python中最好的中文分词组件,本文讲解一下jieba分词器及其应用。1、jieba分词器的分词模式jieba分词器提供了三种常用的分词模式1、精确模式:将句子按照最精确的方法进行切分,适合用于进行文本分析;2、全模式:将句子当中所有可以成词的词语都扫描出来,分词速度很快但容易产生歧义;3、搜索引擎模式:在精确模式分词的基础上,将长的句子再次进行切分,提高召回率,适用于搜索引擎
- Hive 实际应用场景及对应SQL示例
小技工丨
大数据随笔hivesqlhadoop大数据数据仓库
Hive实际应用场景及对应SQL示例一、日志分析场景**场景说明:**处理大规模日志数据(如Web访问日志),分析用户行为或系统运行状态。SQL示例:--统计每日UV(用户访问量)SELECTdate,COUNT(DISTINCTuser_id)ASdaily_uvFROMweb_logsWHEREevent_type='page_view'GROUPBYdate;技术要点:使用DIST
- 智见未来:多大模型协同的数据分析新范式
一ge科研小菜菜
人工智能大数据人工智能大数据
个人主页:一ge科研小菜鸡-CSDN博客期待您的关注1.引言随着大语言模型(LLM)的快速发展,ChatGPT、DeepSeek、Grok等AI模型在数据分析和洞察生成方面展现出巨大潜力。利用多个LLM的协同能力,可以增强数据分析的多角度解读、减少单一模型的偏差,并优化洞察生成的深度和精准度。本文探讨如何结合多个LLM,在数据分析领域实现更可靠的洞察生成,并提供具体的策略、方法和应用场景。2.主要
- 并发爬虫实战:多线程高效抓取王者荣耀全英雄皮肤
YiFoEr_Liu
爬虫案例实操爬虫部署python爬虫python大数据
一、场景与挑战在网络爬虫开发中,我们常常面临以下挑战:需要处理成百上千个页面的数据抓取目标服务器存在反爬机制和请求频率限制单线程模式下载效率低下,难以充分利用带宽本文以王者荣耀英雄皮肤下载为例(日访问量超过1亿的热门游戏),演示如何通过Python并发编程实现高效数据抓取。二、技术选型分析2.1为什么选择并发线程?I/O密集型场景:网络请求占比90%以上GIL限制:Python线程适合I/O密集型
- Ceph数据恢复方案–分布式文件系统删除数据的恢复
San结构数据恢复
数据恢复相关ceph
提示:文章写完后,目录可以自动生成,如何生成可参考右边的帮助文档文章目录前言一、Ceph的三种存储结构二、Ceph中删除数据的恢复提取1.本次案例情况简介:2.数据分析:2.1:BlueStore架构2.2分布式存储中元数据概述2.3提取元数据2.3.2:获取meta_data2.3.4.元数据整理2.3.5.计算数据地址3.数据恢复提取总结前言什么是分布式文件系统分布式文件系统(Distribu
- 统计领域英语专业词汇补充
月亮月亮要去太阳
算法其他
应统考研复试:多元统计、回归分析、时间序列三大领域专业词汇翻译以下是多元统计、回归分析和时间序列三大统计领域的常见专业词汇的英汉互译,按类别整理:多元统计(MultivariateStatistics)英文术语中文术语MultivariateAnalysis多元分析PrincipalComponentAnalysis(PCA)主成分分析FactorAnalysis因子分析ClusterAnalys
- 计算机网络技术服务管理基于Spring Boot-SSM
QQ1978519681计算机程序
网络计算机毕业设计毕业设计数据库springboot
目录一、引言二、用户需求分析三、功能介绍3.1.资源管理:3.2.故障管理:3.3.性能管理:3.4.安全管理:3.5.配置管理:3.6.日志管理:3.7.用户管理:3.8.自动化任务调度:3.9.Web界面管理:3.10扩展性与集成性:四、技术介绍4.1系统架构与技术选型4.2技术选型理由:五、性能需求分析六、安全需求分析结论一、引言随着信息技术的飞
- Spring Boot整合SSE实现消息推送:跨域问题解决与前后端联调实战
Cloud_.
springboot后端java
摘要本文记录了一次完整的SpringBoot整合Server-SentEvents(SSE)实现实时消息推送的开发过程,重点分析前后端联调时遇到的跨域问题及解决方案。通过@CrossOrigin注解的实际应用案例,帮助开发者快速定位和解决类似问题。一、项目背景与需求开发一个实时订单推送系统,需要实现:司机端与服务端的持久化连接订单信息实时推送客户端主动关闭连接二、技术方案设计2.1技术选型技术组件
- JAVA学习-练习试用Java实现“实现一个Spark应用,对大数据集中的文本数据进行情感分析和关键词筛选”
守护者170
java学习java学习
问题:实现一个Spark应用,对大数据集中的文本数据进行情感分析和关键词筛选。解答思路:要实现一个Spark应用,对大数据集中的文本数据进行情感分析和关键词筛选,需要按照以下步骤进行:1.环境准备确保的环境中已经安装了ApacheSpark。可以从[ApacheSpark官网](https://spark.apache.org/downloads.html)下载并安装。2.创建Spark应用以下是
- 研发源代码防泄密加密软件分析
Cnsidna.No.1
企业数据防泄密源代码防泄密企业信息安全网络安全
目前很多企业都拥有自己的研发机构,其研发成果往往体现在源代码和技术文档方面,这些核心机密,如何防止研发参与人员泄密,如何防止核心成员把研究成果带走另立山头,或者提供给竞争对手,是一个很现实的一个问题。有些公司通过和员工签署保密协议,来对应上述的泄密问题,但由于计算机的特性,源代码图纸的取证困难,效果很不理想。如果能够事先进行防范,减少或者杜绝泄密风险,那将大大提升保密性,所以需要购买源代码以及技术
- 学习Python如何高效处理CSV文件的技巧!
程序员总部
pythonpythonjson
在Python中,处理CSV文件是一项非常常见的任务,特别是在数据分析和数据科学领域。CSV文件的全称是Comma-SeparatedValues,顾名思义,它以逗号为分隔符来存储表格数据。这种格式简单易读,也很方便进行数据的存储和交换。接下来就让我们一起探讨一下如何在Python中读取和写入CSV文件吧!CSV模块简介Python内置了一个非常强大的库,名为csv,这个库专门用于处理各种CSV文
- 玛哈特矫平机:引领制造业平整技术的新篇章
玛哈特-小易
制造校平机矫平机大数据微信公众平台
玛哈特矫平机:引领制造业平整技术的新篇章在制造业的广阔舞台上,材料的平整度是确保产品质量与精度的关键要素。玛哈特矫平机,凭借其出色的性能和前沿技术,正逐步成为推动制造业发展的重要驱动力。技术的飞跃与创新的引领玛哈特矫平机不仅代表了传统矫平技术的升级,更是一次技术的飞跃和创新的引领。它融合了先进的传感器网络、实时数据分析系统以及自动化控制平台,为材料矫平提供了智能化的解决方案。这种创新的技术组合,使
- C++多线程常见的数据竞争模式及示例分析
老猿讲编程
c++开发语言多线程数据竞争
一、简单竞争最简单的数据竞争是最常见的一种:两个线程在没有任何同步的情况下访问一个内置类型的变量。很多时候,这种竞争是良性的(代码统计一些允许不精确的统计信息)。intvar;voidThread1(){//在一个线程中运行。var++;}voidThread2(){//在另一个线程中运行。var++;}但有时这种竞争是极其有害的(例如,如果var是在计算你的钱的数量时)。二、线程不友好的引用计数
- sql统计相同项个数并按名次显示
朱辉辉33
javaoracle
现在有如下这样一个表:
A表
ID Name time
------------------------------
0001 aaa 2006-11-18
0002 ccc 2006-11-18
0003 eee 2006-11-18
0004 aaa 2006-11-18
0005 eee 2006-11-18
0004 aaa 2006-11-18
0002 ccc 20
- Android+Jquery Mobile学习系列-目录
白糖_
JQuery Mobile
最近在研究学习基于Android的移动应用开发,准备给家里人做一个应用程序用用。向公司手机移动团队咨询了下,觉得使用Android的WebView上手最快,因为WebView等于是一个内置浏览器,可以基于html页面开发,不用去学习Android自带的七七八八的控件。然后加上Jquery mobile的样式渲染和事件等,就能非常方便的做动态应用了。
从现在起,往后一段时间,我打算
- 如何给线程池命名
daysinsun
线程池
在系统运行后,在线程快照里总是看到线程池的名字为pool-xx,这样导致很不好定位,怎么给线程池一个有意义的名字呢。参照ThreadPoolExecutor类的ThreadFactory,自己实现ThreadFactory接口,重写newThread方法即可。参考代码如下:
public class Named
- IE 中"HTML Parsing Error:Unable to modify the parent container element before the
周凡杨
html解析errorreadyState
错误: IE 中"HTML Parsing Error:Unable to modify the parent container element before the child element is closed"
现象: 同事之间几个IE 测试情况下,有的报这个错,有的不报。经查询资料后,可归纳以下原因。
- java上传
g21121
java
我们在做web项目中通常会遇到上传文件的情况,用struts等框架的会直接用的自带的标签和组件,今天说的是利用servlet来完成上传。
我们这里利用到commons-fileupload组件,相关jar包可以取apache官网下载:http://commons.apache.org/
下面是servlet的代码:
//定义一个磁盘文件工厂
DiskFileItemFactory fact
- SpringMVC配置学习
510888780
springmvc
spring MVC配置详解
现在主流的Web MVC框架除了Struts这个主力 外,其次就是Spring MVC了,因此这也是作为一名程序员需要掌握的主流框架,框架选择多了,应对多变的需求和业务时,可实行的方案自然就多了。不过要想灵活运用Spring MVC来应对大多数的Web开发,就必须要掌握它的配置及原理。
一、Spring MVC环境搭建:(Spring 2.5.6 + Hi
- spring mvc-jfreeChart 柱图(1)
布衣凌宇
jfreechart
第一步:下载jfreeChart包,注意是jfreeChart文件lib目录下的,jcommon-1.0.23.jar和jfreechart-1.0.19.jar两个包即可;
第二步:配置web.xml;
web.xml代码如下
<servlet>
<servlet-name>jfreechart</servlet-nam
- 我的spring学习笔记13-容器扩展点之PropertyPlaceholderConfigurer
aijuans
Spring3
PropertyPlaceholderConfigurer是个bean工厂后置处理器的实现,也就是BeanFactoryPostProcessor接口的一个实现。关于BeanFactoryPostProcessor和BeanPostProcessor类似。我会在其他地方介绍。PropertyPlaceholderConfigurer可以将上下文(配置文件)中的属性值放在另一个单独的标准java P
- java 线程池使用 Runnable&Callable&Future
antlove
javathreadRunnablecallablefuture
1. 创建线程池
ExecutorService executorService = Executors.newCachedThreadPool();
2. 执行一次线程,调用Runnable接口实现
Future<?> future = executorService.submit(new DefaultRunnable());
System.out.prin
- XML语法元素结构的总结
百合不是茶
xml树结构
1.XML介绍1969年 gml (主要目的是要在不同的机器进行通信的数据规范)1985年 sgml standard generralized markup language1993年 html(www网)1998年 xml extensible markup language
- 改变eclipse编码格式
bijian1013
eclipse编码格式
1.改变整个工作空间的编码格式
改变整个工作空间的编码格式,这样以后新建的文件也是新设置的编码格式。
Eclipse->window->preferences->General->workspace-
- javascript中return的设计缺陷
bijian1013
JavaScriptAngularJS
代码1:
<script>
var gisService = (function(window)
{
return
{
name:function ()
{
alert(1);
}
};
})(this);
gisService.name();
&l
- 【持久化框架MyBatis3八】Spring集成MyBatis3
bit1129
Mybatis3
pom.xml配置
Maven的pom中主要包括:
MyBatis
MyBatis-Spring
Spring
MySQL-Connector-Java
Druid
applicationContext.xml配置
<?xml version="1.0" encoding="UTF-8"?>
&
- java web项目启动时自动加载自定义properties文件
bitray
javaWeb监听器相对路径
创建一个类
public class ContextInitListener implements ServletContextListener
使得该类成为一个监听器。用于监听整个容器生命周期的,主要是初始化和销毁的。
类创建后要在web.xml配置文件中增加一个简单的监听器配置,即刚才我们定义的类。
<listener>
<des
- 用nginx区分文件大小做出不同响应
ronin47
昨晚和前21v的同事聊天,说到我离职后一些技术上的更新。其中有个给某大客户(游戏下载类)的特殊需求设计,因为文件大小差距很大——估计是大版本和补丁的区别——又走的是同一个域名,而squid在响应比较大的文件时,尤其是初次下载的时候,性能比较差,所以拆成两组服务器,squid服务于较小的文件,通过pull方式从peer层获取,nginx服务于较大的文件,通过push方式由peer层分发同步。外部发布
- java-67-扑克牌的顺子.从扑克牌中随机抽5张牌,判断是不是一个顺子,即这5张牌是不是连续的.2-10为数字本身,A为1,J为11,Q为12,K为13,而大
bylijinnan
java
package com.ljn.base;
import java.util.Arrays;
import java.util.Random;
public class ContinuousPoker {
/**
* Q67 扑克牌的顺子 从扑克牌中随机抽5张牌,判断是不是一个顺子,即这5张牌是不是连续的。
* 2-10为数字本身,A为1,J为1
- 翟鸿燊老师语录
ccii
翟鸿燊
一、国学应用智慧TAT之亮剑精神A
1. 角色就是人格
就像你一回家的时候,你一进屋里面,你已经是儿子,是姑娘啦,给老爸老妈倒怀水吧,你还觉得你是老总呢?还拿派呢?就像今天一样,你们往这儿一坐,你们之间是什么,同学,是朋友。
还有下属最忌讳的就是领导向他询问情况的时候,什么我不知道,我不清楚,该你知道的你凭什么不知道
- [光速与宇宙]进行光速飞行的一些问题
comsci
问题
在人类整体进入宇宙时代,即将开展深空宇宙探索之前,我有几个猜想想告诉大家
仅仅是猜想。。。未经官方证实
1:要在宇宙中进行光速飞行,必须首先获得宇宙中的航行通行证,而这个航行通行证并不是我们平常认为的那种带钢印的证书,是什么呢? 下面我来告诉
- oracle undo解析
cwqcwqmax9
oracle
oracle undo解析2012-09-24 09:02:01 我来说两句 作者:虫师收藏 我要投稿
Undo是干嘛用的? &nb
- java中各种集合的详细介绍
dashuaifu
java集合
一,java中各种集合的关系图 Collection 接口的接口 对象的集合 ├ List 子接口 &n
- 卸载windows服务的方法
dcj3sjt126com
windowsservice
卸载Windows服务的方法
在Windows中,有一类程序称为服务,在操作系统内核加载完成后就开始加载。这里程序往往运行在操作系统的底层,因此资源占用比较大、执行效率比较高,比较有代表性的就是杀毒软件。但是一旦因为特殊原因不能正确卸载这些程序了,其加载在Windows内的服务就不容易删除了。即便是删除注册表中的相 应项目,虽然不启动了,但是系统中仍然存在此项服务,只是没有加载而已。如果安装其他
- Warning: The Copy Bundle Resources build phase contains this target's Info.plist
dcj3sjt126com
iosxcode
http://developer.apple.com/iphone/library/qa/qa2009/qa1649.html
Excerpt:
You are getting this warning because you probably added your Info.plist file to your Copy Bundle
- 2014之C++学习笔记(一)
Etwo
C++EtwoEtwoiterator迭代器
已经有很长一段时间没有写博客了,可能大家已经淡忘了Etwo这个人的存在,这一年多以来,本人从事了AS的相关开发工作,但最近一段时间,AS在天朝的没落,相信有很多码农也都清楚,现在的页游基本上达到饱和,手机上的游戏基本被unity3D与cocos占据,AS基本没有容身之处。so。。。最近我并不打算直接转型
- js跨越获取数据问题记录
haifengwuch
jsonpjsonAjax
js的跨越问题,普通的ajax无法获取服务器返回的值。
第一种解决方案,通过getson,后台配合方式,实现。
Java后台代码:
protected void doPost(HttpServletRequest req, HttpServletResponse resp)
throws ServletException, IOException {
String ca
- 蓝色jQuery导航条
ini
JavaScripthtmljqueryWebhtml5
效果体验:http://keleyi.com/keleyi/phtml/jqtexiao/39.htmHTML文件代码:
<!DOCTYPE html>
<html xmlns="http://www.w3.org/1999/xhtml">
<head>
<title>jQuery鼠标悬停上下滑动导航条 - 柯乐义<
- linux部署jdk,tomcat,mysql
kerryg
jdktomcatlinuxmysql
1、安装java环境jdk:
一般系统都会默认自带的JDK,但是不太好用,都会卸载了,然后重新安装。
1.1)、卸载:
(rpm -qa :查询已经安装哪些软件包;
rmp -q 软件包:查询指定包是否已
- DOMContentLoaded VS onload VS onreadystatechange
mutongwu
jqueryjs
1. DOMContentLoaded 在页面html、script、style加载完毕即可触发,无需等待所有资源(image/iframe)加载完毕。(IE9+)
2. onload是最早支持的事件,要求所有资源加载完毕触发。
3. onreadystatechange 开始在IE引入,后来其它浏览器也有一定的实现。涉及以下 document , applet, embed, fra
- sql批量插入数据
qifeifei
批量插入
hi,
自己在做工程的时候,遇到批量插入数据的数据修复场景。我的思路是在插入前准备一个临时表,临时表的整理就看当时的选择条件了,临时表就是要插入的数据集,最后再批量插入到数据库中。
WITH tempT AS (
SELECT
item_id AS combo_id,
item_id,
now() AS create_date
FROM
a
- log4j打印日志文件 如何实现相对路径到 项目工程下
thinkfreer
Weblog4j应用服务器日志
最近为了实现统计一个网站的访问量,记录用户的登录信息,以方便站长实时了解自己网站的访问情况,选择了Apache 的log4j,但是在选择相对路径那块 卡主了,X度了好多方法(其实大多都是一样的内用,还一个字都不差的),都没有能解决问题,无奈搞了2天终于解决了,与大家分享一下
需求:
用户登录该网站时,把用户的登录名,ip,时间。统计到一个txt文档里,以方便其他系统调用此txt。项目名
- linux下mysql-5.6.23.tar.gz安装与配置
笑我痴狂
mysqllinuxunix
1.卸载系统默认的mysql
[root@localhost ~]# rpm -qa | grep mysql
mysql-libs-5.1.66-2.el6_3.x86_64
mysql-devel-5.1.66-2.el6_3.x86_64
mysql-5.1.66-2.el6_3.x86_64
[root@localhost ~]# rpm -e mysql-libs-5.1