The Immunomodulatory Effect of Alpha-Lipoic Acid in Autoimmune Diseases.
α-硫辛酸在自身免疫性疾病中的免疫调节作用
IF因子:2.47600 DOI:10.1155/2019/8086257
期刊:Biomed Res Int
作者:Liu W
发表时间:2019-03-20
Αlpha-lipoic acid is a naturally occurring antioxidant in human body and has been widely used as an antioxidant clinically. Accumulating evidences suggested that α-lipoic acid might have immunomodulatory effects on both adaptive and innate immune systems. This review focuses on the evidences and potential targets involved in the immunomodulatory effects of α-lipoic acid. It highlights the fact that α-lipoic acid may have beneficial effects in autoimmune diseases once the immunomodulatory effects can be confirmed by further investigation.
α-硫辛酸是一种天然存在于人体内的抗氧化剂,在临床上被广泛用作抗氧化剂。越来越多的证据表明,α-硫辛酸可能对适应性和先天免疫系统都有免疫调节作用。本文重点介绍了 α-硫辛酸免疫调节作用的证据和潜在目标。它强调了这样一个事实,即一旦免疫调节作用可以通过进一步的研究得到证实,α-硫辛酸可能对自身免疫性疾病有有益的影响。
【全文】
1.背景
α-硫辛酸(ALA)是天然存在的二硫醇化合物,其由植物和动物在线粒体中合成。在生理学上,ALA是α-酮戊二酸脱氢酶复合物的辅助因子,以保护线粒体免受氧化攻击。
ALA和二氢硫辛酸(DHLA)分别是LA的氧化形式和还原形式。 它们是一对强大的氧化还原对,它可以直接清除活性氧(ROS),螯合金属,并再生其他抗氧化剂,以显示抗氧化剂的生化特性。
具有脂溶性和水溶性双重特性,ALA和DHLA可在细胞内和细胞外充分发挥作用[1,2]。
基于其强有力的抗氧化特性和经过验证的安全性,ALA已广泛用于治疗氧化应激相关疾病,如糖尿病、神经系统疾病和心血管疾病。已经开展了越来越多关于硫辛酸的研究;已经对分子机制有了更好的了解,包括ALA刺激胰岛素敏感细胞中的葡萄糖摄取并增强抗氧化防御和内皮血管细胞的功能[3]。几个证据表明ALA可能具有免疫调节作用。随着基础和临床免疫学研究的进展,氧化应激在一些自身免疫性疾病的发病机制中的作用已得到普遍认可,并且ROS与免疫系统的相互作用得到了充分证实。
一方面,ROS可能在各种免疫细胞的信号转导中起生理作用。例如,巨噬细胞产生ROS以杀死细菌,调节性T细胞(Treg)释放ROS以抑制其他T细胞的活化[4]。另一方面,在病理状态中,免疫细胞产生过量的ROS,这加剧了炎症并破坏了免疫系统的平衡。例如,氧化应激是导致免疫系统失调和功能障碍的原因之一[5],这反过来又导致系统性红斑狼疮(SLE)中的氧化应激恶化[6,7]。氧化应激和免疫功能障碍都参与了SLE的发展和进展。
最近,雷帕霉素(mTOR)机制靶标的氧化还原控制激活已被认为在免疫系统中发挥关键调节作用[8],这高度暗示mTOR是代谢应激和自身免疫的关键桥梁。可以推测,基于ROS清除在免疫调节中起作用的证据,抗氧化剂可用于治疗某些自身免疫疾病。在这里,我们总结了ALA免疫调节作用的证据和文献综述所涉及的可能机制。
1.1 ALA的参与信号传导途径
1.1.1 1.1.1. IKKb , Ras/Erk1/2, and PI3K/Akt/mTOR信号传导通路
mTOR可以驱动浆母细胞[9]和T滤泡辅助(Tf)细胞的扩增[10],诱导T1和T17的分化[11],并限制Treg [12]和CD8记忆T细胞的分化[ 13],是免疫力的重要中介。
ALA已被证明可在多种病理条件下调节mTOR的上游激酶[1]。
ALA阻断TNF-a诱导的RA-FLS和人脐静脉内皮细胞(HUVECs)中的IKK / NF-kB信号级联反应[14,15]。 TNF-a激活mTORC1通路通过IKKB激活肿瘤血管生成和胰岛素抵抗[16,17]。因此,可以推测ALA可能抑制IKKB介导的mTORC1活化。
ALA抑制Erk信号传导以改善动脉粥样硬化病变并抑制血管平滑肌细胞增殖[18]。 ALA还抑制由5-羟色胺(5-HT)[19]和表皮生长因子(EGF),碱性成纤维细胞生长因子(bFGF)和血小板衍生生长因子(PDGF)介导的Erk活化[20]。 ALA抑制Akt / S6K1和Erk的活化减弱了肝星状细胞的活化和TGF-β-PDGF刺激的ROS产生[21]。
然而,据报道ALA激活的Erk信号传导可以保护心血管系统和神经系统。ALA增加血红素加氧酶-1(HO-1)以保护血管平滑肌细胞[22],改善葡萄糖/葡萄糖氧化酶 - (G / GO-)诱导的大鼠心肌细胞损伤[23],抑制脂肪细胞分化[24],保护皮质神经元来自4-羟基-2-壬烯醛(HNE-)介导的氧化损伤和神经毒性[25],并通过激活Erk促进神经突向外生长[26]。
由ALA介导的Erk1 / 2激酶对小鼠成纤维细胞的双向调节的效果取决于含有血清或不含血清的细胞培养基[27,28],这在某种程度上可以解释ALA调节相同激酶的事实。不同病理状态的不同方向。
ALA激活Akt激酶以保护胰腺β细胞免受过氧化氢介导的氧化应激[29]。在大鼠L6肌肉细胞中,ALA通过Akt激活和Erk抑制减轻胰岛素抵抗[30]。
ALA增强细胞凋亡并抑制人乳腺癌细胞的增殖[31]。 ALA还通过抑制PI3K / Akt途径诱导肝癌细胞凋亡[32]以发挥抗肿瘤作用。 ALA还抑制脂肪细胞的瘦素产生,改善Goto-Kakizaki(GK)大鼠的胰岛素抵抗,改善葡萄糖和脂质代谢紊乱[33,34]。
ALA的细胞保护作用也可通过磷酸化Akt激酶介导,以改善内质网应激诱导的FRTL5甲状腺细胞死亡[35],保护神经元免受布比卡因、淀粉样蛋白和过氧化氢诱导的损伤[36,37],减少缺血再灌注损伤和肿瘤坏死因子、棕榈酸诱导大鼠L6肌细胞氧化应激损伤[30],减少过氧化氢诱导的胰岛β细胞凋亡[29],减轻LPS诱导的心功能不全[40],单核细胞活化, 急性炎症反应[41],改善血管内皮功能障碍[42,43]。
1.1.2. AMPK信号通路。
ALA已被报道激活AMPK上调脂肪甘油三酯脂肪酶(ATGL),以减少糖尿病小鼠的体重和内脏脂肪含量[44]。
通过AMPC / mTORC1 / S6K1信号通路,亮氨酸和葡萄糖诱导的胰岛素抵抗可以通过TSA2-mTOR抑制剂磷酸化[45,46]和骨骼肌中的AMPK活化[47]通过ALA减弱。 ALA还激活AMPK以下调S6K1 [48]的表达,导致胰腺β细胞中胰岛素分泌的抑制,这意味着mTOR的参与。
然而,据报道ALA还抑制AMPK的磷酸化,AMPK抑制食欲并预防下丘脑肥胖[49-51],这与ALA对外周组织的作用相一致,以改善胰岛素抵抗并减少脂质积累和脂肪生成。
总体而言,ALA在不同疾病的不同细胞类型中以不一致的方向调节mTOR的一些上游激酶。 已经证明mTOR可以调节T细胞分化并抑制SLE患者中无效的Treg细胞[52,53]。 据报道,N-乙酰半胱氨酸(NAC)是一种众所周知的抗氧化剂,可在体外抑制mTOR [54]并改善小鼠狼疮[55]甚至SLE患者的预后[56]。 还观察到,在治疗SLE患者时,mTOR阻断可以减少疾病活动并且可以逆转Treg群体[57]。 尽管这些现有的间接证据很有可能得出结论ALA对mTOR信号传导的调节有效,但免疫细胞中ALA对mTOR通路的调节值得进一步研究具有高复发率和对传统治疗反应差的自身免疫疾病的患者。
2. ALA对免疫系统的影响
在表1和图1中简要总结了ALA对包括T细胞和B细胞在内的适应性免疫细胞的有效作用,并且表1总结了对先天免疫细胞(包括NK细胞,巨噬细胞和单核细胞)的已证实的作用。这将在下面详细讨论。
2.1. 对适应性免疫细胞的影响
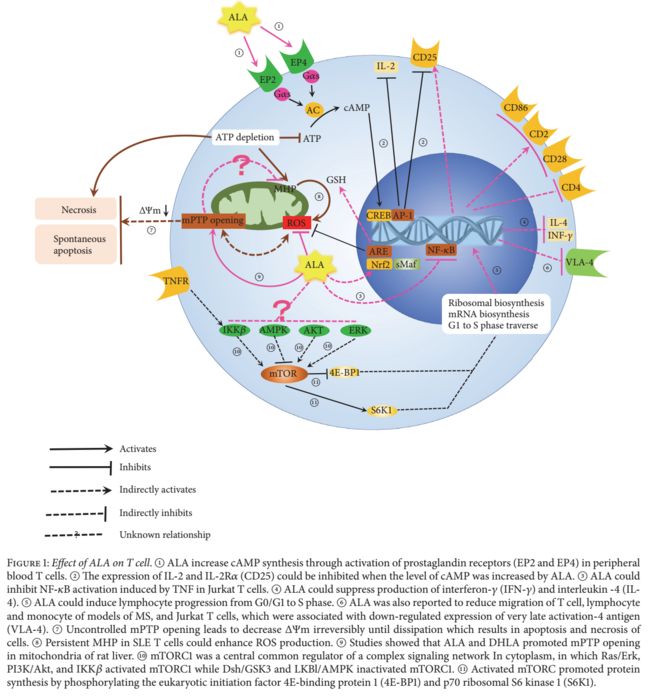
2.1.1 对T细胞的影响。多发性硬化症(MS)是中枢神经系统中的自身免疫疾病,其特征在于髓鞘特异性T淋巴细胞向中枢神经系统(CNS)的迁移和长期存活。 MS的常见模型是实验性自身免疫性脑脊髓炎(EAE)。研究证明了ALA通过抑制炎症细胞的浸润来治疗EAE的有益效果[58-61]。最近,Wang及其同事[60]报道ALA减少了CNS中T17和T1细胞的数量,并增加了EAE小鼠脾脏Treg细胞的数量。它高度暗示ALA对T细胞的分化和增殖显示出免疫调节作用。据报道,ALA还通过激活外周血T细胞中的前列腺素受体(EP2和EP4)来增加cAMP的合成[62](图1,A)。细胞内cAMP水平升高可降低IL-2和IL-2R(CD25)的表达[63](图1,B),进而感染T细胞的增殖和活化[64]。
更多研究表明,ALA可以多种方式调节T细胞的功能。 ALA可改善获得性免疫缺陷综合征(AIDS)患者CD4 + T细胞受损的线粒体功能[65],下调人外周血T细胞CD4分子的表达[66],抑制核因子κB(NF-κB)在Jurkat T细胞中由肿瘤坏死因子-α(TNF)诱导的活化[67](图1,C),抑制干扰素 - (IFN-)和白细胞介素-4(IL-4)的产生(图1,D) CD4 + T细胞降低小鼠模型特应性皮炎病变的严重程度[68],并诱导淋巴细胞从G0 / G1进展至S期(图1,E),这可能与恢复晚期免疫系统功能有关癌症患者[69]。
除了对T细胞增殖,分化和由它们产生的细胞因子的影响外,ALA还可以抑制T细胞的迁移。 Ying及其同事发现ALA可以直接减少T细胞迁移以响应趋化因子,从而减少动脉粥样硬化模型中动脉粥样硬化斑块中的T细胞数量[70]。 ALA还被报道减少T细胞[58,71],MS模型[61]和Jurkat T细胞[72]的淋巴细胞和单核细胞的迁移,这与极晚期激活-4抗原(VLA)的下调表达有关(图1,F)和ALA对MMP-9活性的抑制[72]。
2.1.2. 对B细胞的影响。
研究表明,ALA补充剂可能在高脂饮食小鼠中发挥作用,通过增加B细胞受体(BCR)信号通路的基因表达和降低细胞凋亡百分比来预防氧化应激的发展并减轻B细胞损伤。 脾脏B淋巴细胞[73],也与BCR基因表达水平的提高有关[74]。 已经证实,ALA增加了内毒素血症小鼠脾脏B细胞的数量[75],降低了特应性皮炎小鼠模型的总血清IgE水平[68]。肥胖实验表明,ALA对增殖,凋亡和 B细胞功能具有调节作用(表1)。
2.1.3.对先天免疫细胞的影响
自然杀伤细胞(NK细胞),巨噬细胞和单核细胞(见表2)。细胞毒性和细胞因子分泌是NK细胞的两个主要功能。前者与其细胞质中的颗粒酶(穿孔素和蛋白酶)的释放有关。 INF分泌是后者的代表。
INF-是一种有效的巨噬细胞活化剂,可用于吞噬作用和溶解作用。 IL-12 / IL-18诱导的IFN分泌和NK细胞中的细胞毒性可被ALA抑制,ALA通过G蛋白偶联受体(GPCRs)依赖性和GPCRs独立机制增加cAMP的产生[62,76,77]。此外,还证实了cAMP和cAMP诱导剂(PGE1,茶碱和组胺)均能抑制NK细胞的细胞溶解功能[78]。另一种cAMP升高剂PGE2也抑制IL-15诱导的细胞毒性和IFN-产生[79]。因此,ALA可以通过几种方式抑制NK功能。
还发现ALA通过直接或间接方式调节巨噬细胞的活化,吞噬作用和迁移。 ALA抑制巨噬细胞对髓鞘的吞噬作用[80],这是EAE小鼠的主要自身抗原,并且减少巨噬细胞脂多糖(LPS)诱导的单核细胞趋化蛋白1(MCP-1)和TNF的产生[81,82]。 。此外,ALA使单核细胞浸润到CNS并使EAE大鼠脑内皮细胞稳定[61],这可能与单核细胞下调的细胞内粘附分子-1(ICAM-1)表达[83]和血管细胞粘附上调有关。分子-1(VCAM-1)表达内皮细胞[84]。此外,ALA可诱导人类单核细胞中核因子红细胞2相关因子2(Nrf2)表达血红素加氧酶-1(HO-1)[85]
3. ALA的其他潜在目标
免疫调节作用ALA已在临床上广泛使用了数十年,并在各种实验模型中进行了研究。因此,我们在这些研究中发现了ALA免疫调节作用的潜在靶点。
3.1. 线粒体膜电位(ΔΨm)
线粒体为柠檬酸循环和氧化磷酸化提供了场所,氧化磷酸化是细胞的能量站,参与细胞分化,细胞周期调节和细胞死亡。 ΔΨm的稳定性对维持细胞的正常生理功能至关重要。 Te电子传递链和F0F1-ATPase复合物保持电化学梯度即“ΔΨm”,反之亦然,ΔΨm紧密调节ROS和ATP合成的产生[86]。线粒体通透性转换孔(mPTP)是一系列位于线粒体内外膜的蛋白质通道。 mPTP完全关闭以稳定ΔΨm,而mPTP瞬时打开到低电导状态,导致降低ΔΨm。不可控制的mPTP开放导致不可逆地降低ΔΨm直至消散,导致细胞凋亡和坏死[87,88](图1,G)。在T淋巴细胞活化和凋亡的过程中,ΔΨm瞬时可逆地升高,即生理状态下的线粒体超极化(MHP)应该是[89]。然而,SLE患者T细胞中持续的MHP会增加ROS的产生(图1H),导致巨噬细胞[90]和树突状细胞[91]的激活加剧了炎症[92,93]并导致ATP消耗增加IL-10的产生和T细胞的自发凋亡[94]。 T细胞凋亡不仅提供了核抗原的来源,而且还与SLE疾病活动相关[95,96]。增加IL-10的产生可以促进T细胞凋亡[97]并且有助于通过活动过度的SLE B淋巴细胞产生自身抗体[98,99]。 Tere是证明ALA和DHLA促进大鼠肝脏线粒体mPTP开放的证据[3,93,100](图1,图0)。作者推测,ALA可能从几个方面减轻SLE中的线粒体功能障碍。 ALA打开mPTP以减少ΔΨm,其改善SLE T细胞的病理性MHP并直接淬灭ROS以纠正T细胞和B细胞的功能障碍。
3.2. 中性粒细胞胞外陷阱(NETs)。
中性粒细胞在先天免疫系统中起着非常重要的作用,并且是第一个通过多种机制被招募到感染部位以消除病原体的白细胞。
吞噬作用\炎症介质分泌和NETs释放,也称为NETosis。 NET由核酸,组蛋白和颗粒蛋白组成,有或没有中性粒细胞死亡[101]。 NETs仅对抗病原体,但也与自身免疫性疾病(如SLE [102,103],RA [104,105],牛皮癣[106]和自身免疫性小血管炎[107])和血栓形成的发病机制有关 [108]。 NETs组分的核材料在从细胞中挤出以诱导自身抗体产生后变成自身抗原[109]。 NETs的形成依赖于自噬和ROS的产生[110,111],并受mTOR信号通路的调控[112,113]。据推测,ALA可能能够淬灭ROS并调节mTOR信号,这表明它可能对NETs形成具有益处,以减少自身抗体的产生和保护血管内皮。
3.3. Nrf2信号通路。
ALA被公认为是Nrf2信号传导的激活因子[1,114]。核因子 - 红细胞2相关因子2(Nrf2)是细胞对氧化应激的抗性的中枢调节因子,它结合抗氧化反应元件(ARE)调节许多含有ARE的基因的表达,在氧化剂稳态氧化剂稳态控制中发挥关键作用[115]。 这是证明Nrf2信号传导与自身免疫疾病发病机制之间关联的一个小证据。已经证明,Nrf2-缺陷型雌性小鼠患有与狼疮相似的严重肾炎[116],而Nrf2基因变异与儿童期SLE患者的肾炎相关[117]。 Nrf2( - / - )小鼠发展为再生免疫介导的溶血性贫血[118]并且Nrf2的破坏加重[119],而Nrf2的激活减弱了EAE中的[120]神经炎症性疾病。因此,ALA可能通过Nrf2途径在免疫系统中具有调节作用。
4. ALA的安全性
ALA是人体中天然存在的抗氧化剂,可从常见的饮食来源获得,已在德国用于治疗糖尿病神经病变和视网膜病变超过50年。许多临床试验报道,口服LA补充剂高达2400mg/ d,静脉补充LA至600 mg/d,持续3周,与安慰剂相比没有不良反应[1,2]。此外,Sen和同事已经证实ALA的敏感调节作用是ALA促进Fas诱导的Jurkat细胞凋亡,而不是健康的外周血淋巴细胞[121]。这些研究的数据支持ALA的安全性。
5.总结
总之,ALA是人体的天然成分,不仅可以作为强大的抗氧化剂,而且能够以直接或间接的方式调节免疫系统。上述研究可能表明ALA用于治疗自身免疫性疾病,包括SLE、RA和原发性血管炎以及MS。目前治疗系统性风湿性疾病的疗法是有效的。然而,仍然有很高比例的患者对治疗反应不足或没有反应。因此,如果ALA的免疫调节作用可以通过进一步的调查来解决,那么它可能与当前治疗风湿性疾病一起具有益处。
利益冲突
作者声明他们没有任何利益嫌疑。
作者的贡献
刘伟和施连杰对论文作出了同样的贡献。
致谢
作者感谢来自中国人民解放军联合后勤支援部队第900医院的医学博士李国祥,他在撰写本手稿时为绘图和医学写作提供了帮助。这项工作得到了福州总医院的资助( 2018年J05)和福建省临床重点专业建设项目(民威医学函[2015]第593号)。