The Role of Diabetes Mellitus in Sexual and Reproductive Health Current Diabetes Reviews, 2017, Vol. 13, No. 6 581
The Role of Diabetes Mellitus in Sexual and Reproductive Health: An Overview of Pathogenesis, Evaluation, and Management
糖尿病在性与生殖健康中的作用:发病机制,评估和管理概述
摘要:
背景:未控制或长期的糖尿病造成血管应激和氧化应激,使几种生理系统失衡,这可能反过来引起心理症状。
目的:我们评估糖尿病的性和激素并发症,这些并发症会损害男性和女性的生殖功能。
方法:使用与糖尿病和生殖健康相关的关键词指导全面的MEDLINE®检索。
结果:我们回顾了男性和女性每种糖尿病生殖并发症的发病机制、临床表现、影像学方法、药物治疗和干预方案。继发于血管病,神经病和肌病损伤的勃起功能障碍是男性糖尿病的主要并发症。其他生殖并发症包括射精功能障碍、性腺功能减退、精液参数改变和青春期延迟。由于缺乏对女性性功能的标准化评估以及心理发病率的增加,糖尿病女性生殖功能障碍的细节不如男性明确。尽管如此,已知它表现为性腺机能减退、性欲减退、性交困难、月经功能障碍和多囊卵巢综合症。
结论:需要更大样本量的纵向研究才能更好地理解糖尿病与性功能障碍之间的联系,主要是女性。了解和划分生育和性问题在生殖功能障碍中的作用可以帮助指导评估和管理。
关键词:糖尿病,糖尿病性血管病,糖尿病性神经病,性交困难,射精功能障碍,勃起功能障碍,性欲减退症,性腺功能减退症,不孕症,多囊卵巢综合征,性功能障碍。
1.引言
糖尿病(DM)是一种慢性,进行性代谢和高血糖症状,是世界上最流行的疾病之一。发展中国家的糖尿病患者由于其管理不善而面临更大的困境。预计全球至少有5.5亿人将在2030年前患上这种疾病[1]。这不仅考虑到人口增长,而且考虑到更长的预期寿命。当不受控制时,1型(DM1:胰岛素依赖型)和2型(DM2:非胰岛素依赖型)DM可以煽动阻碍多种生理系统的血管并发症,包括那些在生殖健康中起作用的系统。
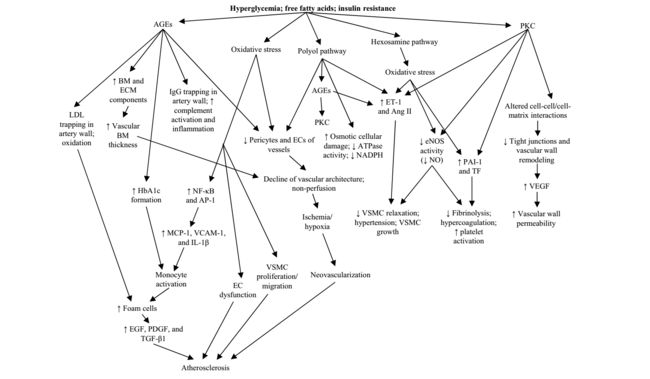
由糖尿病引起的氧化应激引起的主要微血管并发症包括血管病变和神经病变。它们可导致微观水平的血管和神经纤维受损。后者可能以两种方式受到影响:通过神经纤维的代谢损伤或血管周围去神经支配和血管神经的透明化,也被称为沿着神经的精细血管。大血管病变是造成大规模损伤的原因,如心血管疾病和高血压。图(1)突出了血管病变并发症的后遗症[2-4]。
(图1:糖尿病患者血管病变的发病机制。内皮功能障碍和血液性质改变可能是组织缺氧和损伤的关键组成部分。 AGE,高级糖基化终产物; Ang II,血管紧张素II; AP-1,活化蛋白-1; ATP酶,腺苷三磷酸酶; BM,基底膜; DAG,二酰基甘油; EC,内皮细胞; ECM,细胞外基质; EGF,表皮生长因子; eNOS,内皮型一氧化氮合酶; ET-1,内皮素-1; IgG,免疫球蛋白G; IL-1,白细胞介素-1; LDL,低密度脂蛋白; MCP-1,单核细胞趋化蛋白-1; NADPH,烟酰胺腺嘌呤二核苷酸磷酸氧化酶; NO,一氧化氮; NF-kB,核因子-kB; PAI-1,纤溶酶原激活物抑制剂1; PDGF,血小板衍生生长因子; PKC,蛋白激酶C; TF,组织因子; TGF-1,转化生长因子-1; VCAM-1,血管细胞粘附分子-1; VEGF,血管内皮生长因子; VSMC;血管平滑肌细胞。改编自Gandhi,J。等。 (2016)。 “糖尿病的泌尿生殖系统并发症:发病机制,评估和管理概述”。 Curr Diabetes Rev)
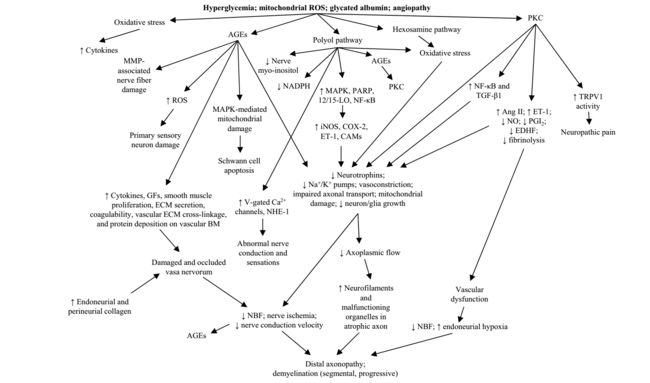
图(2)回顾了神经病理损伤的发病机制[5-9]。血管病变、神经病变和其他与氧化应激相关的后遗症是导致性功能障碍和不育的基础,导致男性和女性的生殖健康受损。恩茨林等人 [10]发现25%的糖尿病男性和27%的糖尿病女性表现出性功能障碍。 2015年的一项研究发现,糖尿病相关的并发症,以及更高的年龄和临床抑郁,在男性和女性糖尿病患者中的患病率和性功能障碍的发生率最高[11]。糖尿病的年龄和持续时间是发生并发症的主要风险因素,因为氧化应激造成的损害需要时间来发展。神经病变的后果通常多年未见。其次,随着年龄的增长,其他糖尿病并发症如心血管疾病的发展可能会进一步加速性和生殖障碍。可控风险因素如肥胖和吸烟是心血管疾病的原因。最后,心理问题在糖尿病中的复杂参与是造成两性性功能受损的原因。
(图2:糖尿病神经病变的发病机制。代谢损伤的神经纤维,以及血管的增厚、透明化和血管周围去神经支配可能是体细胞、自主神经和颅神经功能障碍背后的关键因素。 12/15-LO,12 / 15-脂氧合酶; AGE,高级糖基化终产物; Ang II,血管紧张素II; BM,基底膜; CAM,细胞粘附分子; COX-2,环氧合酶-2; ECM,细胞外基质; EDHF,内皮衍生的超极化因子; ET-1,内皮素-1; GF,生长因子; iNOS,诱导型一氧化氮合酶; MAPK,丝裂原活化蛋白激酶; MMP,基质金属蛋白酶; NADPH,烟酰胺腺嘌呤二核苷酸磷酸氧化酶; NBF,神经血流量; NHE-1,钠 - 氢反向转运蛋白1; NF-B,核因子-B; NO,一氧化氮; PGI2,前列环素; PKC,蛋白激酶C; PARP,聚(ADP-核糖)聚合酶;活性氧,活性氧; TGF-1,转化生长因子-1; TRPV1,瞬时受体电位阳离子通道V1。改编自Gandhi,J.,et al。 (2016)。 “糖尿病的泌尿生殖系统并发症:发病机制,评估和管理概述”。 Curr Diabetes Rev.)
我们目前回顾了当前的发病机制,临床症、影像学方法、以及男性和女性DM的生殖并发症的治疗和干预选择。除非另有说明,否则下面审查的大多数条件不反映特定类型的DM。列出的临床症状和管理方案既不详尽也不强制;大多数情况取决于共存条件,潜在并发症的严重程度,病原体的性质以及患者的人口统计背景。
2.方法
我们已经对1972年至2016年的文献进行了MEDLINE®数据库检索。总结了糖尿病和生殖健康并发症的搜索术语中与性功能障碍和不孕症相关的当前信息。在可获得的情况下,从相关评论、原始研究和与已确定的生殖健康状况有关的病例报告中总结了涉及发病机理、临床表现、成像选择、药理学治疗和干预的要点。
3.糖尿病患者的男性性和生殖并发症
男性的糖尿病生殖并发症可能包括勃起功能障碍、射精功能障碍、性腺机能减退、精液参数改变和青春期延迟。继发于DM的不良阴茎状况,例如阴茎异常勃起(即持续性和疼痛性勃起)、阴茎勃起症(即阴茎不自然弯曲)、龟头炎/龟头包皮炎(即龟头和包皮过长的炎症)、包茎/包皮病(即包皮过长/ /收缩困难)也会损害性功能;他们没有在这篇评论中讨论过,因为它们的影响并不仅限于生殖健康。表1总结了每种已知男性生殖并发症的临床表现、成像、药理学治疗和干预。
3.1 勃起功能障碍
勃起功能障碍(ED)被定义为尽管有足够的性刺激但仍不能获得或延长勃起的挑战。据说糖尿病男性的患病率在35-75%之间[21]。阴茎血管系统的内皮功能障碍、异常的胶原沉积、平滑肌萎缩和氧化应激途径在ED的发展中起主要作用,与非糖尿病患者相比,其在糖尿病男性中发展的可能性高达三倍[22]。
这些结构变化与勃起功能障碍相关,尤其是在阴部内动脉水平[23]。 TGF-1与ED的结缔组织改变有关[24]。人体阴茎海绵体活检中也记录了晚期糖基化终产物(AGEs)[25]。内皮细胞损伤可通过增加糖尿病患者血管收缩剂内皮素-1(ET-1)的循环水平来证实。 ET-1通过Rho激酶依赖性级联起作用,导致平滑肌收缩和血管收缩[26,27]。糖尿病周围神经病变可导致分泌到阴茎背神经的感觉性阴部神经(S2-S4)变性,导致性刺激的冲动受损[14]。然而,去甲肾上腺素(NE)和乙酰胆碱阳性纤维的糖尿病自主神经病变可能是最不利的,因为它可能导致副交感神经输入对氮能神经释放的一氧化氮(NO)的损害和NE的减少[28]。血管收缩,导致自主神经节低氧诱导的轴突运输和神经传导损伤,可能是通过抑制一氧化氮合酶(NOS)导致NO产生减少的原因; NOS在细胞体内的积累可能导致氮能神经变性,并可能导致不可逆的ED [29]。没有阴茎NO合成,阴茎海绵体和海绵体平滑肌组织不能松弛,螺旋动脉不能血管扩张,因此勃起组织内的小梁平滑肌和腔隙空间不能松弛以充血[14]。阴茎疣中低血管活性肠肽(VIP)和前列环素也可能导致平滑肌松弛[12]。总的来说,海绵体平滑肌肌病和植物神经功能紊乱可能会产生静脉渗漏(即对阴茎静脉血流的低阻力)[30]。尽管血管病和神经病变是主要的罪魁祸首,低睾酮(T)也伴随糖尿病ED,因为阴茎血管的NOS和支配横纹勃起肌的脊髓运动神经元(即球海绵体肌和坐骨海绵体)都是T依赖性的[ 12,31]。 T缺乏也可能在阴茎海绵体的结构中产生不利的变化,包括弹性纤维的排列导致导致ED的病理改变[32]。最后,由于糖尿病并发症引起的任何心理损害也可能导致ED。那些患有ED的人通常会遭受较低的生活质量和抑郁,这会对性欲产生负面影响[33]。 ED被认为是随后发生心血管疾病的早期预测因子,因为阴茎微循环受损是新出现的内皮功能障碍的标志物;阴茎动脉不能承受斑块以及较大的全身血管,因此可以更快地观察到ED [21,33]。由于两者都可能源于DM并发症,因此应采取措施使冠状动脉疾病在症状出现之前停止在其轨道上。
3.2 射精功能障碍
射精功能障碍包括早泄,射精延迟,射精(AE)和逆行射精(RE);后两者与DM明显相关,是生育障碍。 AE是由于血管和精囊肌层的蠕动失败导致精液进入后尿道的绝对缺乏[14]。 RE的特征在于射精沉积在后尿道中但向后推进膀胱而不是向前伸向阴茎远端[14]。
糖尿病自主神经病变可以破坏交感神经传出纤维(支配内部[膀胱]尿道括约肌),在高潮期间提供正常的高压膀胱颈闭合,导致进入膀胱的压力相对较低的路径[14]。
3.3 性腺机能减退
性腺机能减退是类固醇生成的损害,即在Leydig细胞中制造睾酮。这无意中影响了Sertoli细胞的生产精子生成。高血糖和高胰岛素血症可伴有血清T和硫酸脱氢表雄酮(DHEA-S)降低[34],这表明糖尿病的低血糖症。平均睾丸大小和血清黄体生成素(LH)也可能下降[35]。降低T可能通过脂蛋白脂肪酶增加游离脂肪酸的摄取,从而刺激内脏脂肪细胞增殖[36]。脂肪细胞内的芳香酶将T转化为雌二醇(E2),这解释了肥胖如何表现出较低的血清T和较高的血清E2浓度。增加的E2水平通过反馈抑制促性腺激素释放来支持上述LH的降低,这也可导致睾丸萎缩[37]。此外,瘦素可能抑制肥胖患者中Leydig细胞T的基础和LH刺激释放[38]。在组织学上,重点是成纤维细胞取代的个体Leydig细胞,以及生精小管中肌样元素,外周纤维化和透明化的变化[20]。代谢综合征中的炎性细胞因子可能另外抑制T生成[39]。下丘脑神经元和胰岛素的相互作用也可能是低促性腺激素性性腺机能减退的基础。已显示胰岛素受体介导参与促性腺激素释放激素(GnRH)产生的前视前下丘脑神经元的作用。在胰岛素抵抗的情况下,这个过程受到干扰,损害GnRH的分泌,从而减少Leydig细胞群和T代谢物[40]。
虽然对性腺机能减退的任何影响都不明显,但动物研究表明口服抗糖尿病药物吡格列酮和西他列汀通过病理结构改变削弱了睾丸、附睾和精囊中性激素受体的表达[41]。同一项研究表明,二甲双胍不具有破坏性。在患有生殖器官的糖尿病男孩中应避免使用拟议的药物。
3.4 改变的精液参数
改变的精液参数可导致男性不育。 DM1患者可能会看到精液量减少以及精子数量/密度(即生发上皮细胞脱落以及生精通道改变,基底膜厚度和间质睾丸组织增生),运动和形态学(即不成熟)和细胞凋亡相关的缺陷),以及精液中果糖和葡萄糖水平的增加以及锌浓度的降低[20,42-44]。这可能与血清LH水平、卵泡刺激素(FSH)和性腺功能减退症糖尿病患者T水平显著降低有关[45]。线粒体功能障碍导致精浆中氨基酸和衍生物的增加,可能是精子参数恶化的原因。改变的激肽释放酶 - 激肽系统活动也可能是精子运动功能减退的原因。精浆中的AGEs导致精子和精浆脂质过氧化,可能是氧化应激的主要原因,从而导致精子核DNA损伤[46,47]。在DM1患者中,7,8-二氢-8-氧代-2-脱氧鸟苷的浓度增加证明了精子中更高水平的DNA片段化[48]。 2015年的一项研究发现,DM1患者的精子比例较低,具有进行性运动,线粒体功能受损和附睾后射精功能障碍[49]。总的来说,这些改变的精液参数可能会影响生育能力。更大的多中心研究对于验证这些研究结果至关重要。
3.5 青春期延迟
尽管机制尚不清楚,青少年可能表现出更高的青春期延迟发生率,尤其是糖尿病患者的碳水化合物代谢紊乱和酮症酸中毒。低DHEA-S浓度以及诸如不规则生长激素分泌等其他因素可能影响糖尿病患者的生长(即骨)延迟[20]。青春期延迟不一定限于DM1。这是非常罕见的,并且因此没有得到很好的研究。
4.糖尿病患者的女性性和生殖并发症
女性的糖尿病生殖并发症可能比男性更具视觉细微差别。女性性功能障碍是生殖健康的关键限制因素。一项研究表明,与对照组和DM2女性相比,DM1女性的性功能障碍患病率显著较高,这可能是由于突然的神经血管紊乱和/或对心理社会因素的长期和显著影响[50]。也可能是由于DM1女性报告的性交困难程度较高[51]。然而,改进的纳入研究标准也使得DM2中女性性功能障碍的患病率显著增高[52]。
虽然女性性功能障碍包括性欲减退,性高潮功能障碍,阴道润滑减少,阴道周围皮肤感觉丧失,以及觉醒和性满足问题,但很难描述每个人的发病机制,因为他们没有单独进行适当的研究。 。
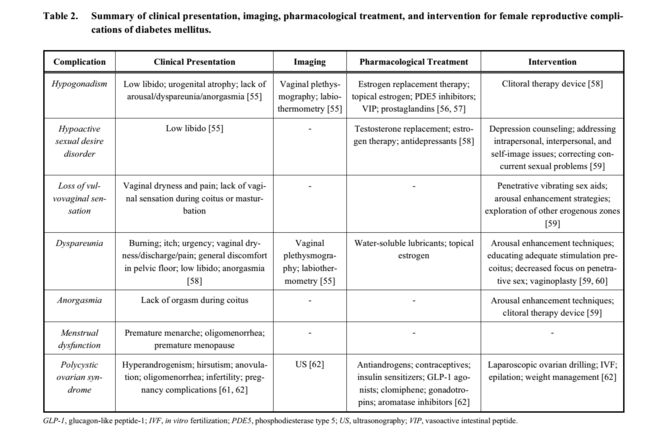
糖尿病患者对外阴阴道念珠菌病的易感性也会引起性交期间的不适;由于其后果不仅限于生殖健康,因此本评价未对此进行讨论。继发于糖尿病(通常为DM1)的慢性肾病也由于性激素分布改变而导致性功能障碍,可能出于肾脏保护的原因。这些女性的卵巢功能衰竭可能与下丘脑 - 垂体瘤轴的几个部位的异常有关[53]。大多数患者研究表明,女性性功能障碍在患有焦虑和抑郁症的糖尿病患者中非常普遍,最近的研究显示,数字分别高达95.8%和65.3%。[54]。虽然女性性功能障碍是一个非特异性术语,但已经实施了几种筛查工具:性欲减退筛查(5个问题,自我管理,对广泛性获得性性欲减退症的评估),女性性功能指数(19个问题,自我管理,评估全部)女性性功能的维度包括性满足度),性兴趣和欲望清单 - 女性(13项,临床医生管理,评估女性性欲减退性疾病的严重程度),短暂的性欲减退症状筛查(4个问题,自我管理的低活性绝经后妇女的性欲障碍),女性性功能简介(7个问题,绝经后妇女自我管理的性欲减退症)和女性性窘迫量表 - 修订(13个问题,自我管理,评估与女性相关的痛苦)性功能障碍)[53]。这使得医疗保健提供者能够获得关于性欲,唤醒和性高潮能力,性交频率和生育能力的详细性史。然后可以将这些病症的发作与患者的糖尿病阶段相关联以确定适当的管理。表2总结了每种已知雌性生殖并发症的临床表现,成像,药理学治疗和干预。
4.1 性腺机能减退
原发性或继发性闭经和代谢控制不足的DM1患者表现出低LH,FSH和雌二醇水平,这通常与缺乏胰岛素分泌有关[63]。对于GnRH脉冲产生异常的研究显示,与月经周期正常的患者相比,闭经DM1患者的LH脉冲频率和振幅均降低,这可能是由于高血糖对GnRH神经元的凋亡作用[64-67]。高血糖期间儿茶酚胺,阿片类药物和多巴胺释放增加也可能抑制LH水平[62,65,68]。
4.2 低活性欲障碍
雌激素,T和黄体酮的激素失衡可能会影响性欲减退症。雌激素在维持粘膜上皮,感觉阈值以及脑和生殖器血流方面起着至关重要的作用[58,69]。除了整体的幸福感外,T主要影响性欲,唤醒,性高潮和血流,而黄体酮最有可能增强接受性[58,70]。
4.3 性交疼痛
高血糖可以减少阴道组织粘膜的水合作用,导致阴道润滑不良和性交困难;感染发生率增加也可能有所贡献[71]。尽管病理解释模糊,但在糖尿病患者中也发现了诸如阴蒂和阴道组织弥漫性纤维化以及生殖器振动感降低等影响[58,72]。糖尿病血管病可能导致局部血流变化,影响VIP和NO在阴道平滑肌松弛和血流量增加中的作用。血管病也可能在唤醒期间阻碍阴蒂充血和阴道润滑,导致性交困难或在性活动期间减少唤醒[73]。阴道干燥也会使患者面临发生外阴阴道炎的风险,产生性疼痛,不适和骚扰。此外,糖尿病神经病变可能阻止性刺激的正常转导并引发性反应,可能引起阴道壁修改(例如肌肉层和上皮厚度减少)和肌肉张力减弱导致的盆底功能障碍[74]。更具体地说,可能存在阴道和阴蒂海绵体自主神经功能障碍,导致阴蒂,阴道和阴唇增大[69]。总的来说,这些结构和功能的偏差可能从根本上影响唤醒和性高潮的性反应。
4.4 月经功能障碍
DM2女性与月经初潮有关。从历史上看,在发现胰岛素之前,患有DM1的年轻女孩未能发生月经初潮。随着糖尿病治疗的进步,由于与DM1相关的代谢应激,可能只能看到最差的月经初潮[75]。对此的潜在机制考虑到促性腺激素分泌活化的延迟。其他可能性包括在青春期发育的最后阶段出现雄激素过多症,卵巢抗体的存在,AGEs增加,胰岛素抵抗加重,以及青春期开始时性激素结合球蛋白增高[63]。
糖尿病性闭经妇女雌二醇水平低可能导致阴道萎缩和性交困难[53]。还必须指出的是,DM1女性在月经的黄体期才被归因于性功能下降和性窘迫增加[76]。
4.5 多囊卵巢综合征
多囊卵巢综合征(PCOS)是卵巢囊肿的发展,可能会影响生育能力。由于强化血糖控制方案,DM1女性中的PCOS可能由外源性高胰岛素血症引起。在生理条件下,内源性胰岛素通过肝脏进行首过代谢,最终消除大部分胰岛素。 DM1患者没有经历这种首过代谢,因此对于类似的葡萄糖控制具有更高的全身胰岛素水平[61,77]。胰岛素通过卵泡膜上的胰岛素和IGF-1受体刺激雄激素分泌; LH激增会增强这种现象[78]。胰岛素还通过颗粒细胞中的胰岛素受体增强卵泡发育和卵巢类固醇生成[79,80]。胰岛素增强FSH刺激的类固醇分泌,如同时暴露于胰岛素和FSH的颗粒细胞中雌激素分泌增加所示[81]。
此外,胰岛素对卵泡发生的促性腺作用增强了排卵前卵泡的募集和生长[79],抑制了卵巢卵泡中的细胞凋亡和闭锁,促进了卵泡成熟,卵巢生长和最终的囊肿形成[79,82-84]。高血糖诱导的胰岛素抵抗可能会增加PCOS形态的频率[82]。高血糖诱导的AGEs可能通过引起有利于早期绝经的卵泡发生异常而进一步影响卵巢功能[85]。
结论
作为全球糖尿病流行病的反映,表现出生殖和并发症的患者激增。神经病变,血管病变,氧化应激和心理偏差是继发性疾病背后的主要因素。男性糖尿病患者可能表现出勃起功能障碍,射精功能障碍,性腺机能减退,精子改良和青春期延迟。由于心理社会成分和抑郁情绪的影响较大,女性生殖并发症更难以界定,而男性并发症与心肺功能,代谢综合征和糖尿病的生理后遗症更相关。女性可能表现出性腺机能减退,性欲减退,性交困难,月经功能障碍和多囊卵巢综合征。
男性和女性最大的抱怨分别是勃起功能障碍和性欲减退症。由于性反应的生理和心理状态之间的复杂和模糊的关系,很难测量女性的生殖器唤醒。与男性不同,尽管缺乏唤醒(并因此润滑),女性仍然可以进行性交,因此身体功能障碍必须很高并且在变得明显之前依赖于耐受水平。
适当的心理咨询和克服与配偶和医疗保健提供者讨论性行为的耻辱感将有助于患者获得改善性健康的生理和心理方面所需的治疗或治疗。关于糖尿病女性性功能障碍的研究很少;女性性功能障碍需要被分解为个体探索的组成部分,而不是一个总括性术语。增加体力活动,及时发现和治疗抑郁症,及早发现勃起功能障碍以预防慢性血管病变并发症,对于控制糖尿病和提高患者的生活质量是有用的[86]。生活方式选择的改善可能有助于消除代谢并发症,但慢性损伤可能并不可逆。
利益冲突
作者声明没有利益冲突,无论是财务利益还是其他方面。
致谢
作者感谢Drs。 Todd Miller和Peter Brink为部门支持,以及Wendy Isser夫人和Grace Garey女士进行文献检索。
REFERENCES
[1] Federation ID. IDF Diabetes Atlas. 6th ed. Brussels, Belgium: 2013.
[2] Kim BH, Son SM. Mechanism of developing diabetic vascular complication by oxidative stress. J Korean Endocr Soc 2006; 21(6): 448-59.
[3] Skrha J. Pathogenesis of angiopathy in diabetes. Acta Diabetol 2003; (40 Suppl 2): S324-9.
[4] Orasanu G, Plutzky J. The pathologic continuum of diabetic vascular disease. J Am Coll Cardiol 2009; 53(5 Suppl): S35-42.
[5] Nukada H. Ischemia and diabetic neuropathy. Handb Clin Neurol 2014; 126: 469-87.
[6] Duby JJ, Campbell RK, Setter SM, White JR, Rasmussen KA. Diabetic neuropathy: An intensive review. Am J Health Syst Pharm 2004; 61(2): 160-73; Quiz 75-6.
[7] Vinik A, Ullal J, Parson HK, Casellini CM. Diabetic neuropathies: Clinical manifestations and current treatment options. Nat Clin Pract Endocrinol Metab 2006; 2(5): 269-81.
[8] Li C, Bunner AE, Pippin JJ. From animal models to clinical practicality: Lessons learned from current translational progress of diabetic peripheral neuropathy: INTECH Open Access Publisher; 2013.
[9] Said G. Diabetic neuropathy-A review. Nat Clin Pract Neurol 2007; 3(6): 331-40.
[10] Enzlin P, Mathieu C, Van Den Bruel A, Vanderschueren D, Demyttenaere K. Prevalence and predictors of sexual dysfunction in patients with type 1 diabetes. Diabetes Care 2003; 26(2): 409-14.
[11] Rutte A, van Splunter MM, van der Heijden AA , et al. Prevalence and correlates of sexual dysfunction in men and women with type 2 diabetes. J Sex Marital Ther 2015; 41(6): 680-90.
[12] Vinik A, Richardson D. Erectile dysfunction in diabetes: Pills for penile failure. Clin Diabetes 1998; 16(3).
[13] Patel DV, Halls J, Patel U. Investigation of erectile dysfunction. Br J Radiol 2012; 85 Spec No 1: S69-78.
[14] Gaunay G, Nagler HM, Stember DS. Reproductive Sequelae of Diabetes in Male Patients. Endocrinol Metab Clin North Am 2013; 42(4): 899-914.
[15] Fedder J, Kaspersen MD, Brandslund I, Hojgaard A. Retrograde ejaculation and sexual dysfunction in men with diabetes mellitus: A prospective, controlled study. Andrology 2013; 1(4): 602-6.
[16] Kamischke A, Nieschlag E. Update on medical treatment of ejaculatory disorders. Int J Androl 2002; 25(6): 333-44.
[17] Revenig L, Leung A, Hsiao W. Ejaculatory physiology and pathophysiology: Assessment and treatment in male infertility. Transl Androl Urol 2014; 3(1): 41-9.
[18] Fode M, Krogh-Jespersen S, Brackett NL, Ohl DA, Lynne CM, Sonksen J. Male sexual dysfunction and infertility associated with neurological disorders. Asian J Androl 2012; 14(1): 61-8.
[19] Corona G, Mannucci E, Petrone L , et al. Association of hypogonadism and type II diabetes in men attending an outpatient erectile dysfunction clinic. Int J Impot Res 2006; 18(2): 190-7.
[20] Dinulovic D, Radonjic G. Diabetes mellitus/male infertility. Arch Androl 1990; 25(3): 277-93.
[21] Tamas V, Kempler P. Sexual dysfunction in diabetes. Handb Clin Neurol 2014; 126: 223-32.
[22] Giugliano F, Maiorino M, Bellastella G, Gicchino M, Giugliano D, Esposito K. Determinants of erectile dysfunction in type 2 diabetes. Int J Impot Res 2010; 22(3): 204-9.
[23] Nehra A, Moreland RB. Neurologic erectile dysfunction. Urol Clin N Am 2001; 28(2): 289-308.
[24] Moreland RB. Is there a role of hypoxemia in penile fibrosis: A viewpoint presented to the Society for the Study of Impotence. Int J Impot Res 1998; 10(2): 113-20.
[25] Jiaan DB, Seftel AD, Fogarty J , et al. Age-related increase in an advanced glycation end product in penile tissue. World J Urol 1995; 13(6): 369-75.
[26] Burchardt M, Burchardt T, Chen MW , et al. Expression of messenger ribonucleic acid splice variants for vascular endothelial growth factor in the penis of adult rats and humans. Biol Reprod 1999; 60(2): 398-404.
[27] Takahashi K, Ghatei MA, Lam HC, O'Halloran DJ, Bloom SR. Elevated plasma endothelin in patients with diabetes mellitus. Diabetologia 1990; 33(5): 306-10.
[28] Hecht MJ, Neundorfer B, Kiesewetter F, Hilz MJ. Neuropathy is a major contributing factor to diabetic erectile dysfunction. Neurol Res 2001; 23(6): 651-4.
[29] Cellek S, Cameron NE, Cotter MA, Fry CH, Ilo D. Microvascular dysfunction and efficacy of PDE5 inhibitors in BPH-LUTS. Nat Rev Urol 2014; 11(4): 231-41.
[30] Colakoglu Z, Kutluay E, Ertekin C, Altay B, Killi R, Alkis A. Autonomic nerve involvement and venous leakage in diabetic men with impotence. BJU Int 1999; 83(4): 453-6.
[31] Mills T, Reilly C, Lewis R. Androgens and penile erection: A review. J Androl 1996; 17(6): 633-8.
[32] Traish AM, Goldstein I, Kim NN. Testosterone and erectile function: from basic research to a new clinical paradigm for managing men with androgen insufficiency and erectile dysfunction. Eur Urol 2007; 52(1): 54-70.
[33] Kautzky-Willer A, Harreiter J, Pacini G. Sex and gender differences in risk, pathophysiology and complications of type 2 diabetes mellitus. Endocr Rev 2016; 37(3): 278-316.
[34] El-Sakka AI, Sayed HM, Tayeb KA. Type 2 diabetes-associated androgen alteration in patients with erectile dysfunction. Int J Androl 2008; 31(6): 602-8.
[35] Corona G, Petrone L, Mannucci E , et al. Assessment of the relational factor in male patients consulting for sexual dysfunction: The concept of couple sexual dysfunction. J Androl 2006; 27(6): 795-801.
[36] Kapoor D, Clarke S, Stanworth R, Channer KS, Jones TH. The effect of testosterone replacement therapy on adipocytokines and C-reactive protein in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2007; 156(5): 595-602.
[37] Cohen P. The hypogonadal-obesity cycle: Role of aromatase in modulating the testosterone-estradiol shunt-a major factor in the genesis of morbid obesity. Medical Hypotheses 1999; 52(1): 49-51.
[38] Isidori AM, Caprio M, Strollo F , et al. Leptin and androgens in male obesity: Evidence for leptin contribution to reduced androgen levels. J Clin Endocrinol Metab 1999; 84(10): 3673-80.
[39] Kalyani RR, Dobs AS. Androgen deficiency, diabetes, and the metabolic syndrome in men. Curr Opin Endocrinol Diabetes Obes 2007; 14(3): 226-34.
[40] Brüning JC, Gautam D, Burks DJ , et al. Role of brain insulin receptor in control of body weight and reproduction. Science 2000; 289(5487): 2122-5.
[41] Ayuob NN, Murad HA, Ali SS. Impaired expression of sex hormone receptors in male reproductive organs of diabetic rat in response to oral antidiabetic drugs. Folia Histochem Cytobiol 2015; 53(1): 35-48.
[42] Faerman I, Vilar O, Rivarola M , et al. Impotence and diabetes: Studies of androgenic function in diabetic impotent males. Diabetes 1972; 21(1): 23-30.
[43] Padrón RS, Dambay A, Suárez R, Más J. Semen analyses in adolescent diabetic patients. Acta Diabetol Lat 1984; 21(2): 115-21.
[44] Baccetti B, la Marca A, Piomboni P , et al. Insulin-dependent diabetes in men is associated with hypothalamo-pituitary derangement and with impairment in semen quality. Hum Reprod 2002; 17(10): 2673-7.
[45] Dhindsa S, Prabhakar S, Sethi M, Bandyopadhyay A, Chaudhuri A, Dandona P. Frequent occurrence of hypogonadotropic hypogonadism in type 2 diabetes. J Clin Endocrinol Metab 2004; 89(11): 5462-8.
[46] Mallidis C, Agbaje I, McClure N, Kliesch S. Einfluss des Diabetes mellitus auf die Fertilität des Mannes. Der Urologe A 2011; 50(1): 33-7.
[47] Karimi J, Goodarzi M, Tavilani H, Khodadadi I, Amiri I. Increased receptor for advanced glycation end products in spermatozoa of diabetic men and its association with sperm nuclear DNA fragmentation. Andrologia 2012; 44(S1): 280-6.
[48] Agbaje I, McVicar C, Schock B , et al. Increased concentrations of the oxidative DNA adduct 7, 8-dihydro-8-oxo-2-deoxyguanosine in the germ-line of men with type 1 diabetes. Reprod Biomed Online 2008; 16(3): 401-9.
[49] La Vignera S, Condorelli RA, Di Mauro M , et al. Reproductive function in male patients with type 1 diabetes mellitus. Andrology 2015; 3(6): 1082-7.
[50] Mazzilli R, Imbrogno N, Elia J , et al. Sexual dysfunction in diabetic women: Prevalence and differences in type 1 and type 2 diabetes mellitus. Diabetes Metab Syndr Obes 2015; 8: 97-101.
[51] Wallner LP, Sarma AV, Kim C. Sexual functioning among women with and without diabetes in the Boston Area Community Health Study. J Sex Med 2010; 7(2 Pt 2): 881-7.
[52] Nowosielski K, Drosdzol A, Sipinski A, Kowalczyk R, Skrzypulec V. Diabetes mellitus and sexuality-does it really matter? J Sex Med 2010; 7(2 Pt 1): 723-35.
[53] Satta E, Magno C, Gali A , et al. Sexual dysfunction in women with diabetic kidney. Int J Endocrinol 2014; 2014: 346834.
[54] Elyasi F, Kashi Z, Tasfieh B, Bahar A, Khademloo M. Sexual dysfunction in women with type 2 diabetes mellitus. Iran J Med Sci 2015; 40(3): 206-13.
[55] Enzlin P, Mathieu C, Demytteanere K. Diabetes and female sexual functioning: A state-of-the-art. Diabetes Spectrum 2003; 16(4): 256-9.
[56] Wylie K, Malik F. Review of drug treatment for female sexual dysfunction. Int J STD AIDS 2009; 20(10): 671-4.
[57] Allahdadi KJ, Tostes RC, Webb RC. Female sexual dysfunction: Therapeutic options and experimental challenges. Cardiovasc Hematol Agents Med Chem 2009; 7(4): 260-9.
[58] Bargiota A, Dimitropoulos K, Tzortzis V, Koukoulis GN. Sexual dysfunction in diabetic women. Hormones (Athens) 2011; 10(3): 196-206.
[59] Meeking DR, Fosbury JA, Cummings MH. Sexual dysfunction and sexual health concerns in women with diabetes. Practical Diabetes 2013; 30(8): 327-31.
[60] Nowier A, Esmat M, Hamza RT. Surgical and functional outcomes of sigmoid vaginoplasty among patients with variants of disorders of sex development. Int Braz J Urol 2012; 38(3): 380-6; discussions 7-8.
[61] Codner E, Escobar-Morreale HF. Clinical review: Hyperandrogenism and polycystic ovary syndrome in women with type 1 diabetes mellitus. J Clin Endocrinol Metab 2007; 92(4): 1209-16.
[62] Nandi A, Poretsky L. Diabetes and the female reproductive system. Endocrinol Metab Clin North Am 2013; 42(4): 915-46.
[63] Codner E, Merino PM, Tena-Sempere M. Female reproduction and type 1 diabetes: From mechanisms to clinical findings. Hum Reprod Update 2012; 18(5): 568-85.
[64] Pal L, Chu HP, Shu J, Topalli I, Santoro N, Karkanias G. In vitro evidence of glucose-induced toxicity in GnRH secreting neurons: High glucose concentrations influence GnRH secretion, impair cell viability, and induce apoptosis in the GT1-1 neuronal cell line. Fertil Steril 2007; 88(4 Suppl): 1143-9.
[65] Volpi R, Chiodera P, Capretti L , et al. Effect of residual endogenous insulin secretion on the abnormal oxytocin response to hypoglycaemia in insulin-dependent diabetics. J Intern Med 1998; 244(1): 43-8.
[66] Djursing H, Hagen C, Andersen AN, Svenstrup B, Bennett P, Molsted PL. Serum sex hormone concentrations in insulin dependent diabetic women with and without amenorrhoea. Clin Endocrinol (Oxf) 1985; 23(2): 147-54.
[67] South SA, Asplin CM, Carlsen EC , et al. Alterations in luteinizing hormone secretory activity in women with insulin-dependent diabetes mellitus and secondary amenorrhea. J Clin Endocrinol Metab 1993; 76(4): 1048-53.
[68] Arrais RF, Dib SA. The hypothalamus-pituitary-ovary axis and type 1 diabetes mellitus: A mini review. Hum Reprod 2006; 21(2): 327-37.
[69] Mioi J, Car N, Metelko . Sexual dysfunction in women with diabetes mellitus. Diabetol Croat 2008; 37: 2.
[70] Woodard TL, Diamond MP. Physiologic measures of sexual function in women: A review. Fertil Steril 2009; 92(1): 19-34.
[71] Rockliffe-Fidler C, Kiemle G. Sexual function in diabetic women: A psychological perspective. Sex Relation Ther 2003; 18(2): 143- 59.
[72] Giraldi A, Kristensen E. Sexual dysfunction in women with diabetes mellitus. J Sex Res 2010; 47(2): 199-211.
[73] Park K, Ahn K, Chang JS, Lee S-E, Ryu SB, Park YI. Diabetes induced alteration of clitoral hemodynamics and structure in the rabbit. J Urol 2002; 168(3): 1269-72.
[74] Bargiota A, Dimitropoulos K, Tzortzis V, Koukoulis GN. Sexual dysfunction in diabetic women. Hormones (Athens) 2011; 10(3): 196-206.
[75] Schweiger BM, Snell-Bergeon JK, Roman R, McFann K, Klingensmith GJ. Menarche delay and menstrual irregularities persist in adolescents with type 1 diabetes. Reprod Biol Endocrinol 2011; 9: 61.
[76] Salonia A, Lanzi R, Scavini M , et al. Sexual function and endocrine profile in fertile women with type 1 diabetes. Diabetes Care 2006; 29(2): 312-6.
[77] Codner E, Soto N, Lopez P , et al. Diagnostic criteria for polycystic ovary syndrome and ovarian morphology in women with type 1 diabetes mellitus. J Clin Endocrinol Metab 2006; 91(6): 2250-6.
[78] Poretsky L, Kalin M. The gonadotropic function of insulin. Endocr Rev 1987; 8(2): 132-41.
[79] Poretsky L, Cataldo NA, Rosenwaks Z, Giudice LC. The insulinrelated ovarian regulatory system in health and disease. Endocr Rev 1999; 20(4): 535-82.
[80] Sirotkin AV. Growth factors controlling ovarian functions. J Cell Physio 2011; 226(9): 2222-5.
[81] Willis D, Mason H, Gilling-Smith C, Franks S. Modulation by insulin of follicle-stimulating hormone and luteinizing hormone actions in human granulosa cells of normal and polycystic ovaries. J Clin Endocrinol Metab 1996; 81(1): 302-9.
[82] Poretsky L, Clemons J, Bogovich K. Hyperinsulinemia and human chorionic gonadotropin synergistically promote the growth of ovarian follicular cysts in rats. Metabolis 1992; 41(8): 903-10.
[83] Hsueh AJ, Billig H, Tsafriri A. Ovarian follicle atresia: A hormonally controlled apoptotic process* Endocr Rev 1994; 15(6): 707-24.
[84] Kezele PR, Nilsson EE, Skinner MK. Insulin but not insulin-like growth factor-1 promotes the primordial to primary follicle transition. Mol Cell Endocrinol 2002; 192(1): 37-43.
[85] Diamanti-Kandarakis E, Piperi C, Patsouris E , et al. Immunohistochemical localization of advanced glycation endproducts (AGEs) and their receptor (RAGE) in polycystic and normal ovaries. Histochem Cell Biol 2007; 127(6): 581-9.
[86] Pozzo MJ, Mociulsky J, Martinez ET , et al. Diabetes and quality of life: Initial approach to depression, physical activity, and sexual dysfunction. Am J Ther 2016; 23(1): e159-71.