文献DOI:10.1002/mnfr.201200608
文献PMID:23293044
文献原文链接:http://doi.org.sci-hub.tw/10.1002/mnfr.201200608
Mol. Nutr. Food Res. 2013, 57, 114–125
Review:《Direct and indirect antioxidant properties of -lipoic acid and therapeutic potential》
综述:抗氧化剂硫辛酸直接和间接的治疗潜力
【Abstract】
Diabetes has emerged as a major threat to worldwide health. The exact mechanisms underlying the disease are unknown; however, there is growing evidence that the excess generation of reactive oxygen species (ROS) associated with hyperglycemia, causes oxidative stress in a variety of tissues. In this context, various natural compounds with pleiotropic actions like -lipoic acid (LA) are of interest, especially in metabolic diseases such as diabetes. LA, either as a dietary supplement or a therapeutic agent, modulates redox potential because of its ability to match the redox status between different subcellular compartments as well as extracellularly. Both the oxidized (disulfide) and reduced (di-thiol: dihydro-lipoic acid, DHLA) forms of LA show antioxidant properties. LA exerts antioxidant effects in biological systems through ROS quenching but also via an action on transition metal chelation. Dietary supplementation with LA has been successfully employed in a variety of in vivo models of disease associated with an imbalance of redox status: diabetes and cardiovascular diseases. The complex and intimate association between increased oxidative stress and increased inflammation in related disorders such as diabetes, makes it difficult to establish the temporal sequence of the relationship.
摘要翻译:
糖尿病已成为全球健康的主要威胁,这种疾病的确切机制尚不清楚。然而,越来越多的证据表明,与高血糖相关的过量产生的活性氧(ROS)会在各种组织中引起氧化应激。在这种情况下,具有多效作用的各种天然化合物如硫辛酸(LA)是令人感兴趣的,尤其是在诸如糖尿病的代谢疾病中。 LA作为膳食补充剂或治疗剂,由于其能够匹配不同亚细胞区室之间以及细胞外的氧化还原状态,因此调节氧化还原电位。 LA的氧化(二硫化物)和还原的(二硫醇:二氢 - 硫辛酸,DHLA)形式都显示出抗氧化性质。 LA通过ROS猝灭在生物系统中发挥抗氧化作用,但也通过过渡金属螯合作用发挥作用。 LA的膳食补充剂已成功用于与氧化还原状态不平衡相关的各种体内疾病模型:糖尿病和心血管疾病。在诸如糖尿病的相关病症中,增加的氧化应激和增加的炎症之间的复杂且紧密的关联使得难以确定关系的时间顺序。
【节选】
LA,DHLA对细胞葡萄糖的影响
摄取LA对胰岛素响应细胞氧化还原状态影响的机理研究表明,LA通过影响胰岛素信号通路的成分来刺激葡萄糖摄取。 LA在葡萄糖转运蛋白类型易位和内在活性调节时刺激葡萄糖摄取,这种作用可能由p38丝裂原活化蛋白激酶介导[55]。有证据表明胰岛素信号通路对氧化还原状态敏感,在胰岛素异常和胰岛素抵抗的背景下检查LA和DHLA的作用,据报道,LA可增加胰岛素敏感[56]和胰岛素抵抗肌肉组织中的葡萄糖摄取[57]。已经证实[58]对肥胖动物施用LA增加了全身胰岛素刺激的葡萄糖摄取。
除了这些效应之外,最近已经表明,在分离的工作大鼠心脏中,LA刺激葡萄糖氧化而不影响糖酵解,乳酸氧化或棕榈酸氧化[59]。在分化的3T3-L1脂肪细胞中,R-LA和氧化同种型通过引起细胞内氧化还原状态变化的机制有效刺激葡萄糖转运,LA还通过可能涉及 - 和 - 亚基中半胱氨酸残基氧化的机制促进胰岛素受体的自磷酸化[24,52]。 肌肉细胞系的研究表明,暴露于LA通过GLUT1和葡萄糖转运蛋白类型向质膜的重新分布以及胰岛素受体底物-1的酪氨酸磷酸化来刺激葡萄糖摄取[55]。 在II型糖尿病中,有证据表明LA可改善胰岛素抵抗和外周葡萄糖代谢受损[60,61]。
LA和DHLA对线粒体代谢的影响
线粒体经常进行裂变和融合以适应细胞的变化条件,并且已经报道了各种心血管疾病中的线粒体功能障碍。线粒体也是细胞死亡的重要调节因子。切换到细胞死亡程序可以通过线粒体内膜中线粒体通透性转换孔(mPTP)的开放来介导[62]。这个大孔允许分子量高达1.5kDa的组分扩散通过内膜,这导致外膜破裂和促凋亡因子的释放。孔隙受促氧化剂的影响,氧化剂通过氧化吡啶核苷酸刺激mPTP开放;硫醇[63]和抗氧化剂减少SH集团[64]。
矛盾的是,浓度在0.01-0.1mM之间的LA和DHLA促进mPTP开放。尽管是二硫醇,DHLA比LA更有效,这表明LA的另一种机制不是氧化。在一些抗氧化剂存在下,DHLA诱导的mPTP开放受到抑制,并且这种抑制支持ROS参与mPTP刺激机制[65,66]。这一发现与LA或DHLA在细胞和组织中的强抗氧化能力形成对比。在牛心脏线粒体中,使用电子顺磁共振研究了DHLA对O2• - 产生的刺激[67]。两种自由基清除剂:BHT和TEMPO降低了DHLA诱导的信号增加。在存在两种不同底物的情况下在线粒体中观察到超氧化物的产生:琥珀酸盐或丙酮酸盐。这些作用尚未完全了解,但其机制可归因于依赖于泛半醌的DHLA氧化成硫基,其将能够通过自动氧化产生超氧化物。线粒体是促氧化剂的主要细胞内来源,并且对氧化还原状态的变化具有可逆反应[4]。现在有证据表明,线粒体克雷布斯循环酶 - 酮戊二酸脱氢酶(KGDH)是线粒体抗氧化系统的一个组成部分,也是氧化还原状态的关键传感器。它诱导线粒体和细胞代谢的关键变化,以防止氧化损伤[68]。 KGDH对氧化应激具有独特的敏感性,能够进行完全可逆的自由基介导的抑制。 LA是β-酮酸脱氢酶复合物的E2组分的必需辅助因子,其仅位于线粒体中,例如,丙酮酸脱氢酶、KGDH和支链 - 酮酸脱氢酶复合物。前者催化丙酮酸的氧化羧化,并在碳水化合物代谢和生物能量学中发挥重要作用,丙酮酸脱氢酶与厌氧和有氧能量代谢相结合。总之,R-LA似乎是四种酶复合物的辅助因子,这四种酶复合物专门位于线粒体中,对于能量产生和碳水化合物和蛋白质代谢的调节至关重要。总之,LA调节涉及能量稳态的线粒体过程;最近在脂肪肝中研究了这种效应[69]。
LA和DHLA作为心血管疾病的治疗方法
1、对内皮血管细胞的影响
内皮功能障碍包括内皮依赖性血管舒张功能受损和内皮细胞活化增加,导致心血管疾病如高血压、动脉粥样硬化和糖尿病血管病变的病理生理学。糖尿病的微血管并发症,包括肾病、视网膜病和神经病,是糖尿病的常见表现。这些病症中内皮表型的变化响应于包括炎性细胞因子、高脂血症和高血糖在内的多种刺激而发生。 ROS的产生增加涉及内皮表型的这些改变的发生,并且内皮功能障碍主要反映NO的可用性降低。血管内皮是新疗法的潜在重要靶点。已经在体外和体内研究了LA治疗对内皮功能的影响。
人体中LA的治疗剂量范围为200至1800mg /天。正如我们之前报道的那样,血浆中外消旋LA的半衰期为30分钟,LA的内源血浆水平在15-20M之间。鉴于其潜在的抗氧化特性,已经在心血管疾病中测试了LA补充剂可能带来的健康益处。导致动脉粥样硬化、糖尿病和高血压发展的一个常见因素是与慢性炎症相关的ROS的过量产生。
心血管疾病的大多数风险标志物包括促进内皮细胞活性分子释放的促炎成分。Jones等人[70]研究了LA在培养的人内皮细胞中的摄取,减少和抗氧化作用。 LA / DHLA氧化还原对增强了抗氧化防御和这些细胞的功能,从而保留了人体内一氧化氮依赖性血管舒张[71]。由于氧化应激可引起内皮功能障碍,因此已经测试了LA的相互作用及其功效,以预防EA-hy926细胞中的氧化损伤,EA-hy926细胞是源自人脐静脉内皮细胞与人肺癌融合的细胞系细胞[72]。这些细胞保留内皮细胞特征,包括人LDL的氧化修饰和钙依赖性内皮细胞一氧化氮合酶活化。
通过将这些细胞与LDL和铜一起孵育产生的细胞外氧化应激引起细胞和LDL的脂质过氧化的时间依赖性增加,之前LDL中的生育酚消失, LA(40-80 M)减弱了这些影响。大量证据表明,ROS引起的血管功能障碍是糖尿病的主要特征之一;这种ROS积累状态与受损的内皮依赖性NO代谢密切相关。最近的研究表明,LA引起的内皮功能改善至少部分归因于内皮型一氧化氮合酶的重新结合和NO生物利用度的提高[73]。用L-精氨酸的胍基取代类似物抑制NOS活性位点阻断NO的合成,例如在血浆和各种组织中发现的天然存在的氨基酸不对称二甲基精氨酸(ADMA)[74]。
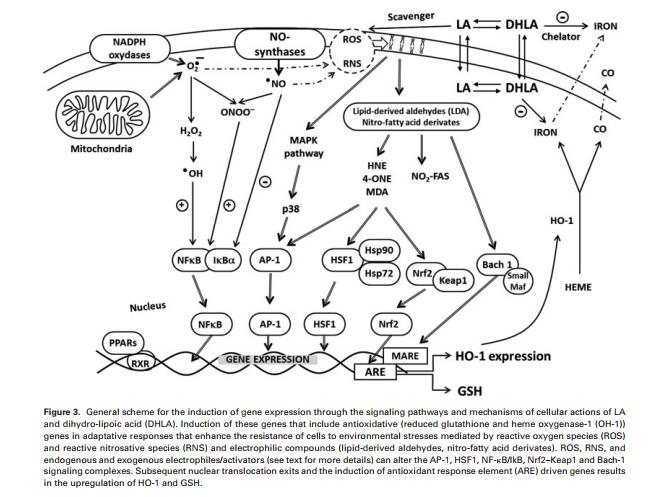
在大多数研究中,人和大鼠的血浆ADMA水平为0.3至0.5 mmol / L [75]。内皮功能障碍因各种心血管危险因素、代谢疾病和全身或局部炎症而增加。与内皮功能障碍的发展有关的一种机制是存在升高的ADMA水平。在该领域,我们的研究表明,果糖饮食诱导的血压和葡萄糖升高伴随着iNOS的早期过度表达和氧化应激的增加。我们的研究结果表明,观察到的ADMA水平升高可能部分地继发于氧化应激的早期发展[76]。 ADMA浓度的增加可预测包括糖尿病患者在内的不同人群的心血管事件[77,78]。在培养的内皮细胞中,已经证明LA通过增加DDAH II mRNA表达和DDAH活性来降低ADMA水平[79]。有人提出DDAH活性受氧化应激的影响。实际上,具有抗氧化特性的药物如普罗布考可增加DDAH活性[80]。根据这些发现,人们可以假定LA诱导的DDAH活性增加部分是由其抗氧化特性介导的。最近,LA在不同组织中的抗氧化机制受到了极大的关注。因此,LA / DHLA氧化还原对影响生物过程,包括酶和受体的活性以及基因转录的调节[81-85]。
预防和治疗糖尿病
1、LA和糖尿病视网膜病变
糖尿病性视网膜病变(DR)是糖尿病最常见的并发症之一,并且是工业化国家工作年龄人群失明的主要原因。大约25%的1型糖尿病患者可能有视网膜病变的迹象[86]; DR患病率在2型糖尿病患者中非常重要(1993年进行的研究中为39%)[87]。 DR的特征在于糖尿病的微血管并发症。疾病早期的血管改变包括血流改变、视网膜周细胞死亡和血管通透性的微妙增加[88]。糖尿病引起视网膜微血管并发症和疾病进展的机制尚不完全清楚。然而,研究表明DR具有慢性炎症的特征。炎症是身体对病原体的防御,也是伤口愈合的关键步骤。该过程涉及多种介质,例如促炎细胞因子、趋化因子和粘附分子,其启动白细胞和内皮之间的相互作用。中性粒细胞的积累与血管中细胞间粘附分子-1免疫反应性的上调相关,并与毛细血管闭合有关[89]。白细胞介素-6,细胞间粘附分子-1和血管细胞粘附分子-1的增加已显示与DR的进展相关。虽然正常的炎症是有益的,但过度或不受控制的炎症会导致组织损伤[90,91]。DR的危险因素包括高血糖、高血压和血脂异常。这些因素通过不同机制与炎症相关,包括氧化应激、NOS失调和晚期糖基化终产物的形成[92]。总体而言,这些变化导致ROS的净增加,并且糖尿病诱导的持续氧化应激是视网膜炎症的主要原因。在我们的实验室中,我们证明了糖尿病患者血浆清除能力下降。在2型糖尿病患者中注意到血浆维生素C的显著降低和抗坏血酸基自由基/维生素C比率的增加。我们的研究结果表明,我们在糖尿病患者中报道可能使用AFR /维生素C比值作为氧化应激的指标[93]。在最近几年,我们证明了视网膜中存在大量的ROS来源,氧化损伤的程度将取决于抗氧化系统的效率。在高血压的发展过程中可能会遇到视网膜并发症,这是对氧化应激的反应[2]。慢性氧化损伤的终生积累将导致视网膜细胞功能障碍,并增加其对外源性和内源性损伤如缺血的易感性[2,94,95]。
最近报道了一项大型临床研究(RETIPON)。目的是评估LA对预防糖尿病性黄斑水肿的作用[96]。患者被随机分配(235名患有II型糖尿病的患者)至治疗组,每天600mg LA或安慰剂组。每6个月记录立体眼底照片,HbA1c水平和眼科检查。主要终点是在2年的随访期内发生临床显著的黄斑水肿。600mg LA的每日剂量不能预防糖尿病患者中临床上显著的黄斑水肿的发生。
2、LA治疗是否可以预防或延缓糖尿病并发症的发生?
在糖尿病受试者和糖尿病动物模型中的许多试验已经试图确定LA治疗是否可以预防或延迟糖尿病并发症的发作。正如最近的综述[97-99]所详述的,已经证明LA在几种实验条件下在预防和治疗糖尿病方面具有许多有益效果。
然而,所有动物研究的一般问题是LA的最佳剂量的选择和抗氧化剂维生素的物种特异性代谢。在患者身上的结果是矛盾的[29]。相反,LA在治疗症状性糖尿病神经病变中具有有益的效果,这是一个主要促进健康方面。获得接近正常血糖的葡萄糖水平是预防糖尿病神经病变的主要方法,但是这些血糖目标在许多患者中是不可实现的。已经完成七项糖尿病神经病变患者LA的随机对照临床试验(α-硫辛酸:糖尿病神经病变:Dekan;口服试验:Orpil;症状性糖尿病神经病变:SYDNEY;硫辛酸在神经病变中的神经学评估:Nathan II)。这些试验使用了不同的研究设计、持续时间、剂量和患者人群。对这些试验进行了全面分析,荟萃分析(n = 1258)对600 mg LA i.v.的疗效和安全性进行了精确评估,是在患有症状性多发性神经病的糖尿病患者中持续3周[100]。还研究了保护人LDL免受LA的糖化作用;这种效应具有临床意义,因为糖尿病患者的动脉粥样硬化发生率高于非糖尿病患者[101]。此外,据报道,LA与白蛋白的非共价疏水结合参与其保护作用。最后,目前大多数可用的疗法是症状性的(专注于缓解疼痛)而不是改善疾病。除了良好的血糖控制外,目前还没有有效的治疗来减缓糖尿病多发性神经病的进展或逆转。认识到扭转既定DN的困难已经集中在减缓其进展的努力[102]。
3、预防和治疗高血压
在实验条件下也研究了LA对高血压的保护作用。由于有强有力的证据表明过量饮食中的NaCl与高血压的发展有关,Vasdev等人 [103]确定给予盐敏感大鼠500 mg / kg LA的膳食补充剂是否可以降低血压。结果表明,LA的膳食补充剂减弱了收缩动脉压的增加。 LA还可有效预防盐诱导的高血压大鼠组织醛结合物和细胞内Ca2 +的增加[104]。 LA的抗高血压作用与主动脉中氧化应激的减弱和饮用水中接受10%D葡萄糖的大鼠血浆中谷胱甘肽过氧化物酶活性的保持有关[105]。在这些实验条件下,LA的膳食补充剂阻止了收缩压的升高和胰岛素抵抗的发展,如更高的稳态模型评估所反映的。最近的研究表明,氧化应激可能是高血压和高血糖的破坏作用的统一因素,LA的心血管保护似乎与其抗氧化特性有关[85,106]。这些研究的结果扩展了我们对抗氧化剂在心血管疾病中作用的理解[84,107]。
结论:保护心血管功能的观点
迄今为止,还没有令人信服的证据表明营养或药物制剂可以预防化疗诱导的心肌病的发生或发展。 ROS的形成和钙稳态的失调都与蒽环类相关毒性的发生有关[108-110],其中铁螯合剂不能提供最佳保护。使用LA治疗神经病变表明这种药物可能是有助于保护接受化疗的患者。事实上,一个小案例系列表明LA可能改善化疗引起的神经病[111],至少,LA可能是治疗这些神经系统副作用的其他经验疗法的合理补充[112,113]。
总之,生物硫醇抗氧化剂LA及其代谢物DHLA受到了极大的关注,因为它们有效地保护细胞免受ROS诱导的损伤。因此,LA / DHLA氧化还原对影响重要的生物学过程,包括基因转录的调节和酶和受体的活性。我们认为,迄今为止在一些临床试验中缺乏明显的有益效果并不能证明LA在不同人群中的临床实用性,包括糖尿病患者。然而,需要进行长期和彻底的临床研究以确认LA的治疗潜力。事实上,硫辛酸提供了有效和安全治疗的希望,可以预防糖尿病的破坏性后果。