BSTR倒数第二章讲述了异常情况下的细胞信号通路,提到了肿瘤细胞发展过程获得的六个关键能力,我查看了引用的文献 :
Hallmarks of Cancer: The Next Generation
虽然是2012年的文章,仍然非常受益,这里编辑了其中的重点内容分享给大家。
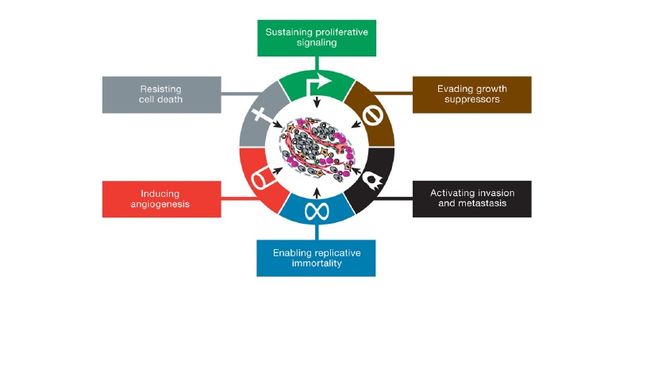
恶性肿瘤的形成需要具备六个可能先后获得的关键能力:持续生长、逃避生长抑制、抵抗死亡、不断自我复制、血管生成和侵袭、转移能力。隐藏在这六个里程碑背后的是肿瘤细胞基因组的不稳定性——为细胞加速成为肿瘤提供了基因水平上的基础。
近年来理论基础的发展又给肿瘤细胞增加了两个重要的关键能力:能量代谢的重组以及逃避免疫杀伤的能力。
除了肿瘤细胞之外,肿瘤组织本身也表现出另一个维度的复杂性: 一个肿瘤组织拥有很多可以补充的、表面上正常的细胞为其获得肿瘤全部特征而提供的“肿瘤微环境”。
先来看癌细胞的六个关键能力:
前面四个和生存相关——活下来;后面两个帮助肿瘤细胞开疆拓土。
[1]持续生长
正常细胞的增殖是受到严密调控的,而肿瘤细胞逆转了这种调控,成了自己命运的真正主宰。
肿瘤细胞通过四种途径实现持续生长:自分泌生长信号;刺激正常细胞分泌生长信号;增加受体表达,放大生长信号;改变受体的结构,使其一直处于被激活的状态。
随着近年来基因组测序的发展,我们了解了更多基因突变所引发的生长信号的增加。最典型的例子是人类恶性黑色素瘤中有40%的B-Raf存在突变,导致Raf-MAPK信号通路的持续应答。另一个例子是PI3K催化结构域突变使得PI3K处于高活性,从而导致Akt/PKB信号通路的高水平运转。
肿瘤细胞还会通过破坏信号通路中的负反馈机制而持续获得生长信号。一个典型的例子是ras原癌基因发生突变后,负反馈信号的传递也受到影响。另一个典型的例子是通过水解PIP3抑制PI3K活性的PTEN磷酸酶,当它发生突变丧失活性后,PI3K信号通路就会被放大。还有一个有趣的例子是mTOR激酶,它位于PI3K的下游,但是又能够通过负反馈抑制PI3K的活性。这就导致了一个后果,如果使用抑制剂抑制mTOR的活性,负反馈也会被抑制,从而上调PI3K信号通路,也就抵消了药物抑制mTOR所带来的效果。这种情况在细胞信号通路中并不少见,也许可以部分解释肿瘤细胞产生耐药性的原因。
还有一个值得一提的现象:过多的生长信号会引发细胞衰老——细胞活着,但却并不增殖。这意味着肿瘤细胞如果想要继续发展,就得获得对抗衰老甚至凋亡的能力。
[2]逃避生长抑制
说到抑制肿瘤细胞生长,就不得不提两个有名的抑癌基因,RB和TP53。它们通过阻断细胞的生长-分裂周期实现抑制细胞增殖的作用,不同的是,RB更多的地接受外来的信号,而TP53则更多感知细胞内部的压力。
近年来还发现了另外两个可以引发接触抑制的抑癌基因,NF2和LKB1。这也是肿瘤细胞进阶所需要跨越的一大障碍。此外,肿瘤细胞还会破坏TGF-β信号通路摆脱生长抑制。
[3]抵抗死亡
细胞的死亡包括程序性细胞死亡,也就是细胞凋亡,自噬和坏死。
细胞凋亡就像是细胞启动的自毁程序(细节可以参见前面的一篇文章),受到精确的调控,细胞内或细胞外的某些信号可以使之启动,是肿瘤细胞生长的一大障碍。为跨越这个障碍,肿瘤细胞可能需要改变凋亡的调控因子,比如TP53和Bcl-2/Bcl-xL。
自噬在某种情况下是肿瘤细胞面临的阻碍。当细胞面临巨大压力,比如营养不足、过氧化、辐射、细胞毒性药物等等,就会发生自噬。不过,如果肿瘤细胞逃过自噬、产生了抵抗力,自噬的发生反而能够促进肿瘤细胞的进展。而另一种细胞死亡途径,坏死,对肿瘤细胞的利弊也与之类似。甚至,坏死对正常细胞的伤害更大,其产生的免疫因子反而会促进肿瘤细胞的发展。
[4]不断自我复制的能力
DNA复制的机制决定了每轮复制之后都会丢失部分末端序列,所以DNA末端都存在一定长度的无意义端粒。不过,随着复制次数的增加,端粒会越来越短,当端粒保护不复存在,有意义的DNA序列就暴露在危险之下。这时细胞会进入衰老或者危机状态——肿瘤细胞前进的两大障碍。
需要不断复制的正常细胞(如生殖细胞)以及绝大部分自发形成的永生化细胞(包括肿瘤细胞)内都存在一种可以修复端粒的端粒酶。获得端粒酶是大部分肿瘤细胞跨越复制陷阱的重要手段。
不过近年来的研究发现,很多增殖相关信号异常,如原癌信号,甚至早于端粒的缩短即会触发衰老和危机。另一方面,肿瘤细胞获得端粒酶活性往往存在延迟,即前期抵抗端粒缩短的威胁,积累更多的突变,在后期获得端粒酶活性,从而稳固之前获得的基因突变。
随着研究深入,科学家发现端粒酶的作用甚至不主要在于维持端粒长度,其功能更多的和增殖相关。获得端粒酶活性对于肿瘤细胞发展的意义仍有待进一步的研究。
[5]血管生成
和正常组织一样,肿瘤也需要持续地养分供给和废物输出,这就要求其生成血管。成人在受伤修复或月经期间也会打开血管生成的开关,不过这是暂时的,而肿瘤进展过程中,血管生成一旦开启,基本不会关闭。
参与血管生成的关键分子中,VEGF和FGF促进其生成,而TSP-1其抑制作用。肿瘤细胞往往也是通过上调前两个分子的表达或者降低抑制分子的表达打开血管生成这个开关的。
不过肿瘤细胞仓促间生成的血管存在很多缺陷,典型的一点就是相比正常组织的血管,更易渗漏。这是很多纳米药物能够特异性针对肿瘤细胞的结构基础。
近年来研究发现,掺入肿瘤病灶的来自骨髓的各种免疫细胞,对肿瘤形成血管也起到了重要的支持作用,甚至直接变身血管祖细胞与血管支持细胞和上皮细胞相互作用。关于此方面的内容,下文肿瘤微环境一节还会详细讲述。
[6]侵袭、转移能力
成为命运主宰的肿瘤细胞,利用一切可以利用的材料,站稳脚跟,还搭建了自己的运输系统,不过,它的野心不止于此,它还要去到更远的地方。
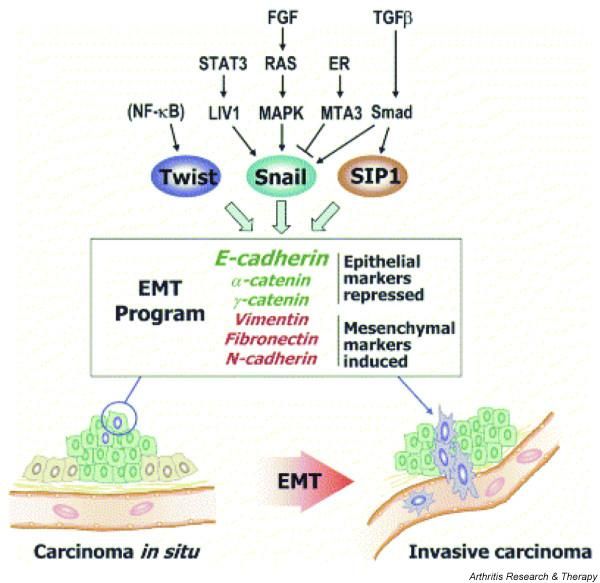
要去远方可不容易,肿瘤细胞得能变形,还要改变与环境的连接方式。上皮-钙黏蛋白以及N-钙黏蛋白都是肿瘤细胞钟爱的靶目标分子。
当然采用最广的方式还是EMT (上皮-间充质转移)。事实上,胚胎期器官形成以及伤口愈合采用的都是EMT系统,肿瘤细胞很善于学习。
EMT指的是具有极性的上皮细胞转化成具有移行能力的间质细胞,并获得侵袭和迁移能力的过程。研究发现,肿瘤细胞很有可能是部分地实现了EMT,因为到达靶细胞后,它还要再反过来,通过间质上皮细胞转化(MET)来重建细胞间连接。
除EMT之外,肿瘤细胞还会采用集体侵袭或变形虫的方式去到远方,这两种方式采用的信号通路还不是很清楚。
无论哪种方式,肿瘤细胞的转移都需要基质细胞以及免疫细胞的参与。
从一个地方到达另一个地方只是一小步,对肿瘤细胞而言,更大的难题在于:在新领域立稳脚跟、发展壮大。事实上,很多肿瘤细胞水土不服,栽在了新殖民地上。
这里又涉及到肿瘤细胞的微环境。
待续……