原文链接:Cell Metabolism 30, October 1, 2019. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. IF: 22.415
miRNAs可在血清和其他体液中发现,并可作为疾病的生物标志物。更重要的是,分泌型miRNAs,尤其是胞外囊泡(EVs)如外泌体分泌的miRNAs,可能介导不同组织间的旁分泌和内分泌通讯,从而调节基因表达和远程调控细胞功能。分泌型miRNAs受影响时可能会导致组织功能障碍、衰老和疾病。脂肪组织是循环外泌体miRNA的重要来源。在许多代谢条件下发生的脂肪组织质量或功能的改变可以导致循环miRNA的改变,从而引起机体一系列的功能改变。
这篇综述回顾了得出这些结论的研究,并讨论了如何为新的研究奠定基础,有助于进一步确定细胞外miRNA作为细胞间通讯的重要介质如何发挥强大作用。
综述分为以下几个部分:
- Introduction
- miRNAs Are More Mobile Than Expected
- 细胞外miRNAs的分泌和转运
- 细胞外miRNAs作为疾病生物标志物
- 细胞外miRNAs是代谢稳态的Housekeepers
- 挑战和远景
- 结论
引言
MicroRNAs (miRNAs)是由体内各种细胞产生的约22个nt的调节性非编码小RNA。许多miRNAs在进化过程中高度保守,尽管它们的多样性和数量与机体的复杂性相关。秀丽隐杆线虫的基因组包含437个miRNAs,小鼠超过1500个,而人类的miRNAs在2000到3000个之间(数据来自miRBase,第22版)。许多miRNAs可以无所不在地表达,而其他的则具有组织特异性。这种分布模式是由细胞内miRNA前体的转录和转录后调控所驱动的。
miRNAs的合成是包括很多步骤:在细胞核中,初级miRNAs(pri-miRNAs)被RNA聚合酶II转录,然后由微处理器复合物(内含核糖核酸内切酶DROSHA及其RNA binding partner DGCR8)或剪接机制的组件进行处理。这导致了约70个nt的pre-miRNAs,被XPO5和Ran GTPase输出到细胞质中。pre-miRNAs被III型核糖核酸内切酶DICER和RNA结合蛋白TRBP与PACT共同处理,产生双链miRNAs duplex。这些miRNAs duplex被加载到RNA诱导的沉默复合体(RISC),在RISC中,Argonaute-2 (AGO2)及其分子伴侣HSC70/HSP90介导双链miRNAs duplex的一条链与其靶mRNA结合(另一条链一般很快被降解了),抑制mRNA的翻译和/或加速mRNA的降解。也有一些miRNAs发挥非常规的相反作用:诱导转录和上调蛋白表达的。不依赖DICER的miRNA生成也有报道,但它们的影响有限。
与mRNAs类似,miRNA表达谱也可作为细胞标志物。例如,miR-122在肝脏中高度表达,占该组织中总miRNA表达量的70%。肌肉细胞中富含miR-1、miR-133a、miR-133b、miR-206、miR-208a、miR-208b、miR-486和miR-499,因此这些miRNAs被称为myomiRs;miR-9和miR-124几乎完全在大脑中表达,后者占了该组织中近50%的miRNA含量;而β细胞是唯一高丰度表达miR-375的细胞。另一方面,一些细胞,如脂肪细胞和干细胞,表达多种miRNAs。
miRNAs Are More Mobile Than Expected
为了理解miRNAs 的表达如何在特定细胞类型中促进该组织的发育和稳态,产生了多种细胞类型特异性DICER或DGCR8敲除小鼠。中枢神经系统、胰腺、骨骼肌和心肌的DICER敲除使小鼠不能成活或出现严重的发育缺陷。而肝脏特异性DICER敲除小鼠(LDicerKO)和脂肪细胞特异性敲除小鼠DICER (ADicerKO)或DGCR8 敲除小鼠(ADgcr8KO)在成年之前与野生型的幼鼠难以区分,直到它们开始出现代谢功能障碍。包括LDicerKO小鼠肝脂质沉着症和早发性肝细胞癌;ADicerKO和ADgcr8KO小鼠部分出现脂肪营养不良和胰岛素抵抗。许多表型是因为miRNAs生成受阻改变mRNA半衰期和细胞的翻译功能,但是有一些表型因为其他组织中基因表达和功能的变化引起的二级改变,提示细胞非自治组织miRNAs损失的影响。当ADicerKO小鼠移植正常脂肪组织后,其肝脏基因表达发生逆转,提示这些变化受脂肪组织分泌的miRNAs调控。这种现象产生一个假象:每个细胞的miRNAs是内源性miRNAs产生和外源性miRNAs摄取的总和。要证实这一假设,就需要发展稳健的技术来追踪miRNAs起源和运输。
细胞外miRNAs的分泌和转运
miRNAs可以通过囊泡转运和蛋白载体的机制被细胞输出和导入是miRNAs具有潜在的细胞和组织间通讯作用的强有力支持。这个概念最早是由Valadi等人在2007年提出的,他们在不同细胞系分泌的胞外囊泡(EVs)中识别出大量的mRNAs和miRNAs,这些囊泡可以被其他细胞吸收,然后将mRNAs和miRNAs释放到靶细胞中。2010年有研究表明,体液中存在miRNAs,且它们的水平与疾病进展相关。从那时起,细胞外miRNAs转运机制被广泛研究,目前已知的两条主要途径是:(1)通过EVs主动转运;(2)作为蛋白-miRNA复合物的一部分转运。此外,可能有一些miRNAs是从破损或受损的细胞中泄漏出来的。
通过细胞外囊泡运输
通常,多泡体(MVBs)与质膜融合产生的较小的EVs (< 200nm)称为外泌体(图1),而质膜直接向外出芽和裂变形成的较大EVs (> 200nm)称为微囊泡。直接出芽也能产生类似外泌体的小泡,被称为梭状囊泡或胞外体。
神经酰胺代谢的改变与外泌体形成和释放的改变之间的关系尚未被研究,但已在代谢综合征中发现神经酰胺代谢的改变。
是什么决定了EVs中包含的miRNAs种类和数量是一个至今仍知之甚少的重要问题。
同样的, 外泌体和其他EVs是如何被靶细胞吸收的?这个问题目前也不是很清楚。
通过蛋白-miRNA复合物的miRNAs转运
除EVs外,miRNAs还可能在含有蛋白复合物的血液中被运输。这些复合物也可以进入细胞并传递miRNAs来抑制靶mRNA。低密度(LDL)和高密度(HDL)脂蛋白都可以在循环中运输miRNAs。在HDLs的情况下,结合的miRNAs可以通过B类I型清道夫受体被受体细胞吸收并在细胞内释放从而调节受体细胞基因表达。
尽管EVs相关和脂蛋白结合的miRNAs在功能上很重要,但它们只是占循环中发现的所有miRNAs的一部分。在一些研究中,在人类血清中发现超过一半的miRNAs可能与核糖核酸蛋白结合,包括argonaute (AGO2);然而,其中只有一小部分是通过这种方式运输的。核仁蛋白核磷蛋白1 (nucleophosmin 1, NPM1)也被发现可以携带和保护细胞外miRNAs不被降解。
作为疾病生物标志物的细胞外miRNAs
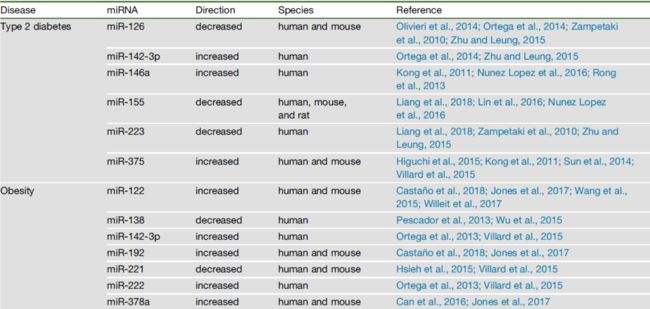
生物标志物是一种可以用于疾病检测和/或预后预测的分子。一个好的生物标志物最重要的四个特征是特异性、敏感性、稳定性和非侵入性。循环miRNAs水平的变化与多种疾病相关,包括2型糖尿病(T2D)、肥胖、心血管疾病(CVD)、癌症、神经退行性疾病等。
分离和检测细胞外miRNAs的方法
这部分内容参考我写的ChemicalReviews综述,那里面有更详细的描述。
疾病相关的细胞外miRNAs
细胞外miRNAs是代谢稳态的Housekeepers
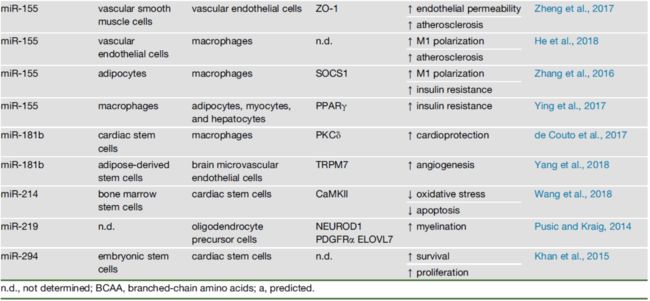
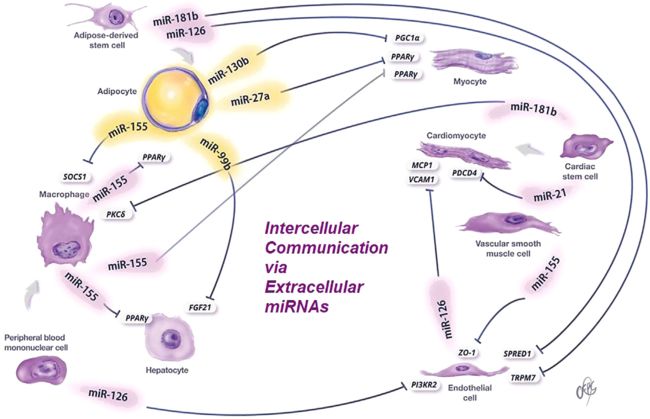
脂肪组织、免疫细胞、胰岛和许多其他与代谢性疾病相关的细胞,会以EVs和其他形式分泌大量的miRNAs。这些miRNAs可能以旁分泌或自分泌的方式发挥作用,或以内分泌的方式进入循环。表2列出了细胞外miRNAs及其供体细胞、受体细胞、靶基因以及与疾病的关联。 以下总结了细胞外miRNAs进行系统调控的相关位点。Adipose Tissue脂肪组织
脂肪组织的功能除了以甘油三酯的形式储存能量外,还能分泌调控全身新陈代谢的分子来维持机体内环境平衡。这些分子包括脂肪产生的激素(被称为脂肪因子),信号脂质,炎症介质和EVs miRNAs。ADicerKO小鼠约三分之二的循环miRNAs显著减少,这表明了脂肪组织对循环miRNAs库的显著贡献。患有各种脂肪营养不良的患者,其循环外泌体miRNAs也有显著改变。重要的是,脂肪组织分泌的miRNAs已经被证明可以到达肝脏和肌肉等器官,并调节该组织基因和蛋白质的表达。
脂肪来源的循环miRNAs以内分泌方式控制代谢稳态的一个例子是2017年Thomou等人通过脂肪来源的miR-99b调控肝脏FGF21。ADicerKO小鼠循环EVs中的miR-99b水平降低,肝脏中Fgf21 mRNA及3' UTR-报告基因活性的上调,这两种现象可通过往循环中加入含有miR-99b的EVs显著纠正。ADicerKO小鼠还显示出其他组织(包括肌肉、β细胞和骨骼)功能障碍,以及全身胰岛素抵抗。但具体是哪些循环外泌体miRNAs参与了这些表型仍有待确定。
其他研究表明,来源于脂肪EVs的miRNAs也可以发挥旁分泌功能。从含有miR-16、miR-27a、miR-146b和miR-222的大脂肪细胞中释放的EVs可以转移到小脂肪细胞中,从而刺激其脂肪生成和脂肪细胞肥大。脂肪细胞分泌这些miRNAs是由游离脂肪酸和H2O2诱导的,在老年小鼠的血清中这些miRNAs表达上调。这些结果提示促进脂质积累和胰岛素抵抗的信号可能通过脂肪细胞的分泌miRNAs从胰岛素抵抗的脂肪细胞向新形成的脂肪细胞传播。肥胖患者的多种脂肪组织衍生的循环miRNAs(通过含脂肪特异性蛋白FABP4的细胞外颗粒的亲和纯化鉴定)在减肥手术一年后发生了显著变化。估计这些miRNAs可靶向WNT/β-catenin和胰岛素信号通路的成分。减肥手术后差异表达的miRNAs中,let-7a和miR-16的靶标涉及胰岛素受体信号传导,并且这些miRNAs的水平与支链氨基酸(BCAA)的水平相关,表明它们可能与全身胰岛素抵抗相关。
Pancreas胰腺
胰岛细胞不仅可以通过分泌胰岛素和胰高血糖素来控制代谢,还可以通过分泌miRNAs来控制代谢。初级胰岛细胞和β细胞来源的MIN6细胞在收到胰岛素分泌刺激时可释放特定的miRNAs。例如,与瘦组相比,肥胖ob/ob小鼠的血清、胰岛、肝脏和骨骼肌中miR-223表达上调。但其前体pri-miR-223仅在胰岛中升高,这表明其他组织中成熟miR-223水平升高来源与胰岛。miR-223已被证明能与Glut4 mRNA的3' UTR结合,下调脂肪组织中的GLUT4(葡萄糖的代谢取决于细胞对葡萄糖的摄取,然而,葡萄糖无法自由通过细胞膜脂质双层结构进入细胞,细胞对葡萄糖的摄入需要借助细胞膜上的葡萄糖转运蛋白(glucose transporters)简称葡萄糖转运体(GLUT)的转运功能才能得以实现。GLUT4就是其中的一种形式),上调心肌细胞的GLUT4表达。
miR-155、miR-142-3p和miR-142-5p可能从T淋巴细胞来源的EVs转移到β细胞,导致炎症通路、细胞凋亡的激活和胰岛素缺乏性糖尿病的发生。
Cardiovascular System心血管系统
人单核细胞在促炎刺激后分泌的EVs具有高水平的miR-150。用这些EVs孵育微血管内皮细胞可下调miR-150靶基因c-Myb,这是一种参与内皮细胞迁移的转录因子。miR-150在体外过表达可诱导内皮细胞迁移,这种作用可通过动脉粥样硬化患者(miR-150水平上调)血浆中的EVs孵育来模拟。来自血管平滑肌细胞的EVs已被证明能够促进miR-155向内皮细胞的转移,通过降低紧密连接蛋白的水平来影响内皮屏障的完整性。暴露于氧化的低密度脂蛋白(LDL)的内皮细胞分泌的EVs高表达miR-155,miR-155可以将巨噬细胞的极化从M2样表型转移到促炎性M1样表型。血清和心脏中miR-126水平的变化被认为通过影响MCP-1和VCAM-1的表达而在心功能障碍中发挥作用。这些过程改变内皮功能,促进动脉粥样硬化。
Central Nervous System中枢神经系统
越来越多的证据表明,循环EVs可能穿过室管膜层和血脑屏障(BBB)作用于中枢神经系统,从而发挥组织间通讯的作用。老龄大鼠鼻腔给药含miR-219的血清EVs可增加中枢神经系统的髓磷脂含量。改变血脑屏障(BBB)通透性的神经退行性疾病可以促进大脑循环miRNAs与血液循环miRNAs的交换。也有证据表明EVs可以通过胞吞机制穿过血脑屏障。许多细胞外miRNAs被认为是神经退行性疾病的疾病生物标志物,尽管它们在这些疾病的病理生理学中的作用尚不确定。衰老会影响下丘脑干细胞分泌EVs miRNAs,而脑室内注射下丘脑干细胞分泌产生的EVs能够延缓下丘脑衰老。(汤老师的Nature文章)含有miRNAs的EVs也涉及神经元、星形胶质细胞、小胶质细胞和内皮细胞之间的相互作用。2018年,Huang等人发现脑损伤后小胶质细胞EVs 中miR-124水平升高,观察到这个miRNA可以转移到神经元中发挥抑制神经元炎症和促进神经元突触生长的作用。
Challenges and Perspectives
寻找细胞外miRNAs的来源和调控机制
确定细胞外miRNAs的靶标和功能
使用细胞外miRNAs作为生物标记物
细胞外miRNAs在治疗中的作用
患者的循环EVs相关的miRNAs被用来找出差异表达的分子。这些候选分子在临床前研究中被研究,在疾病中起作用的miRNAs被选择用于临床试验。将临床相关的miRNAs模拟物或anti-miR分子装入患者自身的EVs中,再注入血液中,使EVs miRNAs水平恢复正常。Conclusions
尽管这个领域还很年轻,但细胞外miRNAs作为细胞间通讯的生理机制的概念却令人兴奋并受到关注,使用细胞外miRNAs更好地对疾病分期以及治疗的前景也是如此。目前,开发合适的工具和标准化的方法来评估miRNAs的运输和交付是该领域的瓶颈,但是在未来几年可能被克服。克服这些障碍将把这一领域带入一个新的高度:特定的细胞外miRNAs可被视为不同生理和病理生理状况的生物标志物,而外泌体或其他EVs中的miRNAs可被用于以一种特定而有效的方式治疗疾病。
感觉这篇综述的质量不如我写的上一篇ChemicalReviews综述,那篇更全面,并且对某些方面描述也更具体。不过这篇也可以学到少量那篇综述没涵盖到的知识点。
原文链接:Cell Metabolism 30, October 1, 2019. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. IF: 22.415
如果你关注了我,希望你与我一起学习,一起成长!❤