Nature子刊:涵盖20多万个基因组的人体肠道微生物参考基因组集
Nature子刊:涵盖20多万个人体肠道微生物基因组的参考基因组集
A unified catalog of 204,938 reference genomes
from the human gut microbiome
出版时间:2020年6月20日
DOI:https://doi.org/10.1038/s41587-020-0603-3
第一作者:Alexandre Almeida1,2
通讯作者:Alexandre Almeida1,2([email protected])、Robert D. Finn1,2,3*([email protected])
其它作者:Stephen Nayfach, Miguel Boland, Francesco Strozzi, Martin Beracochea, Zhou Jason Shi, Katherine S. Pollard, Ekaterina Sakharova, Donovan H. Parks, Philip Hugenholtz, Nicola Segata, Nikos C. Kyrpides
主要研究单位
欧洲生物信息学研究所,英国欣克斯顿惠康基因组校区(European Bioinformatics Institute (EMBL–EBI), Wellcome Genome Campus, Hinxton, UK)
惠康基因组校区惠康桑格研究所,英国欣克斯顿(Wellcome Sanger Institute, Wellcome Genome Campus, Hinxton, UK)
导读
在2019年,在Nature, Nature Biotechnology(NBT) 和Cell期刊相继发表的几篇大规模的基于可培养或宏基因组组装的微生物基因组集(genome catalog)- 参考文献如下。这些研究以前所未有的规模,在基因组水平上扩展了我们对人体肠道微生物群落及其功能多样性的认识,同时也让我们认识到不可培养微生物所占比例之大并且其功能和代谢特点显著相异于可培养微生物。此篇在2020年6月发表在NBT上的文章则是在综合归纳和总结之前多国肠道微生物研究的数据基础上,提供了更加全面的人体肠道微生物基因组集,基于基因组水平上基因和蛋白注释而建立的非冗余蛋白集。两者在很大程度上提高了肠道微生物宏基因组研究的比对比率,并且使得更多的序列的物种分类注释可以深入到菌株水平。
1. Zou, Y. et al. 1,520 reference genomes from cultivated human gut bacteria enable functional microbiome analyses. Nat. Biotechnol. 37, 179–185 (2019). 培养组获得1520个基因组,详见《NBT-4篇35分文章聚焦宏基因组研究》。
2. Forster, S. C. et al. A human gut bacterial genome and culture collection for improved metagenomic analyses. Nat. Biotechnol. 37, 186–192 (2019).介绍了人类胃肠道细菌培养集(Human Gastrointestinal Bacteria Culture Collection, HBC),这是一套完整的737个全基因组测序细菌分离株,来自人类胃肠道微生物组中31个科的273个物种(105个新物种)。详见《NBT-4篇35分文章聚焦宏基因组研究》。
3. Almeida, A. et al. A new genomic blueprint of the human gut microbiota. Nature 568, 499–504 (2019). 从11850个人类肠道宏基因组中,鉴别出92143多组装基因组,其中1952种潜在的、未被培养的肠道细菌,简介:https://www.mr-gut.cn/papers/read/1061565285 ,与本篇NBT相同的作者
4. Nayfach, S. et al. New insights from uncultivated genomes of the global human gut microbiome. Nature 568, 505–510 (2019). 3810份粪便宏基因组数据,组装出60664个原核生物基因组草图 简介:https://www.mr-gut.cn/papers/read/1044403894
5. Pasolli, E. et al. Extensive unexplored human microbiome diversity revealed by over 150,000 genomes from metagenomes spanning age, geography, and lifestyle. Cell 176, 649–662.e20 (2019). 9428个人体宏基因组进行组装,获得4930个物种、154723个微生物基因组,简介:https://www.mr-gut.cn/papers/read/1047831920
摘要
全面且高质量的参考基因组对于人体肠道微生物群落组成的物种分类和功能分析是必要的。本文建立了一个人体肠道微生物的基因组集(Unified Human Gastrointestinal Genome, UHGG),包含20万4938个非冗余基因组,隶属于4644个原核生物种。这些基因组编码大于1.70亿的蛋白质序列,被汇总命名为人类肠道微生物蛋白集(Unified Human Gastrointestinal Protein, UHGP)。相比于之前的IGC (Integrated Gene Catalog),这个UHGP涵盖的蛋白数量是之前的两倍多。通过比对当前微生物基因组数据库及其主流功能注释数据库,结果发现,UHGG当中有70%找不到其对应的可培养微生物代表;与此同时,大约40%的UHGP的功能无法被注释。种内基因组变异性分析结果表明:附属基因(Accessory genes)和单核苷酸多态性(Single Nucleotide Variants, SNVs)广泛存在,某些SNVs呈现人口地理分布的特异性。总之,这个人体肠道微生物基因组和蛋白质组的整合集将会使研究者更加高效的将微生物基因型及其表型关联在一起进行分析。
背景
自人类微生物计划启动(2008年),研究者相继发现成百上千的新细菌基因组。在2014年李俊桦等通过整合源于欧洲,美国和中国多达1200个样品的人体肠道微生物宏基因组测序结果,提供了一个更加全面的人体微生物参考基因集。这个基因集被广泛用于人体肠道微生物与人体疾病(比如,二型糖尿病,肥胖症等)的相关性研究中。但是,基于非冗余基因集的研究存在其自身的缺陷性,例如, 我们无法将这些比对到的非冗余基因对应到其所在的微生物基因组,这就使得我们无法从基因组的整体水平上去认识某些富集或者缺失的基因以更好的认识其功能。
基于分离培养的肠道微生物组的基因组和相应的功能试验验证分析,不断扩充了我们对肠道微生物功能及其对人体群落结构稳定性以及宿主健康的影响机制的理解。与此同时,基于宏基因组序列拼接(assembly)和分箱(binning)技术所获得的宏基因组组装基因组(metagenome-assembled genomes, MAGs)也以前所未有的速度迅速积累。但是,MAGs拼接也面临着错误拼接和分箱的可能性,因此,对于MAGs基因组比较分析解释时需要特别谨慎。以上基于分离培养和宏基因组测序拼接所积累的大量的微生物基因组,在很大程度上扩大了人类肠道微生物可知物种库,本文就综合了之前的研究结果并建立一个综合的肠道微生物基因组集(UHGG)及其蛋白质组集(UHGP)。
主要研究结果
UHGG基因组涵盖范围及其质量描述
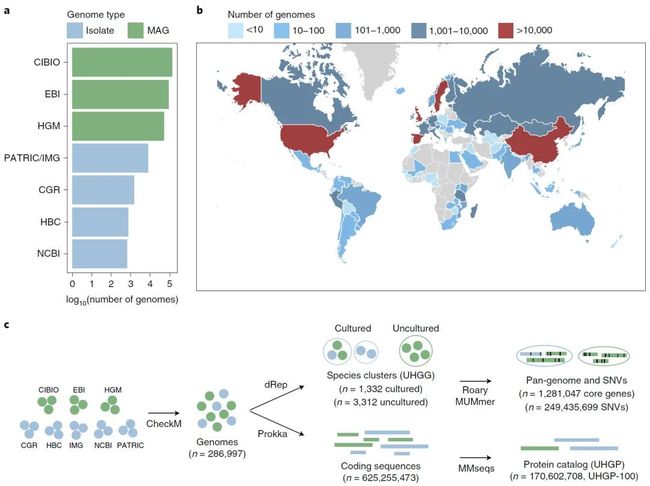
本研究中涵盖了2019年之前几个大规模微生物基因组数据:其中分离菌株基因组来自于Foster et.al. (2019) 等HBC(Human Gastrointestinal Bacteria Culture Collection)基因组,Zou et.al. (2019)等CGR(Culturable Genome Reference)基因组以及其他数据库中的可培养微生物基因组(包含NCBI,PATRIC和IMG);另外,MAGs基因组主要来自于Pasolli et.al. (2019)CIBIO,Almeida et.al. (2019)EBI和Nayfach et.al. (2019)HGM研究中所获得的微生物基因组。对以上所有基因组的筛选条件包含有三个:1)>50%完整度;2)<5%污染度;3)质量分数(完整度-5x污染度)>50。通过这个条件筛选之后,一共获得了286997个高质量基因组,其在各数据库中的分布(图1a):
为了建立物种水平上的微生物集,以上28万6997个基因组被聚类成物种,这里物种是基于两个基因组间核酸序列一致性定义的 - 在大于30%的可比对序列长度(alignment fraction, AF)上具有 >95%的平均核酸一致性(average nucleotide identity, ANI)即被定义为一个物种。每个物种的代表基因组是从其聚类堆内选择的质量最好的一个作为代表,并且这些代表基因组综合起来建立了UHGG集。基于此定义,以上286997个基因组被聚类到4644个原核生物种,其中4616属于细菌而28个为古菌,其中3207的代表基因组的完整度>90,污染度<5%,并且其中573个基因组含有5S,16S,23S以及至少18个tRNAs(这个是Genomic Standards Consortium定义的高质量MAG的标准)。GTD-Tk(Genome Taxonomy Database Toolkit)被用来注释这些物种代表基因组的物种信息。结果表明,有大于60%的肠道微生物基因组无法被注释到物种,也就是说有大量的UHGG在对应的物种数据库中是缺乏代表物种的。与此同时,作者也使用CMseq分析了所有MAGs的菌株异质性(strain heterogeneity=proportion of polymorphic porsitions),其中位数是0.06%,这个数值低于0.5%,意味着这个研究中得到的MAGs是数据高质量的MAGs伴随着很微弱的菌株异质性。
图1. 人类肠道微生物组的整合序列集
Fig. 1 | The unified sequence catalog of the human gut microbiome.
a,生成本基因组集和蛋白集的基因组数据来源,即对应研究项目及其所涵盖的肠道基因组数量,其中蓝色柱条代表可培养分离菌株基因组而绿色柱条代表MAGs。b,每个国家/地区检索到的基因组数量的地理分布。c,用于生成基因组(UHGG)和蛋白质序列(UHGP)集的方法概述。从公共数据集中检索的基因组首先由CheckM进行质量控制。过滤后的基因组采用dRep以估计的物种水平(95%ANI)聚类,并评估其种内多样性(来自同种基因组的基因以90%的蛋白质同一性聚类)。同时,从286,997个基因组的所有编码序列中生成了非冗余蛋白集,分别为100%(UHGP-100,n = 170,602,708),95%(UHGP-95,n = 20,239,340),90%(UHGP-90,n = 13,907,849)和50%(UHGP-50,n = 4,735,546)蛋白质同一性。
UHGG与之前研究结果及其数据库的比对
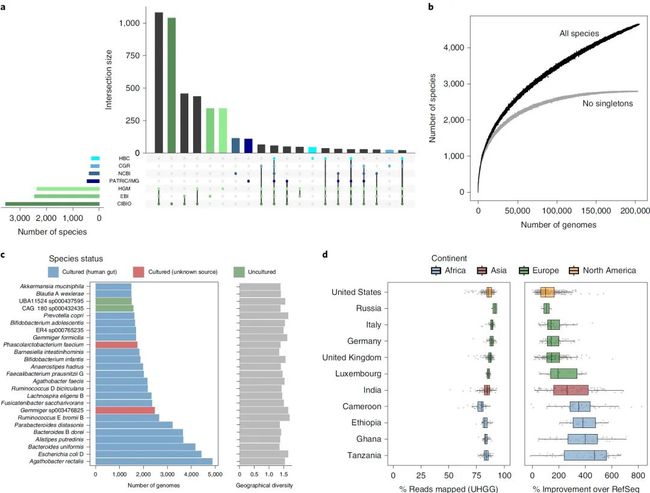
通过比较不同研究中拼接而成的MAGs发现,几个大规模的MAGs研究,虽然使用了不同的序列拼接,分箱及其提纯优化方法,其生成的MAGs存在很大比例的重合度,其中1081物种分别同时在CIBIO,EBI和HGM获得(Fig.2a)。通过比较这几个研究中均用到的样品MAGs发现,79%-86%的MAGs在所有的研究中都有检测到。另外,通过比较同一个样品在不同研究中所拼接获得的属于同一个物种的MAGs发现,对应物种的ANI和AF的中位数分别为99% 和92.1%,其中高质量(90%完整度)基因组其对应的AF为94.5%,然而中间质量的基因组,这个AF只有86.6% (附图3c)。物种饱和曲线显示(2b),不可培养微生物种在此研究中并未达到饱和,但是这个不饱和很有可能是稀有种所引起的,因为当单基因组单独代表的物种去掉时,物种曲线接近饱和。不同于MAGs在不同研究中的高度一致性(详者注:MAG更倾向于恢复高丰度的微生物),对应在HBC,CGR和NCBI中的可培养微生物基因组的重叠性很小,大部分(70%)是研究或数据库特有的。大约81%(3705)UHGG肠道微生物中在现有的肠道微生物可培养数据库中找不到对应的代表性物种。当作者将比对数据库扩展到NCBI RefSeq所有的可培养菌时,另外的438个物种找到了对应的物种信息,即使这样依旧有3312(71%)的UHGG物种在现阶段缺乏可培养种代表。其中大约有66%和31%的细菌和古菌没有对应的可培养微生物代表。几个最大的代表性分支为4C28d-15目(包含167个物种),RF39目(包含139个物种)和CAG-272目(包含67个物种)。
另外,通过比较对应物种所包含的基因组数目发现,包含最多细菌基因组的前25个物种中仅有两个物种是没有可培养菌株的(Fig.2c),排名前三的细菌物种是Agathobacter rectalis, Escherichia coli D和Bacteroides uniformis,而对应的古菌为Methanobrevibacter A smithii。本文中也计算了这些UHGG微生物种的地理分布Shannon多样性,结果表明其中最大的物种不受到样品地理位置的限制,而是在不同地理位置分布的样品中呈现相似的高丰富度[Fig.2d]。为了更好的评估本文UHGG在宏基因组物种注释中的独特优势,作者选取了1005个宏基因组数据并将序列使用Kraken2比对到UHGG以及RefSeq数据库,结果表明前者足足提高了155%的比对比例相比也后者而言,其可比对比例高达85.9%(中位数)。并且UHGG作为参考基因组的比对优势在非西方国家的宏基因组样品中更为明显。
图2:整个研究中物种的交集和对应每个物种的基因组频数分布
Fig. 2: Interp and frequency of species across studies.
a,不同基因组研究中涵盖物种数量及彼此间的重叠度,按其重叠程度排序。竖线表示特定研究组之间共享的物种数,下图中用彩色点突出显示。下部面板中的水平条表示每个研究集中包含的物种总数。绿色阴影代表的是基于MAG的基因组研究,而蓝色的阴影代表的是基于分离培养的基因组研究。
b,检测到的物种数量与所分析的非冗余基因组数量的稀释曲线。描绘了所有UHGG物种以及排除单体物种(仅包一个基因组)之后的曲线。
c,每个物种检测到的非冗余基因组数量(左),以及每个物种对应的地理分布多样性(以香农多样性指数计算;右)。仅描绘了25个最具代表性的物种簇。
d,左,以UHGG为参考基因组,1,005个宏基因组样品基于Kraken 2的物种注释比例。右,基于 RefSeq参考数据库,对应宏基因组样品的物种注释提高百分比。以下对应于每个国家分析的数据集数量:喀麦隆,n = 54。埃塞俄比亚,n = 25。德国,n = 56。加纳,n = 40。印度,n = 105;意大利,n = 50。卢森堡,n = 26。俄罗斯,n = 4;坦桑尼亚,n = 61。英国,n = 210。美国,n = 374。框长代表数据的IQR,并且限制线分别从第一个和第三个四分位数延伸到IQR的1.5倍之内的最低和最高值。
附图3. 不同研究中微生物的物种覆盖相似度
Extended Fig.3 Species overlap across study sets
a,不同研究中MAGs的覆盖重复度,基于同时包含在不同研究中的1554个样品的结果;b,每个样品中物种恢复比例;c,同物种基因组的序列比对比率及ANI分布关系。上面的图片对应中等水平质量的MAGs结果,下面对应高质量(完整度>90%)MAGs结果。d,分离培养微生物在不同研究中的重复覆盖度。其中NCBI中的分离基因组主要来自于人类微生物计划结果。
UHGP蛋白集的涵盖范围及其组成特性
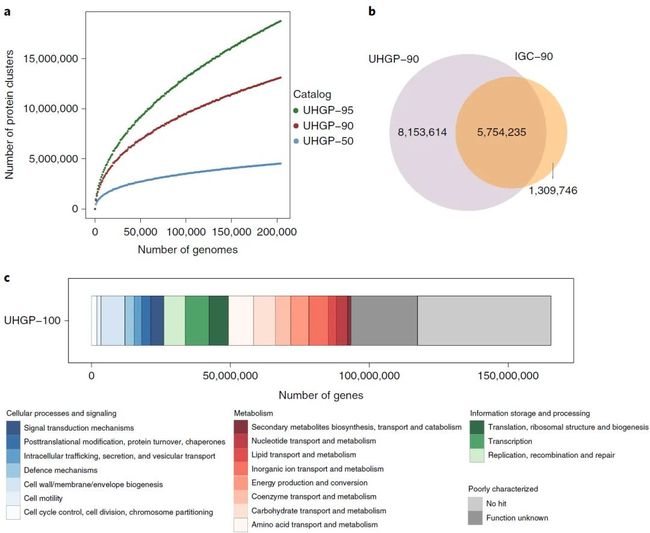
首先UHGP是通过注释所有的UHGG所包含的286997个基因组而获得的蛋白组集,这个不同于之前流行的非冗余基因集概念,因为后者没有对应非冗余基因的基因组信息而UHGP蛋白集中对应的蛋白条目可以找到其所在的基因组来源。UHGP包含625,255,473个完整蛋白序列,随后这些条目在50%,90%和95%蛋白序列一致性标准基础上被聚类并命名为UHGP50,UHGP90,UHGP95和UHGP100。饱和曲线显示),在90%和95%一致性水平上,非冗余蛋白条目的数量呈现持续上升而未能饱和,相比而言在50%相似度水平上,对应的蛋白条目随着样品数量的增加达到饱和(图4A)。
为了评估这个蛋白集作为参考集其比对能力,文中以之前的IGC作为参考并将其非冗余基因组以同样的90%蛋白序列一致性进行去冗余,结果得到包含有7,063,981条目的IGC-90蛋白集。结合UHGP-90的1390万的蛋白条目,两者一起共收录1520万的蛋白簇,其中580万共存于UHGP-90和IGC-90集里。相比于IGC-90而言,UHGP-90收录的条目数量同比增加了115%。然而基于1005个样品宏基因组的比对结果显示,UHGP-90并没有在很大程度上增加对应测序系列的比对率(mapping ratio),对应的提高比例只有5%。这个结果暗示,极有可能UHPG中很多的蛋白条目隶属于样品中的低丰度蛋白簇。为了降低因MAG污染而带来的虚高的蛋白质组集,最后的UHGP只选用了那些在同物种基因组中至少出现在两个不同的基因组中的一类,基于这个筛选条件所得到的UHGP-95,UHGP-90和UHGP-50分别包含10,798,224,8,082,122和3,088,278个蛋白条目。
图4:UHGP提高了人类肠道微生物蛋白的覆盖度
Fig. 4: The UHGP improves coverage of the human gut protein landscape.
a,所获得的蛋白质簇的数量的稀释曲线与所分析的非冗余基因组的数量的关系。针对UHGP-95,UHGP-90和UHGP-50分别绘制了彩色曲线。b,UHGP(紫色)和IGC(橙色)之间的重叠,都以90%的氨基酸同一性聚集。c,统一的胃肠道蛋白质集的COG功能注释结果以100%氨基酸同一性(UHGP-100)聚集。
UHGP功能组成
通过比对当下的主要功能注释数据库(eggNOG,InterPro,COG和KEGG),UHGP-100中存在27.3%的条目在以上数据库中无法匹配到的对应的功能。基于COG的注释结果显示,其中高代表性的功能类群主要参与氨基酸转运和代谢,细胞壁/细胞膜/膜生物合成以及转录(图4c)。另外为了比较微生物物种间功能组成差异,作者们将同隶属于同一个物种的基因组的蛋白序列在90%的氨基酸序列一致性的标准下进行了去冗余,对应物种的泛基因组分类到363个KEGG模块(module)(附图8a)。其中保守性的模块的功能主要参与如下过程或者功能:核糖体结合,糖酵解,肌酐一磷酸生物合成,糖原异生以及蔓草酸酯信号路径。另外,本文发现某些细菌门对应的泛基因组可注释的功能比列相对较小,比如Myxococcota, Bdellovibrionota, Thermoplasmatota, Patescibacteria和Verrucomicrobiota。与此同时,某些细菌类群对应的碳水化合物相关的活性酶的编码基因含量相对较高,比如:Fibrobacterota,Bacteroidota,Firmicutes I,Verrucomicrobiota和Patescibacteria (附图8b)。
种内基因组多样性
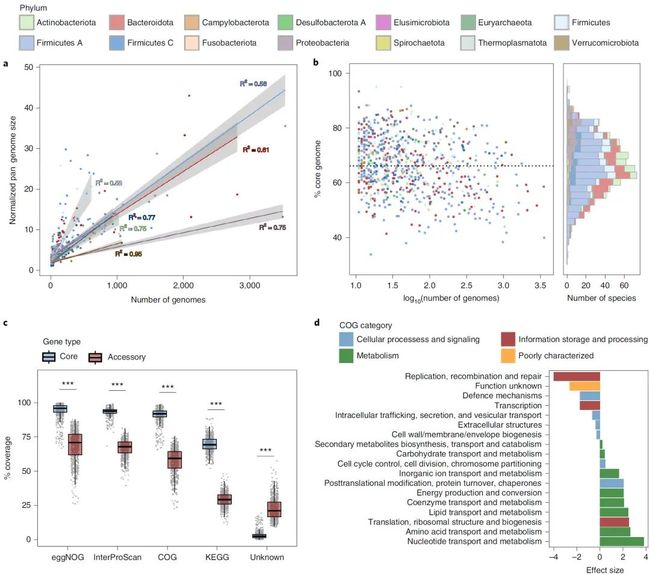
为了比较种内核心基因以及附属基因组成特点,只有那些完整度>90同时对应物种的基因组总数大于10的物种(共781)及其基因组被用于比较分析。每个物种的基因频数分布呈现双峰模式,总体上来讲大部分的基因或属于核心基因(Core,出现在其对应物种>90%的基因组中)亦或属于附属基因(Accessory,出现在其对应物种<10%的基因组中)。另外不同微生物种泛基因组(pan-genome)大小随着其基因组个数的增加速率不同,其中Firmicute对应的增长速率较大(但是个人认为这个趋势并没有特别明显,线性关系有点牵强)。但是有一点比较有意思的是,物种对应的核心基因占总基因的比例存在很大的差异,即使当同一个细菌门的两个物种包含基因组个数都高达1000,其核心基因比例依旧差异很大。
通过对核心基因和附属基因进行功能注释发现,对应核心基因的可注释比例(96% eggNOG,94% InterPro,92% COG和69% KEGG)明显高于附属基因,后者平均有21%基因无法被以上数据库注释。基于COG数据库的功能注释结果显示,核心基因编码蛋白功能往往与关键的碳,氨基酸以及脂肪的代谢途径及其它看家功能相关。相比而言,附属基因编码的蛋白往往与微生物的防御机制相关,包含广谱耐药性机制相关的ABC运输外排泵(ABC transporter efflux pumps)以及更加具有目标性的对噬菌体病毒的防御机制,比如,CRISPRA-Cas限制修改系统。
图5:肠道微生物组内的全基因组多样性模式
Fig. 5: Pan-genome diversity patterns within the gut microbiome.
a,归一化的泛基因组大小与同种基因组数目的关系。对应每个细菌门生成了对应的回归曲线,对应的决定系数显示在每个曲线的旁边,阴影区域表示95%的置信度区间。以下对应于每个门所考虑的物种数量:放线菌,n = 66。Bacteroidota,n = 122。Firmicutes,n = 90。Firmicutes A,n = 325。Firmicutes C,n = 44。变形杆菌,n = 65。Verrucomicrobiota,n = 13。b,每个物种核心基因组百分比及其包含基因组个数分布散点图(左)和直方图(右),每种物种的核心基因组的比例,用门着色。水平虚线表示所有物种的中位数。c,通过各种注释方案分类的核心和附属基因(n = 781种)的比例,以及缺少任何功能注释的基因的百分比。框长代表数据的IQR,并且延长线分别从第一个和第三个四分位数扩展到IQR的1.5倍以内的最低和最高值。进行了双尾Wilcoxon秩和检验,以比较核心基因和附属基因之间的测序深度的显著差异性(* P <0.001)。d,比较分配给核心基因(n = 1,236,880)和附属基因(n = 4,785,975)的功能类别。仅显示了统计学上显著的差异(校正后的P <0.05)。通过双尾Wilcoxon秩和检验计算显著性,并使用Benjamini-Hochberg校正对多个比较进行进一步调整。正效应大小(Cohen’s d)表示核心基因中的代表性过高。
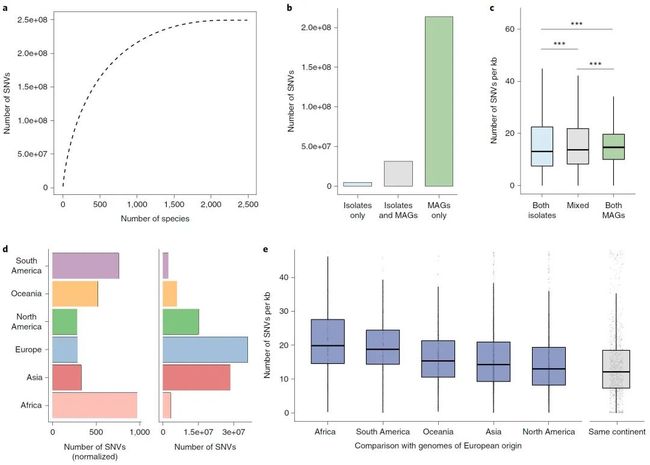
种内单核苷酸多态性
另外本研究也分析了物种内不同基因组的单核苷酸多态性(single-nucleotide variants, SNVs),结果显示85%的SNVs是MAGs特有的,而可培养微生物的基因组特有的种内SNVs仅有2.2%(Fig.6b)。另外发现,非洲肠道微生物样品种的SNVs比例相比于其所包含的总基因组数量而言比例远远高于欧洲,美国以及亚洲样品 (Fig.6e)。
图6:种内单核苷酸变异分析
Fig. 6: Analysis of intraspecies single-nucleotide variation.
a,检测到的SNV随物种的累计分布图。X轴物种是按照其对应SNV降序排列。b,仅在分离的基因组或MAG中,或在两者中检测到的SNV数量。c,相同或不同类型的基因组的成对SNV密度分析(分离株,n = 808,331;混合,n = 1,575,895;MAG,n = 26,899,457)。进行了双尾Wilcoxon秩和检验,以评估统计显着性,并使用Benjamini-Hochberg校正对更多比较进行了进一步调整(* P <0.001)。d,左图,通过每个大陆的基因组数量归一化的特有SNV数量。右图,每个大陆的基因组中仅检测到的SNV数量。e,欧洲,最大基因组子集和其他大洲的基因组之间的成对SNV密度分析。计算每个物种的SNV密度中值,并显示所有物种的分布(非洲,n = 188;亚洲,n = 746;北美,n = 688;大洋洲,n = 35;南美,n = 151) 。从同一大陆(n = 908种)中回收的基因组比较用作参考。来自同一大陆的基因组之间的SNV密度显着低于针对不同大陆的基因组所计算的SNV密度(校正后的P <0.05)。在c和e中,框长代表数据的IQR,延长线分别描绘了第一和第四四分位数的IQR 1.5倍以内的最小和最大值。
福利:代码和数据库
UHGG的基因组已经被存放在European Nucleotide Archive数据库的ERP116715研究序列号之下。本文中生成的UHGG,UHGP以及SNV,另外其对应的功能注释,泛基因组结果以及基于UHGG而生成的Kraken2格式的参考比对数据集等MGnity ftp网站(http://ftp.ebi.ac.uk/pub/databases/metagenomics/mgnify_genomes/)均可见。另外,此研究还生成UHGG对应的Bitsliced Genomic Signature Index (BIGSI),使得用户可以通过交互式界面从数据库中搜索(query sequence <5kb)对应在数据库中的相似序列的相关信息,详见NBT:超高速细菌基因组检索技术。为了保持数据库能及时的并入最新研究的数据,MAGs也会从ENA(European Nucleotide Archive)数据库中提取相应的MAGs数据并及时并入数据库中以补充或者取代低质量的代表序列。
编辑:刘芳 中科院遗传发育所 博士后
责编:刘永鑫 中科院遗传发育所 工程师
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
系列教程:微生物组入门 Biostar 微生物组 宏基因组
专业技能:学术图表 高分文章 生信宝典 不可或缺的人
一文读懂:宏基因组 寄生虫益处 进化树
必备技能:提问 搜索 Endnote
文献阅读 热心肠 SemanticScholar Geenmedical
扩增子分析:图表解读 分析流程 统计绘图
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
在线工具:16S预测培养基 生信绘图
科研经验:云笔记 云协作 公众号
编程模板: Shell R Perl
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
![]()
学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
![]() 点击阅读原文,跳转最新文章目录阅读
点击阅读原文,跳转最新文章目录阅读