高中化学30个分类专题全汇总! 新学期拿高分就靠它了!
![]()
(一)纯净物: 重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg;水晶SiO2。
(二)混合物: 氨水(分子:NH3、H2O、NH3·H2O;离子:NH4+、OH、H+) 氯水(分子:Cl2、H2O、HClO;离子:H+、Cl、ClO、OH) 王水(浓HNO3∶浓HCl=1∶3溶质的体积比)卤水(MgCl2、NaCl及少量MgSO4) 硬水(溶有较多量Ca2+、Mg2+的水)软水(溶有较少量或不溶有Ca2+、Mg2+的水) 铁水(Fe、C、Mn、Si、S、P等单质的熔融态混合体) 苏打水(Na2CO3的溶液) 生理盐水(0.9%的NaCl溶液)硝(盐)镪水[浓硝(盐)酸] 水玻璃(Na2SiO3水溶液)水泥(2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3)
(一)无机的:爆鸣气(H2与O2);水煤气或煤气(CO与H2);高炉气或高炉煤气(CO、CO2、N2)
笑气(N2O) 碳酸气(CO2) (二)有机的:天然气(又叫沼气、坑气,主要成分为CH4)电石气(CH≡CH,常含有H2S、PH3等) 裂化气(C1~C4的烷烃、烯烃)裂解气(CH2=CH2、CH3CH=CH2、CH2=CHCH=CH2等) 焦炉气(H2、CH4等)炼厂气(C1~C4的气态烃,又叫石油气、油田气。)
3:氧化物的分类
(一)氧化物的分类:成盐氧化物:酸性氧化物、碱性氧化物、两性氧化物、复杂氧化物(过氧化物、超氧化物、Fe3O4、Pb3O4等);不成盐氧化物CO、NO (二)易混淆概念分辨 酸酐不一定是酸性氧化物:如乙酸酐酐(CH3CO)2O等;酸性氧化物一定是酸酐。 非金属氧化物不一定是酸性氧化物:如NO、CO、NO2、N2O4、H2O 酸性氧化物不一定是非金属氧化物:如Mn2O7、CrO3 金属氧化物不一定是碱性氧化物:如Al2O3、ZnO(两性),Mn2O7、CrO3(酸性氧化物) 碱性氧化物一定是金属氧化物 ※NO2因与碱反应不仅生成盐和水,还有NO,因而不是酸性氧化物。 ※Na2O2因与酸反应不仅生成盐和水,还有O2,因而不是碱性氧化物。
4:比较金属性强弱的依据
金属性:金属气态原子失去电子能力的性质;金属活动性:水溶液中,金属原子失去电子能力的性质。 注:金属性与金属活动性并非同一概念,两者有时表现为不一致,诸如Cu与Zn:金属性Cu>Zn,而金属活动性Zn>Cu。 1、同周期中,从左向右,随着核电荷数的增加,金属性减弱;同主族中,由上到下,随着核电荷数的增加,金属性增强; 2、依据最高价氧化物的水化物碱性的强弱;碱性愈强,其元素的金属性也愈强; 3、依据金属活动性顺序表(极少数例外);4、常温下与酸反应煌剧烈程度; 5、常温下与水反应的剧烈程度; 6、与盐溶液之间的置换反应; 7、高温下与金属氧化物间的置换反应。
5:比较非金属性强弱的依据
1、同周期中,从左到右,随核电荷数的增加,非金属性增强;同主族中,由上到下,随核电荷数的增加,非金属性减弱; 2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强; 3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强; 4、与氢气化合的条件;5、与盐溶液之间的置换反应; 6、其他,例:2Cu+S , Cu+Cl 2所以,Cl的非金属性强于S。
6:“10电子”、“18电子”的微粒小结
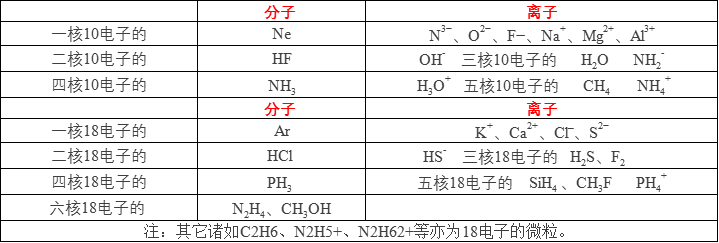
7:具有漂白作用的物质
氧化作用:Cl2、O3、Na2O2、浓HNO3;化学变化;不可逆 化合作用:SO2;化学变化;可逆吸附作用:活性炭;物理变化;可逆 ※其中能氧化指示剂而使指示剂褪色的主要有Cl2(HClO)和浓HNO3及Na2O2
8:安全火柴的成分及优点
安全火柴的成分:火柴头:氧化剂(K、MnO2)、易燃物(如硫等)、粘合剂 火柴盒侧面:红磷、三硫化二锑、粘合剂起火原因:摩擦→发热→KClO3分解→使红磷着火→引起火柴头上的易燃物(如硫)燃烧。优点:红磷与氧化剂分开,比较安全,无毒性。
9:能升华的物质
I2、干冰(固态CO2)、升华硫、红磷,萘。(蒽和苯甲酸作一般了解)。
10:能被活性炭吸附的物质
1、有毒气体(NO2、Cl2、NO等)——去毒; 2、色素——漂白; 3、水中有臭味的物质——净化。
11:硅及其化合物十“反常”
1、硅的还原性比碳强,而碳在高温下却能从二氧化硅中还原出硅。SiO2+2C=Si+2CO↑ 2、非金属单质一般不与弱氧化性酸反应,而硅不但能与HF反应,而且还有H2生成。Si+4HF=SiF4↑+2H2↑ 3、非金属单质与强碱溶液反应一般不生成氢气,而硅却不然。Si+2NaOH+H2O==Na2SiO3+2 H2↑ 4、虽然SiO2是硅酸的酸酐,但却不能用SiO2与水反应制备硅酸,只能用可溶性硅酸盐跟酸作用来制备。 5、酸性氧化物一般不与酸反应(除氧化还原反应外),而二氧化硅却能与氢氟酸反应。 6、非金属氧化物一般是分子晶体,而二氧化硅却是原子晶体。 7、无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。 8、通常所说的某酸盐为一种酸根的盐,而硅酸盐却是多种硅酸(H 2SiO3、H4SiO4、H2Si2O5、H6Si2O7等)的盐的总称。 9、较强的酸能把较弱的酸从其盐溶液中制取出来,这是复分解反应的一般规律,由此对于反应Na2SiO3+CO2+H2O==Na2CO3+H4SiO4↓的发生是不难理解的,而反应Na2CO3+SiO2=Na2SiO3+CO2↑居然也能进行。 10、硅酸钠的水溶液俗称水玻璃,但它和玻璃的化学成分并不相同。硅酸钠也叫泡花碱,但它是盐而不是碱。钢化玻璃与普通玻璃成分相同,水晶玻璃与玻璃成分不同。
12:碱金属元素具体知识的一般与特殊
1、Na、K均保存在煤油中,防止氧化,但锂单质不能保存在煤油中,因锂单质密度小于煤油,浮于煤油液面,达不到隔绝空气的目的,应保存太平石蜡中。 2、碱金属单质的密度一般随核电荷数的增大而增大,但钾的密度却比钠小。 3、碱金属单质在空气中燃烧大部分生成过氧化物或超氧化物,但锂单质特殊,燃烧后的产物只是普通氧化物。 4、碱金属单质和水反应时,碱金属一般熔点较低,会熔化成小球。但锂的熔点高,不会熔成小球。生成的LiOH溶解度较小,覆盖在锂的表面,使锂和水的反应不易连续进行。 5、碱金属单质和水反应时,碱金属单质一般浮于水面上,但铷、铯等单质和水反应时沉入水底,因铷、铯单质的密度比水大。 6、钠盐的溶解度受温度的变化影响一般都较大,但NaCl的溶解度受温度变化的影响却很小。 7、碱金属的盐一般均易溶于水,但Li2CO3却微溶于水。 8、焰色反应称为“反应”,但却是元素的一种物理性质。
13:Fe3+的颜色变化
1、向FeCl3溶液中加几滴KSCN溶液呈红色;2、FeCl3溶液与NaOH溶液反应,生成红褐色沉淀; 3、向FeCl3溶液溶液中通入H2S气体,生成淡黄色沉淀; 4、向FeCl3溶液中加入几滴Na2S溶液,生成淡黄色沉淀;当加入的Na2S溶液过量时,又生成黑色沉淀; 5、向FeCl3溶液中加入过量Fe粉时,溶液变浅绿色; 6、向FeCl3溶液中加入过量Cu粉,溶液变蓝绿色;7、将FeCl3溶液滴入淀粉KI溶液中,溶液变蓝色; 8、向FeCl3溶液中滴入苯酚溶液,溶液变紫色;
14:“黑色金属”有哪些
化学上把铁、铬、锰三种金属和铁基合金统称为“黑色金属”。
15:Fe2+与Fe3+的鉴别方法
Fe2+与Fe3+的性质不同而又可以相互转化。中学化学中可用以下几种方法加以鉴别。 1.观察法:其溶液呈棕黄色者是Fe3+,呈浅绿色者是Fe2+。 2.H2S法:通往H2S气体或加入氢硫酸,有浅黄色沉淀析出者是Fe3+,而Fe2+溶液 不反应。2Fe3++H2S==2Fe2++2H++S↓ 3.KSCN法:加入KSCN或其它可溶性硫氰化物溶液,呈血红色者是Fe3+溶液,而Fe2+的溶液无此现象。这是鉴别鉴别Fe3+与Fe2+最常用、最灵敏的方法。Fe3++SCN==[Fe(SCN)]2+ 4.苯酚法:分别加入苯酚溶液,显透明紫色的是Fe3+溶液,无此现象的是Fe2+的溶液。Fe3++6C6H5OH→[Fe(C6H5O)6]3+6H+(了解) 5.碱液法:取两种溶液分别通入氨气或碱液,生成红褐色沉淀的是Fe3+溶液,生成白色沉淀并迅速变为灰绿色、最终变成红褐色的是Fe2+溶液。 Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+; Fe3++3OH== Fe(OH)3↓Fe2++2 NH3·H2O==Fe(OH)2↓+2NH4+;4 Fe(OH)2+2H2O+O2==4 Fe(OH)3 6.淀粉KI试纸法:能使淀粉KI试纸变蓝的是Fe3+溶液,无变化的是Fe3+溶液。2 Fe3++2I==2 Fe2++I2 7.铜片法:分别加入铜片,铜片溶解且溶液渐渐变为蓝色的是Fe3+溶液,无明显现象的是Fe2+溶液。 2 Fe3++Cu==2 Fe2++Cu2+ 8.KMnO4法:分别加入少量酸性KMnO4溶液,振荡,能使KMnO4溶液紫红色变浅的是Fe2+溶液,颜色不变浅的是Fe3+溶液。5 Fe2++MnO4+8H+==5 Fe3++Mn2++4H2O
16:金属的冶炼规律
1.活泼金属的冶炼钠、镁、铝等活泼金属,采用电解其熔融态的卤化物的方法冶炼(通直流电)。 例如:2NaCl(熔融) 2Na+Cl2↑ MgCl2熔融) Mg+Cl2↑ 2Al2O3(熔融) 4Al+3O2↑(加入Na3AlF6作熔剂) 注:这里为何不电解熔融态铝的氯化物而须电解其熔融态的氧化物,读者应掌握AlCl3为共价化合物,熔融态时不电离,而Al2O3为离子化合物,熔融态时可发生电离的道理。 2.中等活泼的金属的冶炼锌、铁、锡、铅等中等活泼的金属采用还原剂还原它们的氧化物的方法冶炼。 例如:ZnO+C Zn+CO↑ Fe2O3+3CO 2Fe+3CO2WO3+3H2W+3H2O Cr2O3+2Al 2Cr+Al2O3 3.不活泼金属的冶炼银、铂、金等不活泼金属在自然界可以游离态存在,直接采用物理方法(如淘金等)冶炼,而铜、汞等不活泼金属可用还原剂还原法或热分解法冶炼。例如:2HgO 2Hg+O2↑
17:“置换反应”有哪些?
1.较活泼金属单质与不活泼金属阳离子间置换如:Zn+Cu2+==Zn2++Cu Cu+2Ag+=2Ag 2、活泼非金属单质与不活泼非金属阴离子间置换Cl2+2Br==2Cl+Br2 I2 + S2==2I+ S 2F2+2H2O==4HF+O2 3、活泼金属与弱氧化性酸中H+置换2Al+6H+==2Al3+3H2↑ Zn+2CH3COOH==Zn2++2CH3COO+H2↑ 4、金属单质与其它化合物间置换2Mg+CO2 2MgO+C 2Mg+SO2 2MgO+SMn+FeO MnO+Fe 2Na+2H2O==2Na++2OH+H2↑ 2Na+2C6H5OH(熔融)→2C6H5ONa+H2↑2Na+2C2H5OH→2C2H5ONa+H2↑ 10Al+3V2O5 5Al2O3+6V8Al+3Fe3O4 4Al2O3+9Fe 2FeBr2+3Cl2==2FeCl3+2Br2 2FeI2+ 3Br2==2FeBr3+2I2Mg+2H2O Mg(OH)2+H2↑ 3Fe+4H2O(气) Fe3O4+4 H2↑ 5、非金属单质与其它化合物间置换H2S+X2==S↓+2H++2X 2H2S+O2 2S+2H2O(O2不足)CuO+ C Cu+CO↑ (C过量时) 2CuO+C 2Cu+CO2↑ (CuO过量时)FeO+ C Fe+CO↑ 2FeO+Si SiO2+2Fe↑2FeO+C 2Fe+CO2↑ CuO+H2 Cu+H2O Cu2O+H2 2Cu+H2OSiO2+2C Si+2CO↑3Cl2+8NH3==6NH4Cl+N2 3Cl2+2NH3==6HCl+N2
18:条件不同,生成物则不同
1、2P+3Cl2 2PCl3(Cl2不足) ;2P+5Cl2 2PCl5(Cl2充足) 2、2H2S+3O2 2H2O+2SO2(O2充足) ;2H2S+O2 2H2O+2S(O2不充足) 3、4Na+O2 2Na2O 2Na+O2 Na2O2 4、Ca(OH)2+CO2 (适量)== CaCO3↓+H2O ;Ca(OH)2+2CO2(过量)==Ca(HCO3)2↓ 5、2Cl2+2 Ca(OH)2==Ca(ClO)2+CaCl2+2H2O6Cl2+6 Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O 6、C+O2 CO2(O2充足) ;2C+O2 2CO (O2不充足) 7、8HNO3(稀)+3Cu==2NO↑+2Cu(NO3)2+4H2O4HNO3(浓)+ Cu==2NO2↑+Cu(NO3)2+2H2O 8、NaCl(固)+H2SO4 (浓)NaHSO4+HCl↑2NaCl(固)+H2SO4 (浓)Na2SO4+2HCl↑ 9、 H3PO4+ NaOH==NaH2PO4+H2O;H3PO4+2NaOH==Na2HPO4+2H2O H3PO4+3NaOH==Na3PO4+3H2O 10、AlCl3+3NaOH==Al(OH)3↓+3NaCl ; AlCl3+4NaOH(过量)==NaAlO2+2H2O 11、NaAlO2+4HCl(过量)==NaCl+2H2O+AlCl3;NaAlO2+HCl+H2O==NaCl+Al(OH)3↓ 12、Fe+6HNO3(热、浓)==Fe(NO3)3+3NO2↑+3H2O;Fe+HNO3(冷、浓)→(钝化) 13、Fe+6HNO3(热、浓) Fe(NO3)3+3NO2↑+3H2O;Fe+4HNO3(热、浓) Fe(NO3)2+2NO2↑+2H2O 14、Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;3Fe+8HNO3(稀)=3Fe(NO3)3+2NO↑+4H2O 15、C2H5OH CH2=CH2↑+H2OC2H5-OH+HO-C2H5 C2H5-O-C2H5+H2O 16.苯与氯气反应 17、C2H5Cl+NaOH C2H5OH+NaClC2H5Cl+NaOH CH2=CH2↑+NaCl+H2O 18、6FeBr2+3Cl2(不足)==4FeBr3+2FeCl32FeBr2+3Cl2(过量)==2Br2+2FeCl3
19:滴加顺序不同,现象不同
1、AgNO3与NH3·H2O:AgNO3向NH3·H2O中滴加——开始无白色沉淀,后产生白色沉淀 NH3·H2O向AgNO3中滴加——开始有白色沉淀,后白色沉淀消失 2、Ca(OH)2与H3PO4(多元弱酸与强碱反应均有此情况): Ca(OH)2向H3PO4中滴加——开始无白色沉淀,后产生白色沉淀 H3PO4向Ca(OH)2中滴加——开始有白色沉淀,后白色沉淀消失 3、NaOH与AlCl3:NaOH向AlCl3中滴加——开始有白色沉淀,后白色沉淀消失 AlCl3向NaOH中滴加——开始无白色沉淀,后产生白色沉淀 4、HCl与NaAlO2:HCl向NaAlO2中滴加——开始有白色沉淀,后白色沉淀消失 NaAlO2向HCl中滴加——开始无白色沉淀,后产生白色沉淀 5、Na2CO3与盐酸:Na2CO3向盐酸中滴加——开始有气泡,后不产生气泡 盐酸向Na2CO3中滴加——开始无气泡,后产生气泡
20:有关“燃烧”的总结
(一)“燃烧”的条件: 1.温度达到着火点;2.有助燃剂(多指在反应中的氧化剂) (二)镁在哪些气体中能燃烧? 1.镁在空气(氧气)中燃烧:2Mg+O2 2MgO 现象:产生白烟,发出耀眼的强光。 2.镁在氯气中燃烧:Mg+Cl2 MgCl2 现象:产生白烟。 3.镁在氮气中燃烧:3Mg+N2 Mg3N2 现象:产生灰黄色烟。 4.镁在CO2气体中燃烧:2Mg+CO2 2MgO+C现象:产生白烟,瓶壁上有少许淡黄色物质。 (三)火焰颜色小结: H2在空气中燃烧(淡蓝色);CH4在空气中燃烧(淡蓝色);C2H4在空气中燃烧(火焰明亮,黑烟) C2H2在空气中燃烧(浓烈的黑烟);H2S在空气中燃烧(淡蓝色);C2H5OH在空气中燃烧(淡蓝色) S在空气中燃烧(淡蓝色);S在纯氧中燃烧(蓝紫色);CO在空气中燃烧(淡蓝色) H2在Cl2中燃烧(苍白色) 此外:含钠元素的物质焰色呈黄色;含钾元素的物质焰色呈紫色(透过蓝色钴玻璃片)
21:关于化工生产的小结
有关教材中化工生产的内容概括如下两表格,阅读时还应注意: 1. 制玻璃和制水泥三工业都用到了石灰石; 2. 接触法制硫酸和硝酸的工业制法共同用到的设备是吸收塔; 3. 接触法制硫酸、硝酸的工业制法、炼铁(炼钢)都需要鼓入过量空气; 4. 炼铁和炼钢的尾气中均含有可燃性气体CO。 主要原料、化工生产原理与设备 接触法制硫酸 主要原料:硫铁矿、空气、98.3%的浓H2SO4 化工生产原理:增大反应物的浓度、逆流、增大反应物间的接触面积 设备:沸腾炉、接触室、吸收塔 硝酸的工业制法 主要原料:氨、水、空气 化工生产原理:反应物的循环操作、增大反应物的浓度、逆流 设备:氧化炉、吸收塔 制玻璃 主要原料:石灰石、纯碱和石英 设备:玻璃熔炉 制水泥 主要原料:石灰石和粘土 设备:水泥回转窑
化工生产原理及环境污染问题
| 生产名称 | 反应方程式 | 环境污染有关内容 |
| 接触法制硫酸 | 4FeS2+11O2 = 2Fe2O3+8SO2 (高温) | 产生的SO2形成“酸雨”造成污染。用氨水吸收① |
| 2SO2+O2 = 2SO3(V2O5、△) | ||
| SO3+H2O=H2SO4 | ||
| 硝酸的工业制法 | 4NH3+5O2=4NO+6H2O(Pt、△) | 产生的NO、NO2造成污染,用碱液吸收② |
| 2NO+O2=2NO2(放电) | ||
| 3NO2+H2O=2HNO3+NO | ||
| 制玻璃 | Na2CO3+SiO2= Na2SiO3+CO2(高温) | |
| CaCO3+SiO2 = CaSiO3+CO2(高温) | ||
| 制水泥 | 是化学变化,方程式不掌握 |
22:关于气体的全面总结
1.常见气体的制取和检验:(此处略) 2.常见气体的溶解性:极易溶的:NH3(1∶700) 易溶的:HX、HCHO、SO2(1∶40) 能溶的或可溶的:CO2(1∶1)、Cl2(1∶2.26)、H2S(1∶2.6)微溶的:C2H2 难溶或不溶的:O2、H2、CO、NO、CH4、CH3Cl、C2H6、C2H4 与水反应的:F2、NO2。 3.常见气体的制取装置: 能用启普发生器制取的:CO2、H2、H2S; 能用加热略微向下倾斜的大试管装置制取的:O2、NH3、CH4; 能用分液漏斗、圆底烧瓶的装置制取的:Cl2、HCl、SO2、CO、NO、NO2、C2H4等。 4.有颜色的气体:F2(淡黄绿色)、Cl2(黄绿色)、NO2(红棕色) 5.具有刺激性气味的:F2、Cl2、Br2(气)、HX、SO2、NO2、NH3、HCHO。臭鸡蛋气味的:H2S。 稍有甜味的:C2H4。 6.能用排水法收集的:H2、O2、CO、NO、CH4、C2H4、C2H2。 7.不能用排空气法收集的:CO、N2、C2H4、NO、C2H6。 8.易液化的气体:Cl2、SO2、NH3。 9.有毒的气体:Cl2、F2、H2S、SO2、NO2、CO、NO。 10.用浓H2SO4制取的气体:HF、HCl、CO、C2H4。 11.制备时不需加热的:H2S、CO2、H2、SO2、NO、NO2、C2H2。 12.能使湿润的蓝色石蕊试纸变红的:HX、SO2、H2S、CO2。 13.能使湿润的红色石蕊试纸变蓝的:NH3 14.能使品红试液褪色的:Cl2、SO2、NO2 15.能使酸性KMnO4溶液褪色的:H2S、SO2、HBr、HI、C2H4、C2H2 16.能使湿润的醋酸铅试纸变黑的:H2S 17.不能用浓H2SO4干燥的:H2S、HBr、HI、NH3 18.不能用碱石灰干燥的:Cl2、HX、SO2、H2S、NO2、CO2 19.不能用氯化钙干燥的:NH3、C2H5OH
23:最简式相同的有机物
1.CH:C2H2和C6H6 2.CH2:烯烃和环烷烃 3.CH2O:甲醛、乙酸、甲酸甲酯 4.CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数的饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2) 5.炔烃(或二烯烃)与三倍于其碳原子数的苯及苯的同系物;举一例:丙炔(C3H4)与丙苯(C9H12)
24:有机物之间的类别异构关系
1. 分子组成符合CnH2n(n≥3)的类别异构体:烯烃和环烷烃; 2. 分子组成符合CnH2n-2(n≥4)的类别异构体:炔烃和二烯烃; 3. 分子组成符合CnH2n+2O(n≥3)的类别异构体:饱和一元醇和醚; 4. 分子组成符合CnH2nO(n≥3)的类别异构体:饱和一元醛和酮; 5. 分子组成符合CnH2nO2(n≥2)的类别异构体:饱和一元羧酸和酯; 分子组成符合CnH2n-6O(n≥7)的类别异构体:苯酚的同系物、芳香醇及芳香
25:能发生取代反应的物质及反应条件
1.烷烃与卤素单质:卤素蒸汽、光照; 2.苯及苯的同系物:与①卤素单质:Fe作催化剂;②浓硝酸:50~60℃水浴;浓硫酸作催化剂③浓硫酸:70~80℃水浴;共热 3.卤代烃水解:NaOH的水溶液; 4.醇与氢卤酸的反应:新制的氢卤酸、浓硫酸共热 5.酯化反应:浓硫酸共热 6.酯类的水解:无机酸或碱催化;7.酚与浓溴水或浓硝酸 8.油酯皂化反应 9.(乙醇与浓硫酸在140℃时的脱水反应,事实上也是取代反应。)
26:能发生加成反应的物质
烯烃的加成:卤素、H2、卤化氢、水炔烃的加成:卤素、H2、卤化氢、水 二烯烃的加成:卤素、H2、卤化氢、水苯及苯的同系物的加成:H2、Cl2 苯乙烯的加成:H2、卤化氢、水、卤素单质 不饱和烃的衍生物的加成:(包括卤代烯烃、卤代炔烃、烯醇、烯醛、烯酸、烯酸酯、烯酸盐等) 含醛基的化合物的加成:H2、HCN等酮类物质的加成:H2 油酸、油酸盐、油酸某酯、油(不饱和高级脂肪酸甘油酯)的加成。
27:能发生加聚反应的物质
烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
28:能发生缩聚反应的物质
1.苯酚和甲醛:浓盐酸作催化剂、水浴加热 2.二元醇和二元羧酸等
29:能发生银镜反应的物质
凡是分子中有醛基(-CHO)的物质均能发生银镜反应。 1.所有的醛(R-CHO);2.甲酸、甲酸盐、甲酸某酯; 注:能和新制Cu(OH)2反应的——除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸、氢氟酸等),发生中和反应。
30:能跟钠反应放出H2的物质
A.有机:1.醇(+K、Mg、Al);2.有机羧酸;3.酚(苯酚及同系物);4.苯磺酸;5.苦味酸
B,无机:1.水及水溶液;2.无机酸(弱氧化性酸);3.NaHSO4 注:其中酚、羧酸能与NaOH反应;也能与Na2CO3反应;羧酸能与NaHCO3反应;醇钠、酚钠、羧酸钠水溶液都因水解呈碱性。
end
声明:本文内容来源于网络,转载请联系原出处。封面图片来自邑石网。高考网尊重版权,如有侵权问题,请及时与管理员联系处理。
![]()
喜欢就点个“在看”哦~![]()