人民金融·创新药指数涨1% | 突破性疗法药品审批提速,天境生物海外授权超百亿创纪录
![]()
“人民金融·创新药指数”由证券时报编制,指数每周发布一次。为避免我们资料收集过程中出现遗漏,请创新药研发企业及时将创新药研发进展通报给我们,以便我们及时计入指数并计算权重。联络邮箱:[email protected]
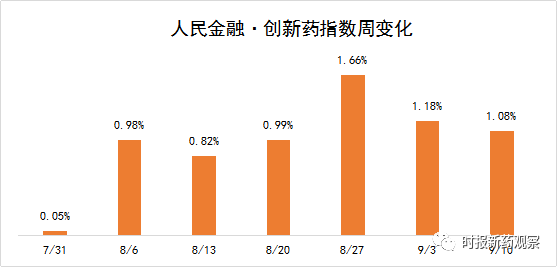
截至9月10日,“人民金融·创新药指数”报1105.95点,在最近一个发布周期内上涨了1.08%,这已是连续三周上涨超过1%,表明我国创新药研发保持稳健发展态势。指数走高的主要原因是4个1类生物药、3个1类化药获批临床,我们将其纳入了指数样本,目前“人民金融·创新药指数”的成分样本数为577个。此外,多个“人民金融·创新药指数”成分样本近期取得积极进展,如获得突破性疗法资格、临床试验状态向前推进等。
突破性疗法药品审批提速
为鼓励创新和满足临床急需,今年我国设立了多种快速审评上市通道。其中,突破性治疗药物程序针对的是临床试验期间,具有明显临床优势的创新药或改良型新药。被纳入突破性治疗药物程序的药物,有望加速获批。
在“人民金融·创新药指数”追踪的创新药中,传奇生物的LCAR-B38M细胞制剂是我国最早被纳入突破性治疗药物名单的创新药。据传奇生物招股书显示,该药将于今年底前在美国提交上市申请,并于2021年在中国提交上市申请。
最近,国家药监局药审中心专"突破性治疗公示"专栏连续更新,突破性疗法药品审批迎来提速。璎黎药业的YY-20394片于9月3日拟纳入突破性治疗品种名单,公示日期截至9月10日。9月9日,"突破性治疗公示"专栏再度更新,药明巨诺的JWCAR029拟纳入,公示日期截至9月16日。这两个创新药均是“人民金融·创新药指数”追踪的成分样本。
YY-20394是新一代高选择性PI3Kδ抑制剂,此前已获得FDA颁发的针对滤泡淋巴瘤和慢性淋巴细胞白血病适应症的两项孤儿药资格认定。在复发难治的惰性淋巴瘤患者中,璎黎药业官网显示该药已有的临床试验结果在疗效、安全性和用药依从性均优于同类已上市药品。目前,YY-20394正在开展治疗复发和/或难治滤泡性淋巴瘤患者的2期临床研究。
药明巨诺的JWCAR029为我国第4款拟纳入突破性治疗药物,是一款靶向CD19的CAR-T细胞治疗药物,6月底,该药用于治疗复发难治淋巴瘤的上市申请获受理。目前全球共有两款CAR-T产品上市,均靶向CD19。在被拟纳入突破性疗法治疗药物程序的同时,JWCAR029也被拟纳入优先审评,在两个绿色通道的加持下,JWCAR029有望成为我国首个获批上市的CAR-T产品。
7个1类新药获批临床
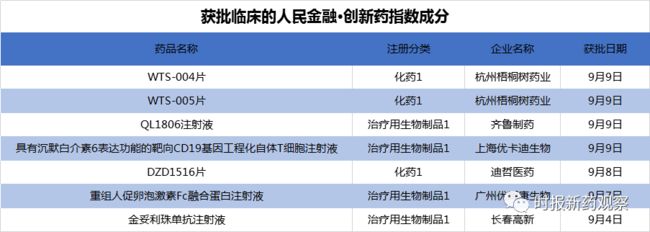
在9月4日至9月10日“人民金融·创新药指数”最新一个发布周期内,有7个创新药获批临床,包括4个生物药和3个化药,我们将其纳入了指数样本。其中杭州梧桐树药业贡献了两个,齐鲁制药、长春高新、优卡迪、迪哲医药等均贡献了一个。
9月9日,齐鲁制药美国子公司QLSF Biotherapeutics开发的1类新药QL1806注射液获临床试验默示许可,拟用于多种恶性肿瘤的治疗。QL1806是一款4-1BB抗体,目前全球尚无同靶点药物上市。作为肿瘤免疫治疗中的重要靶点,4-1BB抗体在近年的研究中显示出了强大的潜力,百时美施贵宝、辉瑞等国际制药巨头已进行了布局,国内也有不少药企在跟进。除了QL1806外,“人民金融·创新药指数”的成分样本中还有多个靶向4-1BB的抗体药物,如科望生物的ES101、怀越生物的PE0116、天眼药业的ADG106等。
齐鲁制药在生物创新药领域迎来了突破。今年以来,除QL1806外,齐鲁制药还有QL1711、QL1706等多款1类生物药获批临床。QLSF Biotherapeutics网站显示,目前其生物药管线除本次批临床的4-1BB单抗外,还有两款双抗处于临床前研究阶段。
9月4日,长春高新的金妥利珠单抗注射液有两个适应症获批临床,分别是血液系统恶性肿瘤、晚期恶性实体瘤和淋巴瘤。金妥利珠单抗注射液是CD47抗体,目前国内已有近10款获批临床,在研企业包括天镜生物、宜明昂科、信达生物、恒瑞医药和翰思生物等。
竞争激烈的背后是巨大的机会。不久前,天境生物就其CD47单抗(TJC4)的研发和商业化和艾伯维达成了一项巨额交易,交易总额高达19亿美元,创下中国生物制药企业向海外授权交易的新纪录,足见CD47在肿瘤免疫治疗领域的巨大吸引力。
临床试验进展也是“人民金融·创新药指数”重点追踪内容之一。在最近一个发布周期内,多个“人民金融·创新药指数”成分样本的临床试验向前推进。
最近,药物临床试验登记与信息公示平台显示,禾元生物启动了其重组人乳铁蛋白溶菌酶口服液的1期临床研究,适应症为用于轮状病毒引起的儿童感染性腹泻。目前临床上缺乏针对儿童病毒感染性腹泻的安全特效药物,这是业内首个对因治疗病毒性腹泻的创新生物药。
此外,优诺金生物的注射用重组人血白蛋白-生长激素融合蛋白、步长制药的BC0335颗粒也登记启动了1期临床,丹诺医药的TNP-2092胶囊登记启动了Ib/IIa期临床。但由于这些创新药临床试验最高状态未变化,依据“人民金融·创新药指数”的评分标准,审评审批进度的评分保持不变。
中国基金报:报道基金关注的一切
Chinafundnews
长按识别二维码,关注中国基金报
版权声明:
《中国基金报》对本平台所刊载的原创内容享有著作权,未经授权禁止转载,否则将追究法律责任。
授权转载合作联系人:于先生(电话:0755-82468670)
万水千山总是情,点个 “在看” 行不行!!!