Nature综述:微生物构成的氮循环网络
-
- 导读
- 论文ID
- 综述结构
- 综述内容
- 1.综述研究背景、研究目的、研究内容概述
- 2.氮全球生化循环圈:全球的氮库存、氮转化过程、氮通量
- 3.微生物构成的氮化合物的转化
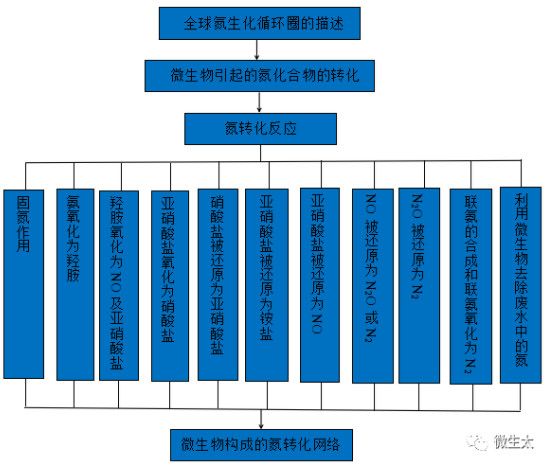
- 4.固氮作用
- 5.羟胺氧化成一氧化氮以及进一步氧化成亚硝酸盐
- 6.亚硝酸盐向硝酸盐的氧化
- 7.硝酸盐还原为亚硝酸盐的过程
- 8.亚硝酸盐还原为铵盐
- 9.亚硝酸盐还原为一氧化氮
- 10.一氧化氮还原为氧化亚氮或氮气
- 11.氧化亚氮还原为氮气
- 12.联氨的合成和联氨向氮气的氧化
- 13.利用微生物去除废水中的氮
- 14.微生物构成的氮转化网络
- 15.未被发现的生物化学反应
- 综述总结
- 点评
- 猜你喜欢
- 写在后面
本文转载自“微生太”,作者宋君,己获授权。
导读
氮是所有生物的重要组成部分,也是限制我们星球上所有生命体的主要营养成分。目前为止,可自由获得氮的最大库存是大气中的氮气,但是大部分生物是依赖生物可利用的氮形式来生长,比如铵盐和硝酸盐。而这些基质的可利用性是依赖于不同的氮转化反应,这些氮转化反应是由具有多种多样新陈代谢功能的微生物构成的复杂网络而实现的。本综述在目前获得的新研究和新发现的背景下,对当前由微生物引起的氮转化过程进行描述,包括这些微生物构成的氮转化反应,参与氮转化的微生物以及它们的生理和环境功能,也对那些并未发现但可能会发生的反应进行了描述。此外,我们对由氮转化微生物之间的相互作用而构成的复杂网络和其对全球生物化学氮循环的影响进行了讨论。
论文ID
原名:The microbial nitrogen-cycling network
译名:微生物构成的氮循环网络
期刊:Nature Reviews Microbiology
IF:26.819
发表时间:2018年
通讯作者:Marcel M. M. Kuypers
作者单位:马克斯普朗克海洋微生物研究所
综述结构
综述内容
1.综述研究背景、研究目的、研究内容概述
氮是所有生物体不可缺少的组成元素,也是合成蛋白质和核酸等关键细胞化合物的必要物质。大气中的氮气是可自由获得氮的最大库存,从生物学上来讲,它具有高度多样的可利用性,然而能够固氮的细菌和古生物菌是很少的。而其他生物体却必须依靠如铵盐和硝酸盐这种性质活泼的氮形式来提供生长,可这些生物可利用的氮在许多环境中是罕见的。这些限制性营养盐的可获得性主要是通过由微生物参与的能够改变氮氧化状态的反应来控制的。
由于工业氮肥的高投入量,导致人类活动对生物可利用氮的数量产生了极大的影响,人类生产的50%的食物需要依靠工业氮肥,这种氮肥的使用和豆科植物的种植几乎使向陆地和海洋生态系统中的氮输入量增加了一倍。因此为了预测这种氮输入的后果,我们迫切地需要了解由微生物构成的氮转化的基本机制。
由微生物形成的氮转化的过程通常被描述为由六个有序进行的不同反应过程组成的一个循环。这种观点认为一个氮气分子体首先通过固氮作用变成氨气,氨气经过同化吸收作用而转变成生物有机氮,有机氮再经过氨化作用转变成铵盐,而铵盐再通过硝化作用被氧化成硝酸盐(NH4+→NO2-→NO3-),最终再经反硝化作用被还原为一个氮气分子(NO3-→NO2-→NO →N2O→N2)或者经厌氧氨氧化作用被还原为一个氮气分子(NO2- + NH4+ → N2)。事实上,在氮循环过程并未达到上述所描述的一个平衡状态,反而是与这六个过程中截然不同的氮通量的大小有关。
过去十年来收集的基因数据揭示了参与氮转化的微生物实际上存在巨大的多种多样的新陈代谢功能。现在我们知道很多微生物可以同时发生固氮和脱氮作用。因此,由于它们代谢的多样性,几乎不可能再根据氮转化过程中经典的六个过程来划分这些微生物。故在本文中,我们将使用过程的名字,比如反硝化作用和硝化作用,而避免对微生物进行相应的分类。
根据我们目前的理解,微生物可通过14个离散型的氧化还原反应改变从-3价态到+5价态的含氮化合物(图1),不过这里不包括有机氮和氨气之间的相互转化作用。氮转化有关的酶经常在不同的微生物中被发现,而且这里包括的很多酶还是最近才被鉴定出来的。在过去的十年里,有四种新的反应被研究学者发现,它们分别是:羟胺氧化为一氧化氮的反应(图1,反应7);一氧化氮通过歧化作用转变成氮气和氧气的反应(图1,反应9);联氨的合成反应(图1,反应13);联氨氧化成氮气的反应(图1,反应12)。另外,许多新的代谢能力也被发现,比如光氧亚硝酸盐氧化和生成硝酸盐的完全氨氧化。许多新型的微生物也被鉴定出来,比如氨氧化古生菌,反硝化真核生物有孔虫和共生异养的固氮蓝藻。
图1.氮全球生化循环圈:全球的氮库存、氮转化过程、氮通量
本文中,我们在这些新发现的背景下,对目前由微生物引起的氮转化过程进行理解,并对这些微生物构成的氮转化反应,参与氮转化的微生物以及它们的生理和环境功能进行描述,也对那些并未发现但可能会发生的反应进行了描述。此外,我们对由氮转化微生物之间的相互作用而构成的复杂网络和其对全球生物化学氮循环的影响进行了讨论。
2.氮全球生化循环圈:全球的氮库存、氮转化过程、氮通量
如图1所示,图中灰色方块表示氮储存量,束缚在岩石和沉积物中的最大氮存量是氨(1.8×10^10^ Tg氮),虽然这种束缚氨经侵蚀后可被生物利用,但是它在整个氮循环生化圈中起的作用是很小的,而陆地中可自由获得的氨的储存量是未知的,海洋中的氨的氮储存量被估计为340-3600 Tg;全球中可自由获得氮的储存库是大气中的氮气(约为3.9×109Tg氮),紧接着是有机氮、硝酸盐、氧化亚氮中氮的储存量;而全球的亚硝酸盐和一氧化氮中的氮储存量可以忽略不计。
在这些氮储存库中形成的全球生化的氮循环主要是因为以下六个不同的氮转化过程:同化作用(Assimilation)、氨化作用(ammonification)、硝化作用(nitrification)、反硝化作用(denitrification)、厌氧氨氧化作用(anammox) 和固氮作用(nitrogen fixation)。我们从可查文献中估计了这些过程中的年度氮通量,并作出了如图1所示的简单的假设,在本图中,我们用每年所含Tg氮来表示在这些主要含氮的物质之间的氮通量,其中绿色、蓝色和红色方块分别代表每年的陆地氮通量、每年的海洋氮通量以及每年人为制造的氮通量。其中最明确的氮通量包括氮的流失和固定,因为它们是重点研究的对象。如图1所示,虽然这些氮通量相对较小,但它却可以调控这些生物可利用氮的可用性,而这些生物可利用氮在很大程度上可以通过生物碳泵来控制大气中二氧化碳的去除。据目前估计,生物固氮量(300Tg氮/年)和人工固氮量(125Tg/年)的总和已经超过了通过厌氧氨氧化和反硝化作用产生的氮气的量(350Tg氮/年)。并不是所有的经一氧化氮还原产生的氧化亚氮都可以进一步的被还原为氮气,而每年从海洋和陆地环境中释放的氧化亚氮的氮通量分别为4Tg和12Tg,虽然与其他氮形式的通量相比,氧化亚氮的氮通量相对较小,但是它对环境影响却很大,因为氧化亚氮是破坏臭氧层的主要气体,而且它还是一个强大的温室气体。
如图1所示,在这些不同的氮转化过程中有着截然不同的氮通量,它们并没有达成一个平衡的氮循环,这和论文及教材中经常描述的一样,而最大的氮通量跟氨气和有机氮的相互转化有关。仅在海洋环境中,每年与氨化作用和氨同化作用有关的氮通量(8800Tg氮/年)比海洋中氮的流失和获得的总和氮通量(约400Tg氮/年)高出了一个数量级。另一个巨大的氮通量(约2000Tg氮/年)跟硝化作用(NH4+→NO2-→NO3-)有关,这也正好可以解释为什么在海洋中氨盐的浓度虽然不高,但是海洋氨氧化古生菌却是最丰富的微生物之一。与硝酸盐同化有关的氮通量和硝化作用的氮通量是一个数量级的,即海洋浮游植物每年可减少约2000Tg的硝酸盐氮。而之相比,异化硝酸盐还原为氨的氮通量可能会比较小。虽然目前还没有可利用的对陆地环境中氮通量进行估计的数据,但是因为陆地植物与海洋植物相比对氮的需求比较低,对于陆地植物来说,平均每固定40个分子的碳才需要1分子的氮,而对于海洋植物来说,平均每固定6.6个分子的碳就需要1分子的氮,所以陆地中与同化作用相关的氮通量大概是海洋中的1/6。所以假设在稳定状态下(即氮的获得和流失相等),我们用海洋中的氮通量除以6来估计陆地环境中硝化作用与氨化作用中的氮通量。
3.微生物构成的氮化合物的转化
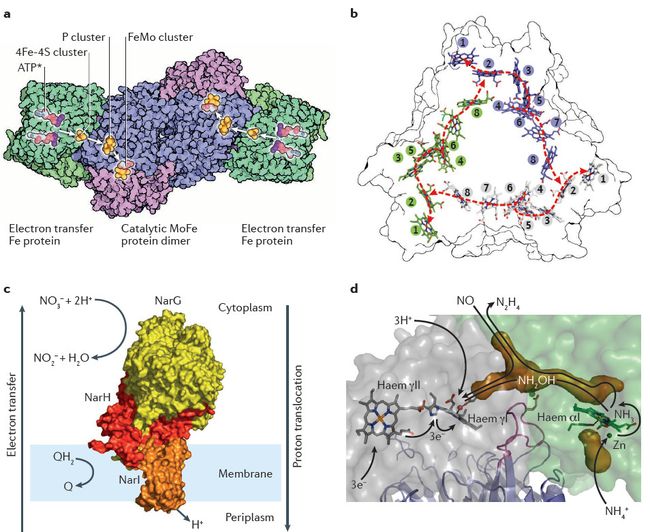
如图2所示微生物携带的酶可以执行14个氧化还原反应,在这些氧化还原反应中主要包括8种不同氧化状态下的无机氮(限制酶的中间产物和它们的氧化还原状态没有显示)。氨气与有机氮的相互转化不涉及氮原子氧化还原状态的改变。其中红色的表示还原反应,蓝色的表示氧化反应,绿色的表示歧化反应和归中反应。接下来是执行各种反应的酶:同化硝酸盐还原酶(NAS、NasA和NirA);膜结合酶(NAR, narGH);周质(NAP, napA)异化硝酸还原酶;亚硝酸盐氧化还原酶(NXR, nxrAB);一氧化氮氧化酶(NOD, hmp);含血红素(cd1-NIR, nirs)和含铜(Cu-NIR, nirk)的亚硝酸还原酶;依赖红细胞色素(cNOR, cnorB)、依赖对苯二酚(qNOR, norZ)和含铜的依赖对苯二酚(CuANOR)一氧化氮还原酶;依赖NADH细胞色素P450的一氧化氮还原酶(P450NOR, p450nor);黄铜-二铁一氧化氮还原酶(NORvw, norVW);混合集群蛋白质酶(HCP, hcp);羟胺氧化还原酶(HAO, hao);羟胺氧化酶(HOX, hox);氧化亚氮还原酶(NOS, nosZ);一氧化氮歧化酶(NO-D, norZ);同化亚硝酸盐还原酶(cNIR, nasB和nirB);周质异化细胞色素C亚硝酸盐还原酶(ccNIR, nrfAH);ε -羟胺氧化还原酶(εHAO, haoA);八面体血红素亚硝酸盐还原酶(ONR);八面体血红素连四硫酸盐还原酶(OTR);钼-铁(MoFe, nifHDK)、铁-铁(FeFe, anfHGDK)和钒-铁(VFe, vnfHGDK)固氮酶;联氨脱氢酶(HDH, hdh);联氨合成酶(HZS, hzsCBA);氨单加氧酶(AMO, amoCAB);微粒甲烷单加氧酶(pMMO, pmoCAB);氰酸酯酶(CYN, cynS);尿素酶(URE, ureABC)。
4.固氮作用
大气中的氮气是可以自由获得氮的最大库存,但从生物学上讲,只有微生物携带的金属固氮酶可以将氮气固定为氨气。固氮酶普遍分布在细菌和古生菌中,这使它们在生物可利用氮被消耗的环境中有一个非常有利的竞争优势。总共有三种类型的固氮酶:钼-铁(MoFe)、铁-铁(FeFe)和钒-铁(VFe)固氮酶,它们有相似的序列、结构和功能特性,但它们的金属系数不同,而所有的固氮酶都是有两种物质组成(图3a)。anfDGK, vnfDGK 或 nifDK 分别在活动中心编码含铁、钒或者钼的固氮酶的催化成分,另外,anfH、vnfH 或 nifH 编码含铁的电子转运蛋白(又称固氮还原酶或铁蛋白)。NifH 是用来检测环境中有固氮作用微生物的标记基因。土壤固氮细菌vinelandii 可以编码这三种类型的固氮菌,然而其它微生物,比如海洋固氮菌 Trichodesmium spp .只含有钼铁固氮酶。钒是很少被限制的,但钼和铁分别在陆地和海洋环境中是罕见的,因此钼和铁可以分别在相应的生态系统中限制固氮作用。
在固氮作用中,一个电子载体比如铁氧化还原蛋白会首先会减少铁蛋白,随后会减少催化剂组分,这需要铁和催化蛋白的分离和再结合。每固定一分子的氮分子,需要消耗16分子的ATP。额外的生物能量损耗是由于强大的还原剂如铁氧化还原酶的生产和不稳定含氧固氮酶的保护。由于氧气的暴露会使固氮酶失效,故含氧的光能利用菌,比如Trichodesmiumspp.、Crocosphaera watsonii 和Nodularia spp. 会使固氮作用和光合作用从空间上(比如在专门的固氮异形细胞里)或者时间上分离。而非光和作用的生物体生活在含氧环境中则需要一些机制从氧气中保护它们的固氮酶,比如增加氧气呼吸、超氧化物歧化酶的解毒作用和固氮酶的构象等机制。而关于存在能够用一个不寻常的固氮酶去进行一个完全不同的、对氧气不敏感的固氮途径的观点也在最近被反驳了。
虽然现在用于固氮作用的真核生物还没有被发现,但是许多有固氮作用的微生物都可以和真核生物共生。例如单核蓝藻菌UCYN-A是固氮微生物中最普遍的一种,它与小型的单核海藻共生,并在海洋固氮作用中起着重要的作用。共生固氮微生物也是动物肠道菌群的一部分,比如在白蚁类和双壳类中发现的一些特殊细菌。此外,根瘤菌目的一些固氮成员生活在豆科农作物的根瘤关节处,像苜蓿、黄豆、豌豆和大豆等植物,这些农作物提供了全球20%的食物蛋白。
5.羟胺氧化成一氧化氮以及进一步氧化成亚硝酸盐
氨气向羟胺的有氧氧化是一个吸热反应,因此,所有的氨氧化剂可以使羟胺氧化从而保存能量。而需氧氨氧化细菌用八面体血红素羟胺氧化还原酶(HAO)可以将羟胺氧化成亚硝酸盐。但最近研究表明,HAO将羟胺氧化的结果不是亚硝酸盐,而是一氧化氮,然后一氧化氮在一种未知的酶作用下才会被进一步氧化成亚硝酸盐。尽管目前这种未知的催化酶还没有被最终确定下来,但是含铜的亚硝酸还原酶(Cu-NIR, nirk)却可以在一氧化氮被氧化成亚硝酸盐的相反方向起到催化作用。所有的氨氧化细菌,包括新发现的可以一步使氨气彻底氧化成硝酸盐的消化螺菌属细菌,它们都包含氨单加氧酶(AMO)和羟胺还原酶(HAO),相比之下,已知的氨氧化古生菌却不能编码羟胺还原酶(HAO),而使羟胺氧化反应发生的古生菌酶还是未知的。
八面体血红素羟胺氧化还原酶(HAO)属于八面体血红素蛋白家族,在很多微生物中都可以被发现。厌氧氨氧化细菌的基因可以编码约十种的类似于HAO的蛋白,而其中的一种蛋白也可以使羟胺氧化成一氧化氮。在种厌氧氨氧化细菌中,这种羟胺氧化酶(HOX)可以回收从联氨合成酶中泄漏的羟胺。
甲烷氧化细菌也可以产生羟胺,这是由于它们非特异的氨氧化反应。属于变形菌门、疣微菌门和NC10菌门中的多种多样的甲烷氧化菌可以编码类似HAO的蛋白,而这种蛋白很有可能使羟胺氧化成一氧化氮,一氧化氮还可以进一步被氧化成亚硝酸盐或者被还原成氧化亚氮。目前,在甲烷氧化细菌中发生的这种反应是否可以直接有助于能量保存还未可知。
6.亚硝酸盐向硝酸盐的氧化
亚硝酸盐的氧化是产生硝酸盐的主要生化途径,而这一过程可以通过亚硝酸盐氧化还原酶(NXR)来完成。NXR可以被需氧的亚硝酸盐氧化细菌、不产氧的光能利用菌(比如荚硫菌属的KS1、红假单胞菌属的LQ17)、厌氧氨氧化细菌编码。而需氧的亚硝酸盐细菌在亚硝酸盐氧化还原酶(NXR)的作用下会直接发生亚硝酸盐氧化反应从而来保存能量,但是厌氧亚硝酸细菌却不能做到。此外,厌氧氨氧化细菌会将厌氧亚硝酸氧化反应和碳固定作用结合起来。
亚硝酸氧化细菌具有丰富多样的代谢功能,而且还可以在不是亚硝酸盐的基质上生长。的确,消化螺菌属的一些细菌可以将氨气彻底氧化成硝酸盐,当消化螺菌属以硝酸盐为基质进行呼吸作用时,如果在氢气环境中生长会进行有氧呼吸,而在有机酸环境中生长则进行厌氧呼吸。亚硝酸盐氧化还原酶(NXR)跟细菌和古生菌的硝酸盐还原酶也相关,亚硝酸盐氧化细菌在NXR的催化作用下进行硝酸盐还原反应。
亚硝酸盐和氨氧化微生物在农业土壤中可以协同作用将氨基化肥转变成硝酸盐,它们在肥料向河水和地下水中的流失过程中起着关键的作用,而化肥的流失会导致河流、湖泊、海岸水域的水体富营养化。与上述同样的协同作用在污水处理工厂中也会被用做去除氮浓度的第一步处理。在海洋环境中,亚硝酸盐氧化细菌会生产硝酸盐,而硝酸盐是海洋中最主要的生物可利用氮,同时亚硝酸盐氧化细菌也有助于碳的固定。
7.硝酸盐还原为亚硝酸盐的过程
硝酸盐被还原成亚硝酸盐是用来进行呼吸作用的(此过程又被称为异化硝酸盐还原反应),同时也使氮被同化成生物量。硝酸盐被还原为亚硝酸盐的反应都可以由来自三个领域中的微生物来完成,而这些微生物都存在于含有硝酸盐的缺氧环境中,包括土壤、低氧区、海洋沉积物和人类胃肠道中。这些反应可以被膜结合硝酸还原酶(NAR)或者周质的硝酸还原酶(NAP)催化,而且许多生物体,包括副球菌属的反硝化细菌都含有NAR和NAP。NAR在细胞质中还原硝酸盐,并将质子释放到细胞质中(图3c),并通过质子的动能量直接有助于节约能量。相比之下,NAP在细胞外周质中将硝酸盐还原为亚硝酸盐,因此不改变质子位置。
异化的硝酸盐还原为亚硝酸盐不仅仅是反硝化作用的第一步。许多微生物,比如广泛分布在淡水和海洋沉积物中的巨大硫氧化贝日阿托氏菌就是先将硝酸盐还原为亚硝酸盐,再进一步还原为氨盐。还有许多微生物,比如海洋进化分支SAR11的一些成员只把硝酸盐还原为亚硝酸盐。硝酸盐的还原对于其它氮循环过程来说是亚硝酸盐的一个主要的来源,比如需氧的亚硝酸盐氧化和厌氧氨氧化作用。异化的硝酸盐还原反应还可以与有机物、甲烷、硫化物、氢气或者铁等电子供体的氧化作用相结合。
硝酸盐是真核生物的主要氮源,而细菌和古生菌中都含有同化硝酸盐还原酶(NAS)。考虑到硝酸盐支持了至少20%的海洋藻类的生长,所以在海洋中,硝酸盐的同化吸收作用很可能已经超过了氮循环过程中其它大部分的氧化还原反应。同化硝酸盐还原酶(NAS)与同化亚硝酸盐还原酶共同产生了氨气,而这氨气也成为了生物量的一部分。因为NAS存在于细胞质中,所以硝酸盐的同化需要用依赖ATP的转运蛋白将硝酸盐转运到细胞内。由于这种能量的需求,NAS的活性会在充满氨的环境中被抑制(比如肥沃的土壤中)。
细菌和古生菌的同化硝酸盐还原酶(NAS)、周质的硝酸还原酶(NAP)、膜结合硝酸还原酶(NAR)和亚硝酸盐氧化还原酶(NXR)都属于二甲亚砜还原酶家族,而真核生物的同化硝酸盐还原酶属于亚硫酸盐氧化酶家族,这就表明硝酸盐还原酶有多种起源。同化硝酸盐反应与异化硝酸盐还原反应的途径间的差别并不是绝对的,从原理上讲,亚硝酸盐的产生是由于在呼吸链上可以进一步减少硝酸盐的还原反应,但与之相反的是,分支杆菌结核病已被证实可以用NAS复合体来进行硝酸盐的同化吸收。
8.亚硝酸盐还原为铵盐
亚硝酸盐还原为氨盐的反应可以用做同化作用,也可以用作异化作用。异化亚硝酸盐反应大部分是由嗜热的热球菌属家族的细菌来完成的,这种反应是由nrfAH编码的周质的细胞色素C亚硝酸盐还原酶(ccNIR)、八面体血红素亚硝酸盐还原酶(ONR)或者八面体血红素连四硫酸盐还原酶(OTR)催化完成的,目前尚不清楚后两种酶是否能用于呼吸作用、亚硝酸盐或羟胺的解毒作用中。亚硝酸盐还原为铵盐的过程中还涉及到中间产物羟胺的形成,而羟胺一直和相应的酶结合在一起直到转变成铵盐。
有趣的是,厌氧氨氧化细菌K. stuttgartiensis在缺少产生铵盐的亚硝酸盐还原酶的情况下,还可以将亚硝酸盐还原为铵盐,因此可以推测亚硝酸盐还原为铵盐是由一种类似于HAO的蛋白酶来完成的。最近研究表明,一种羟胺还原酶(HAO)可以被ε-变形菌门(比如弯曲杆菌和鹦鹉螺菌)编码,此酶被称为εHAO,也可以将亚硝酸盐或羟胺还原为铵盐,只不过效率比较低。
异化的亚硝酸盐还原为铵盐的反应是异化硝酸盐还原为铵盐(DNRA)过程中的关键反应。微生物可以利用异化硝酸盐还原为铵盐反应(DNRA)和电子供体的氧化的耦合来生长,比如有机物、二价铁、氢气、硫化物、甲烷等电子供体。但DNRA对环境的重要性还未可知,而且在海洋和湖泊等沉积物中当与硝酸盐有关的电子供体超量时,DNRA反应就更偏爱转向于反硝化作用。
同化亚硝酸盐还原酶可以产生氨,而且它和同化硝酸盐还原酶(NAS)一样普遍分布,这两种酶经常被相同的nas操纵子编码。在海洋中亚硝酸盐最大值的形成是由于浮游植物中硝酸盐的同化吸收作用与亚硝酸盐的还原作用并没有偶联,从而可以释放更多的亚硝酸盐,但这种未偶联的生理原因并不清楚。
9.亚硝酸盐还原为一氧化氮
许多微生物都有将亚硝酸盐还原为一氧化氮的能力,比如变形菌、厌氧氨氧化菌和拟杆菌。这些微生物在很多环境中都能被发现,比如在土壤、低氧区、海洋沉积物等环境中(在这些环境中硝酸盐可被利用且含氧量低)。这种反应可以由两种不相关的酶催化,包含血红素的cd1亚硝酸盐还原酶 (cd1-NIR; 被 nirS编码) 和含铜的亚硝酸盐还原酶(Cu-NIR; 被nirK编码) ,而且这两种酶在细菌和古生菌中都普遍分布。这两种酶都存在于外周质细胞内,不会直接有助于节约能量。这两酶也可以一起出现在同一个微生物内,比如海洋红嗜热盐菌。
通常nirS 和nirK 被用作基因标记来研究环境中的反硝化菌,而且这些基因在其他很多微生物中都存在,包括厌氧氨氧化细菌、亚硝化细菌、甲烷氧化细菌、氨氧化细菌和古生菌。除了cd1-NIR和Cu-NIR,其他亚硝酸盐还原酶也可能存在。比如,一些厌氧氨氧化细菌并不包含nirS 和nirK 这两种基因,但却可以将亚硝酸盐还原为一氧化氮。而为了执行这种反应,这些细菌可以利用类似于HAO的八面体血红素氧化还原酶。
10.一氧化氮还原为氧化亚氮或氮气
一氧化氮是一种信号分子,一种有毒物质,也是反硝化作用、硝化作用和厌氧氨氧化作用过程中的一个中间产物。此外,可催化需氧的反硝化作用的细菌可以将2分子的NO变成1分子的N2和1分子的O2。能够使一氧化氮还原的微生物在环境中可以广泛的被发现,包括废水处理工厂、农业土壤、海洋沉积物、海洋低氧区。由微生物引起的一氧化氮还原反应是氧化亚氮的主要来源,而氧化亚氮是一个强大的温室气体(比二氧化碳的温室效应强烈310倍),也是破坏臭氧层的主要物质。能够产生氧化亚氮的一氧化氮还原酶(NOR)被用于一氧化氮的解毒作用或呼吸作用。属于不同组的酶从黄素蛋白到血红素铜氧化酶,它们都通过生命树而广泛分布。黄铜-二铁蛋白例如黄铜-二铁一氧化氮还原酶(NORvw, norVW)可以通过像硫酸盐还原细菌(牡蛎中的脱硫弧菌)来解毒一氧化氮。其他的NOR类型的酶是从真菌线粒体中发现的依赖NADH细胞色素P450的一氧化氮还原酶(P450NOR, p450nor),比如镰刀菌属的马拉色菌以及最近在大肠杆菌中发现的混合聚类蛋白HCP。
血红素铜氧化酶家族包括末端氧化酶类,比如依赖红细胞色素(cNOR, cnorB)、依赖对苯二酚(qNOR, norZ)和含铜的依赖对苯二酚(CuANOR)一氧化氮还原酶,它们都在利用一氧化氮进行的呼吸作用中都起着重要作用。氧化亚氮是反硝化作用的中间产物,而NOR存在于反硝化细菌和假单胞菌属等微生物中。氧化亚氮对于一些微生物来说也可以是最终产物,比如绿叶假单胞菌。氨氧化细菌可以在硝化-反硝化作用中可以产生氧化亚氮,而在硝化-反硝化作用中NOR是被用来在亚硝酸盐还原过程中还原产生的一氧化氮的。在氨氧化细菌和能够一步彻底氧化氨到硝酸盐的细菌培养中,氧化亚氮也可以通过细胞外的中间产物一氧化氮和羟胺的非生物反应产生。此外,氨氧化细菌还可以在羟胺氧化中产生的一氧化氮还原酶(NOR)的催化作用下产生氧化亚氮。和氨氧化细菌相似,嗜甲烷细菌也可以通过在羟胺氧化和亚硝酸盐还原中产生的一氧化氮还原酶(NOR)的催化作用产生氧化亚氮。与此相比,氨氧化古生菌只是通过中间产物一氧化氮和羟胺的非生物反应产生氧化亚氮。
氮肥的使用大幅度增加了氧化亚氮的排放。由于氮转化微生物的协同作用,3%-5%的氮作为农业氮肥被转化成氧化亚氮。氮肥越来越多的被用来种植生物燃料,这为代替化石燃料提供了可能。但也因此形成了一个困境,越多的氮肥被用来生产生物燃料,就会有越多的氧化亚氮被排放出来。为了生产生物燃料而对氮肥的使用,抵消了由于减少对化石燃料的使用降低的温室效应的效果。
一氧化氮转变成氮气和氧气的歧化作用是最近被发现的新的氮转化反应。从湖泊和湿地等富含甲烷和硝酸盐的缺氧系统中发现的微生物(比如Ca.Methylomirabilis oxyfera)用这种歧化反应从亚硝酸盐中产生自己的氧气。微生物Ca.Methylomirabilis oxyfera可以在缺氧环境中生存,也可以利用需氧的甲烷氧化途径。这种歧化反应包含一种不寻常的酶qNOR,暂时称这种酶为一氧化氮歧化酶(NO-D)。一氧化氮的歧化反应比之前预想的更为普遍,与此相似的是,这种不寻常的酶qNOR的基因序列在其它菌门中也存在,比如γ-变形菌门的细菌HdN1和拟杆菌门的细菌。
11.氧化亚氮还原为氮气
由微生物引起的氧化亚氮向氮气的还原,是减少这种强大温室气体的主要途径。已知的催化这种反应的酶只有氧化亚氮还原酶(NOS),而这种酶存在于细胞外周质中,这对于由质子动能引起的能量节约并没有直接的促进作用。来自于变形菌门、拟杆菌们、绿菌门的多种多样的细菌与来自于泉古菌门、嗜盐菌门的古生菌都能利用氧化亚氮还原酶(NOS)。在大肠杆菌中发现的稍微不同的能够编码NOS的基因揭示了人们忽视了土壤中NOS基因序列的多样性。编码NOS变体的有机体经常不含有氧化物还原酶。一些真核生物,比如有孔虫类或者网足虫目也可以减少氧化亚氮,但是它们的酶机制还不清楚。
长久以来,人们都认为氧化亚氮还原酶(NOS)比其他氮化合物还原酶对O2、pH、硫化物更敏感。基于这种明显的敏感性,氧化亚氮向环境中的排放,完全是由于在能够使硝酸盐一直被还原为氮气的生物体(这就是所谓完全反硝化菌)内NOS的活性被抑制。此外,由于这些不完全反硝化菌的相互作用,比如只能进行亚硝酸盐还原为氧化亚氮反应,或者氧化亚氮还原为氮气的反应等的微生物,它们生态位的差别在很多环境中也会导致氧化亚氮的产生和消耗间的不平衡,比如土壤和海洋环境。
12.联氨的合成和联氨向氮气的氧化
人们普遍认为只有O2才能激活氨气,而生物可利用氮只有通过反硝化作用被转化为氮气才能损失。然而以亚硝酸盐作为终端电子接受者转成氮气的厌氧氨氧化反应却推翻了这两种教条观点。联氨合成酶(HZS, hzsCBA)是唯一已知的可以激活厌氧氨的酶,而且它只在属于浮霉菌门中的五种厌氧氨氧化细菌中被发现。HZS也是唯一已知的可以使两种离散的氮化合物形成N-N化合键的酶,在一个含有两步的反应中会产生中间产物联氨。而联氨合成的假设机制是从一氧化氮还原为羟胺开始的,然后羟胺和氨一起发生归中反应产生联氨,而联氨在自然界中是最强有力的还原剂之一。在这种反应中,羟胺从一个活动中心转移到另一个活动中心,这样在联氨合成酶HZS的作用下羟胺就会损失。编码HZS的基因有两个,分别是hzsA 和 hzsB,这两种基因一般会被作为环境中厌氧氨氧化细菌的标记基因。
通过联氨脱氢酶(HDH, hdh)可以将联氨氧化成氮气。通过对氨基序列的测定,知道了这种酶与羟胺氧化还原酶(HAO)和羟胺氧化酶(HOX)有关,但联氨脱氢酶(HDH)会被羟胺抑制,而且它只能氧化联氨。联氨的氧化作用发生在被称为厌氧氨氧化体的一种独特的膜结构中,而且很可能与能量节约有直接的关系。有趣的是,厌氧氨氧化细菌的所有分解代谢酶(HDH, HZS, NIR, HOX 和 NXR)都只存在于厌氧氨氧化体中。
联氨脱氢酶(HDH)主要负责向大气中释放氮气,在过去的数十年,关于在海洋中的厌氧氨氧化过程已经很清楚了,而且该过程在陆地生态系统中也有着非常重要的作用。
13.利用微生物去除废水中的氮
自工业革命以来,农耕、化石燃料的燃烧、家庭和工业产生的废水等一直都是造成氮污染的主要因素,而氮污染严重影响着地球上生命的生存。在过去的四十年,当发现过量的氮会导致水体富营养化以及氨盐的毒性可以造成鱼类的死亡时,氮就被认为是废水中重要的污染物,因此,在原本用来去除有机碳的废水处理工厂里都又添加了氮去除系统,然而大部分常规的废水处理工厂并没有进行对氮的去除。
在很多自然生态系统中,珍贵的氮都是是被循环回收和保存的,但与此对比,在废水处理工厂却需要通过设计将水体中的铵盐转变成氮气释放到大气中。在废水处理工厂,有机碳会首先被去除,然后将有机碳贫乏但铵盐氮丰富的水体送入到氮去除循环系统中。传统的去氮系统是依靠硝化作用(NH4+→NO2-→NO3-)将氨盐氧化成硝酸盐,再依靠反硝化作用(NO3-→NO2-→NO→N2O→N2)将硝酸盐还原为氮气。但硝化作用需要大量曝气增加氧气来创造条件使氨盐氧化成硝酸盐(平均每1分子的氨需要2分子的O2),然后通过外源添加有机碳(一般为甲醇)诱导可以将硝酸盐还原为氮气的反硝化作用发生。因此传统的去氮方法很费财力、精力和资源,而且这个过程中还会产生温室气体N2O。为了缓和这个问题,现在很多不同结构的反应器被运用起来,比如将富含有机碳的部分原始废水直接输入到反硝化作用的步骤中,或者对单独的一个池子里进行间接性的曝气,以促进硝化作用和反硝化作用的进行。
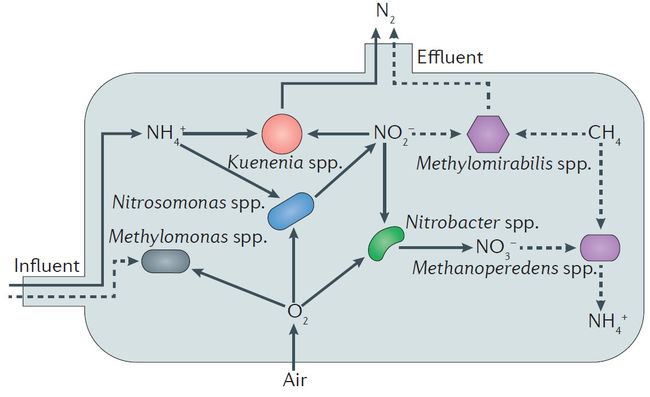
在过去数十年里,厌氧氨氧化的出现,被用作去除氮的可供选择的一种方法。在一些简洁的生物反应器中,需氧的氨氧化细菌(比如亚硝化单胞菌属)在氧气限制条件下可以进行一半的生物可利用氨向亚硝酸盐的转化,这被称为局部亚硝化。接下来在细菌(比如Kuenenia spp.)作用下发生厌氧氨氧化,将亚硝酸盐和剩下的氨盐转变成氮气(图4中实线所示)。在这种部分亚硝化厌氧氨氧化的系统中,可以生成硝酸盐的需氧亚硝酸盐氧化剂(比如消化螺菌属Nitrospira spp. 或者消化杆菌属 Nitrobacter spp )是不受欢迎的,因为它们降低了氮去除的效率。这种亚硝化厌氧氨氧化生物反应器与传统的氮去除系统相比,需要的曝气较少,而且不需要再另添加有机碳,产生的N2O气体也较少。目前,这种亚硝化厌氧氨氧化生物反应器在污水处理(比如来自厌氧污泥消化器的废水)中也越来越多的被应用,而这些系统在含有较低铵盐浓度的全市规模的废水处理中的应用,为可持续的治理废水铺平了道路。
最近发现的一些氮循环中的微生物也可以应用到废水治理中。可以使氨氧化到亚硝酸盐的古生菌和彻底氨氧化为硝酸盐的细菌在废水处理工厂中被发现,但它们在这些系统中所扮演的角色还不是很清楚。在氧气受限制的氮去除系统中(比如亚硝化厌氧氨氧化反应器),那些可以进行彻底的氨氧化成硝酸盐的细菌可能跟传统的氨氧化过程一样产生亚硝酸盐。而令人兴奋的是,新发现的依赖亚硝酸盐和依赖硝酸盐的厌氧甲烷氧化微生物为废水的治理提供了一种新的可能。一个联合着厌氧甲烷氧化菌(比如ethylomirabilis spp. 和Methanoperedens spp.)和可进行厌氧氨氧化反应的微生物的反应器,就可以同时去除氨盐、硝酸盐和甲烷(图4中虚线所示)。这样的系统已经在实验室的条件下建立起来了,但这样的全规模的污水处理系统还没有在实际环境中被实施,而在这样系统中,需氧的甲烷氧化剂(比如Methylomonas spp.)可以有助于甲烷的去除。
对氮循环微生物的基本生理和生化以及它们的应用的研究正在一步一步进行着,新的微生物的发现会引领更高效和持续发展的去氮系统,反之亦然。很明显地,这种趋势可以保护环境而造福我们的子孙后代。
14.微生物构成的氮转化网络
微生物在氮转化方面的多样性是惊人的,每一种微生物都有各自最适宜的生理生长条件。由于在自然界中生长环境是多变的,而且很少能达到最优条件,所以微生物个体对氮的转化效率必然是低效的。然而,在自然界中依靠微生物群落的氮转化效率比依靠单个微生物的转化效率高多了。因此,在微生物群的作用下,几乎没有生物可利用氮逃逸到大气中,而以氮气的形式损失的少量的氮也会由于固氮作用而达到平衡。这种明显的氮体内平衡不仅是全球生物圈的特征,也是很多生态系统的特征,比如森林土壤和海洋环流。这些能够高效进行氮回收的必需的微生物群落即使因为环境扰动而使微生物的物种组成发生了改变,它们仍然会保持执行氮转化的反应。由微生物连接起来的氮转化过程在自然和人为建造的生态系统中都形成了一个复杂的网络(图5)。
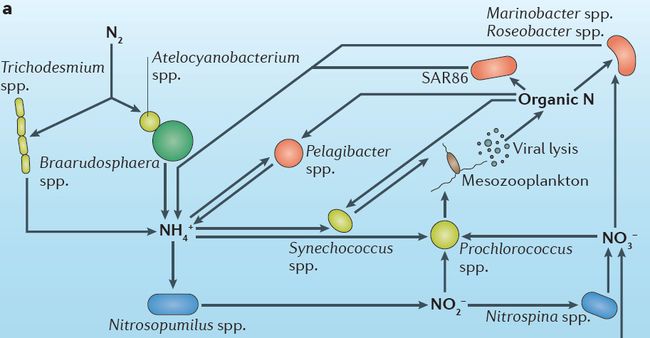
世界上最大的生态系统-海洋环流,因为大量的氮回收利用而达到了一个氮平衡。在这里主要的氮转化过程是由蓝藻细菌(比如Prochlorococcus spp.)完成的氮的同化吸收作用、由浮游动物和异养细菌(比如Pelagibacter spp. )完成的氨化作用、由Nitrosopumilus spp. 和Nitrospina spp. 完成的硝化作用(如图5a)。而由微生物群(比如Trichodesmium spp.和Atelocyanobacterium spp. )完成的固氮作用在海洋环流中属于相当小的氮转化过程,但因为可发生固氮作用的领域非常大,所以它是向海洋中提供生物可利用氮的主要途径。
与海洋环流相比,那些低氧区的水域虽然不到公海海域的1%,但却占海洋领域氮损失的30%-50%。在这里,厌氧微生物(比如Scalindua spp.)可以与需氧的生物体(Nitrosopumilus spp. 和 Nitrospina spp. )共生。由微生物构成的氮转化网络在公海的低氧区是非常复杂的,彼此之间以及与旁边发生的氮转化过程都是已知的(如图5b)。
和低氧区水域相似,在废水处理工厂也是以不平衡的氮转化为特点。这些人为设计的系统主要用来将铵盐转变成氮气排到空气中的。农业土壤是人为建造的最大的生态系统,它们由微生物构成的氮转化系统已经受到了人工输入的氮的强烈影响。种植的豆科农作物和固氮微生物群形成了共生关系,这大大增加了环境中氮的输入量。固氮微生物菌(比如Bradyrhizobiumspp.)经常生活在特定的根瘤中,并给豆科植物提供铵盐(如图5c),而泄漏到周围土壤中的铵盐又可以促进其他微生物的氮转化过程,比如需氧的氨氧化作用。在稻田领域,人工肥料的使用导致了强烈的硝化作用,并加大了氮的损失。Nitrosopumilus spp. 和Nitrospina spp. 在氨氧化到硝酸盐的过程中是相互合作的,在很多环境中,硝化作用是由氨氧化和亚硝酸盐氧化微生物的集合体共同执行的,同时,它们也分别竞争铵盐和亚硝酸盐。由于不同的新陈代谢,在微生物菌群之间同样存在对基质营养的竞争。比如Nitrospira spp.、Methylomirabilis spp.、Brocadiaspp.、Methanoperedens spp. 和Pseudomonas spp.都竞争亚硝酸盐(如图5d)。微生物之间既可以相互合作,同时也会相互竞争,而对于控制这些相互合作的因素的了解还比较少。就像有时候,一个生理特征可以解释那些与氮转化有关的微生物菌群在环境中占主导作用的原因,例如,在氨耗损的环境中,氨氧化古生菌与细菌相比而言比较丰富,主要是因为古生菌对氨更有亲和力。但是最近研究发现了一种陆地细菌硝化螺菌属(Nitrospira inopinata)可以完成一步式彻底氨向硝酸盐的氧化,它对氨的亲和力比陆地培养的所有古生菌还要高,但它在氨耗损的环境中却没有占主导地位。微生物群构成的氮转化网络的成功也依赖与其他因素,比如可供选择的基质和细胞能量的需求,而这些变量在微生物构成的氮转化网络形成过程也起到有一定的作用。
15.未被发现的生物化学反应
在过去十年里许多由微生物引起的新的氮转化反应和途径被发现,而基于热力学方面的考虑,应该会存在由微生物引起的更进一步释放能力的反应(反应15—26)。然而这里有一些反应可以由已知的酶催化,但有一些反应却需要迄今为止未被发现的生物化学催化剂(反应15—19,25和26)。例如依赖硝酸盐的氨氧化作用(反应15)不能通过厌氧氨氧化途径来进行,因为氨盐需要首先被氧化成中间产物羟胺或者类似的含氧物质。
相似的,激活氨盐的新的生化途径对于依赖铁和锰的氨氧化作用是必需的(反应16—19)。
相反地,一些歧化反应(反应20—24)可以由已知的微生物用现存的生化机制实施。厌氧氨氧化细菌可以进行对亚硝酸盐(反应20)和一氧化氮(反应21)的歧化作用。
相似的,由亚硝酸盐转化成氧化亚氮和硝酸盐的歧化反应(反应22)、由一氧化氮转化成亚硝酸盐和氧化亚氮的歧化反应(反应23)或者是由一氧化氮转化成硝酸盐和氧化亚氮的歧化反应(反应24),在理论上可以由需氧的亚硝酸盐氧化细菌完成。
这些微生物可以利用亚硝酸盐氧化还原酶使亚硝酸盐氧化成硝酸盐,而存在于硝化杆菌属(Nitrobacter spp.)、硝化球菌属(Nitrococcus spp.)、硝化螺菌属(Nitrospira spp.)和硝化刺菌属(Nitrospina spp.)中的亚硝酸盐还原酶可以将亚硝酸盐还原为一氧化氮。一氧化氮的氧化可以在硝化杆菌属(Nitrobacter spp.)中观察到,但是这种反应是生物反应还是非生物反应还未可知,而且与该反应有关的酶还不清楚。一氧化氮氧化成亚硝酸盐的反应可以由含铜的亚硝酸盐还原酶(由nirk基因编码)催化,众所周知这个反应是双向的。一氧化氮还原为氧化亚氮的反应可以由末端氧化酶类催化,而末端氧化酶类在进化上是与一氧化氮还原酶有关的。
氧化亚氮是一种强效的温室气体,在缺氧条件下可以被还原为氮气,而它在好氧条件下被认为在生物学上性质比较稳定的。有趣的是,从热力学上讲需氧的氧化亚氮被氧化成亚硝酸盐或者硝酸盐反应是可行的(反应25、26),但这种反应需要新的生化途径。
将催化这些未被发现反应的微生物鉴定出来的唯一方法就是在条件可控的实验室内培养它们。很显然,对这些氮转化微生物的生理生化条件的研究在未来几年的研究领域里依然是重点研究对象。
综述总结
想要确定出影响氮循环网络的因素,需要对微生物的生理机能、生态学功能以及它们的进化有更深一步的了解。而现在也越来越清楚的意识到,氮转化网络需要各种各样的微生物群共同作用,单靠一种微生物完成完整的反硝化作用只是个例,并不是常规,大部分微生物还是只能完成氮转化过程中的一步或几步。但是通过近几十年的研究,我们唯一得出的结论是,微生物并没有清晰的界限的,它们会为了生存而做出任何必要的长期斗争。
点评
本文总结了对目前氮循环网络的理解,包括新鉴定的微生物群、新的氮转化过程,以及潜在的氮转化生化途径。描述了它们对环境的影响和工业应用价值,为微生物研究方向的学者提供了宝贵的参考意见!
本文由宋君编译,江舜尧和宋君编辑。
猜你喜欢
- 10000+:肠道细菌 人体上的生命 宝宝与猫狗 梅毒狂想曲 提DNA发Nature 实验分析谁对结果影响大 Cell微生物专刊
- 系列教程:微生物组入门 Biostar 微生物组 宏基因组
- 专业技能:生信宝典 学术图表 高分文章 不可或缺的人
- 一文读懂:宏基因组 寄生虫益处 进化树
- 必备技能:提问 搜索 Endnote
- 文献阅读 热心肠 SemanticScholar Geenmedical
- 扩增子分析:图表解读 分析流程 统计绘图
- 16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
- 在线工具:16S预测培养基 生信绘图
- 科研经验:云笔记 云协作 公众号
- 编程模板 Shell R Perl
- 生物科普 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外1600+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍末解决群内讨论,问题不私聊,帮助同行。
![]()
学习扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
![]()
点击阅读原文,跳转最新文章目录阅读
https://mp.weixin.qq.com/s/5jQspEvH5_4Xmart22gjMA