全靠赌?药企天广实既无商业化产品,也无规模化收入或盈利预期
图片来源:摄图网
记者 | 赵阳戈
北京天广实生物技术股份有限公司(下称天广实)带着自己丰富的产品管线叩响了科创板的大门,9月28日科创板官网披露了天广实的相关材料。
不过需要指出的是,天广实虽有丰富的储备,但即便是最为成熟的产品MIL60也尚未实现商业化,甚至其商业化权益还转让给了其他公司,何时能有规模化的收入和盈利,天广实方面并不能有所保证。也因此,该公司采用了第五套上市标准,希冀冲出一条活路来。
冲着第五套标准而来
天广实成立于2003年2月27日,是一家具备抗体药物研发和产业化能力的创新型生物制药公司,拥有高效的抗体糖基化改造和双特异性抗体等药物研发技术平台的同时,也已形成涵盖从抗体药物筛选、优化、临床研究到产业化的完整研发体系。该公司多年来开发了十余个旨在满足国内患者重大需求的抗体产品,临床适应症涵盖肺癌、淋巴瘤、白血病、狼疮性肾炎、高脂血症、胃癌和传染性疾病等多个治疗领域。
天广实2017年至2020年一季度的营业收入分别为4942.31万元、1164.17万元、8.82万元和0元;归属于母公司所有者净利润分别为-2074.28万元、-26462.99万元、-12331.54万元、-4483.05万元。
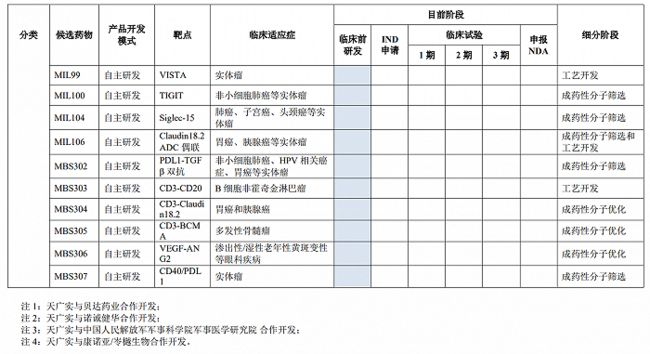
目前该公司拥有7个核心产品(涵盖9项临床研究)且已进入临床阶段或申请IND:其中1项已提交NDA申请并获得受理,1项研究处于临床2期,其余7项研究处于临床1期或IND阶段,此外,尚有十余个品种处于临床前研发阶段。
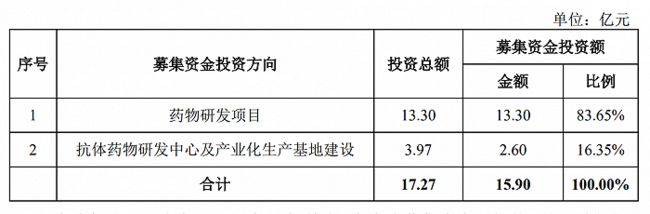
另外,天广实正在建设2条1000L的不锈钢生物反应器及其配套的纯化生产和制剂生产线,年产能为35万支制剂,预计于2021年上半年投入使用;计划建设3条2000L的一次性反应器及其配套的纯化生产线,年产能为500kg抗体。
说起来,天广实在亮相之前曾多次转让和增资,最近一次发生在2019年年末2020年年初,由华泰君实、华泰天实、安泰天实将持股转让出去,另由天广实向多方增资扩股,算起来转让的价格为47.62元/股,增资价格为每股58.03元。目下天广实的总股本为6810.2334万股,算起来估值逼近40亿元。
从上述种种条件来看,显然天广实是冲着第五套上市标准而来。据《上海证券交易所科创板股票发行上市审核规则》第二十二条第二款第(五)项规定的上市标准:预计市值不低于人民币40亿元,主要业务或产品需经国家有关部门批准,市场空间大,目前已取得阶段性成果。医药行业企业需至少有一项核心产品获准开展临床2期试验,其他符合科创板定位的企业需具备明显的技术优势并满足相应条件。
来源:说明书
值得一提的是,天广实的保荐人、主承销商中金公司的全资子公司中金资本运营有限公司持有中金启德1.227%的合伙份额并作为中金启德的普通合伙人、执行事务合伙人,中金启德持有公司4.7124%的股份;联席主承销商中信证券通过其全资子公司中信投资间接持有公司1.3205%的股份,通过其全资子公司金石投资有限公司设立的证券公司直投基金金石翊康间接持有公司1.3205%的股份。
产品均未商业化
那么天广实的产品如何呢?
来源:说明书
来源:说明书
从产品管线来看,天广实的储备蛮丰富。MIL60(重组抗人血管内皮生长因子人源化单克隆抗体注射液)为公司自主研发的贝伐珠单抗的生物类似药,适应症为晚期或复发性非鳞状细胞非小细胞肺癌。天广实自主完成了临床前及临床1期研究,之后与贝达药业合作展开临床3期试验,目前该产品已申报NDA并获得受理。
MIL62(重组人源化单克隆抗体MIL62注射液)为天广实自主研发的一种创新型的II型抗CD20重组人源化单克隆抗体。MIL62是基于天广实自主创新的糖基化改造抗体技术平台研发的产品,获得中国专利授权以及国家重大新药创制专项支持。该产品已开展的临床试验包括:联合来那度胺治疗复发/难治性滤泡性淋巴瘤和边缘区淋巴瘤,目前处于临床2期;联合BTK抑制剂治疗复发/难治CD20+B细胞淋巴瘤(与诺诚健华联合开发),目前处于临床1期;联合标准治疗方案治疗狼疮性肾炎,目前IND已获得受理。
MIL86(重组全人源单克隆抗体MIL86注射液)为天广实自主研发的一种创新型的抗PCSK9重组全人源单克隆抗体,获得中国专利授权。该产品已开展的适应症为高胆固醇血症,目前处于临床1期。
MBS301(注射用重组人源化双功能单克隆抗体MBS301)为自主研发的一种创新型的HER2双特异性抗体。该产品已开展的临床适应症为HER2阳性转移性乳腺癌、胃癌、胰腺癌等实体瘤,目前处于临床1期。
MIL77(重组抗埃博拉病毒单克隆抗体联合注射液)为中国人民解放军军事科学院军事医学研究院牵头,基于天广实自主创新的糖基化改造抗体技术平台研发的抗埃博拉三联抗体,获得国家重大新药创制专项支持。该产品适应症为埃博拉出血热,目前处于临床1期,未来计划申请进入国家战略储备,预计不会成为未来业绩主要来源。
MIL95(重组人源化单克隆抗体MIL95注射液)为天广实与康诺亚/岺樾生物合作研发的一种创新型的CD47单克隆抗体。该产品适应症为淋巴瘤及晚期恶性实体瘤,目前处于临床1期。
MIL93(重组人源化单克隆抗体MIL93注射液)为天广实自主研发的一种创新型的Claudin18.2单克隆抗体。该产品拟开展适应症为Claudin18.2阳性胃癌/胃食管结合部癌和胰腺癌,目前IND已获得受理。
不过需要指出的是,上述产品中,最成熟的MIL60却竞品较多,截至2020年8月底,中国已经有14家药企开展贝伐珠单抗生物类似药临床试验,全部处于临床3期或申请上市阶段。MIL62呢,尽管在临床1期试验中表现出良好的安全性和有效性,但早期临床研究结果未必能完全预示注册临床试验的结果。因此,MIL62的研究开发及商业化也存在不确定性。
也因此,天广实直白自己“无法确保在研产品能够取得药物上市批准,即使公司在研药物未来获准上市并取得市场认可,公司在研产品的商业化前景依然存在不确定性,商业化可能存在时间及效果不达预期的情形”,如此天广实也在“未来一定期间无法盈利或无法进行利润分配”。
研发最快产品商业化权益已转让
如上所述,MIL60目前已申报NDA并获得受理,为天广实研发进度最快的产品,不过这即将商业化的产品,其商业化权益却被天广实转让了出去,转让的对象为上市公司贝达药业(300558.SZ)。
据悉,天广实首先自主完成了MIL60临床前及临床1期研究,之后于2017年3月1日天广实与贝达药业(300558.SZ)签订合作协议,该协议主要约定:(1)天广实将在协议生效日之前拥有的产品权益和产品技术永久性地独家许可给贝达药业,用于后者在区域内对相关领域的产品开拓。贝达拥有对该等产品技术再许可的权利;(2)贝达药业应承担产品临床三期试验及产品注册、商业化、生产及销售的相关费用。天广实应承担产品临床三期试验之前的研究、开发费用;(3)贝达药业分4期向天广实支付里程碑费用合计5000万元;(4)产品上市后,贝达药业每年将向天广实支付提成费(净销售额1×8%),提成年限暂定为10年,自产品首次上市销售当年年末起算(含当年)。届满之日,双方将重新商定提成费比例,总提成年限不超过15年,10年后提成比例在现有基础上依据当年市场情况相应降低。
由此看来,天广实这是打着“翘脚掌柜”的算盘,但为何要采取合作呢?天广实表示,MIL60的开发是利用天广实的技术和贝达药业的产业化能力、临床开发经验、销售渠道及市场准入能力共同合作开发,有助于该产品获得生产批件后迅速落地,实现商业化。那最终效果如何,还有待考证。
未经授权 禁止转载