前言
2020年5月22号,Signal Transduction and Targeted Therapy杂志(IF:13.493)在线发表了题目为:Hypoxia-induced GBE1 expression promotes tumor progression through metabolic reprogramming in lung adenocarcinoma 的研究论文,证明了GBE1是HIF1α信号转导的重要转录靶点,通过NF-κB信号通路调节FBP1启动子区域的甲基化,从而促进肿瘤的进展。
郑州大学第一附属医院的李砺锋博士、杨黎副教授和范智蕊老师为共同一作,张毅教授和赵杰教授为共同通讯作者,文中MethylRAD技术由欧易生物提供。
研究背景
缺氧是肿瘤患者预后不良的指标,缺氧诱导代谢从氧化磷酸化到糖酵解的转化,增加糖原合成,这种代谢重编程有利于肿瘤生长。之前研究发现,糖原分支酶(GBE1)在低氧诱导因子-1(HIF1)信号通路的下游,GBE1可能通过缺氧诱导HIF1的稳定表达,从而促进细胞内糖原的积累,但是GBE1在肿瘤生物学和临床肿瘤学中的重要性及其调控机制尚不清楚。
研究内容
本研究旨在探讨GBE1在体内和体外缺氧条件下,通过调节代谢信号对肿瘤进展的影响。作者通过分析癌症基因组图谱(TCGA)数据集发现GBE1和HIF1α基因表达呈现正相关,并通过免疫荧光qPCR、Western blot等方法确定肿瘤组织及低氧状态下的A549细胞中GBE1表达会发生明显上调。Chip实验表明GBE1是HIF1α的直接靶基因。
然后从体外和体内两方面分析GBE1对肿瘤进程的影响,发现GBE1是肿瘤进展的关键决定因素,通过检测GBE1基因敲降A549细胞(shGBE1细胞)中各项生化指标发现GBE1诱导LUAD细胞代谢重编程,进而通过RNA测序(RNA-seq)和代谢组GC/LC-MS分析发现糖异生途径的果糖-1,6-二磷酸酶(FBP1)是代谢中的关键靶基因,FBP1能够阻止LUAD肿瘤进展。
通过MethylRAD、BSP和MSP等实验检测了FBP1启动子的甲基化水平,分析了甲基化与FBP1及GBE1表达的关系,从而确定GBE1通过NF-κB信号增强HIF1α表达水平进而介导FBP1启动子区高甲基化抑制FBP1表达,最后作者提出靶向HIF1α/GBE1/NF-κB/FBP1信号可能是治疗LUAD的一种潜在策略。
研究结果
1、缺氧可提高LUAD细胞中GBE1的表达水平和糖原生成
作者利用TCGA数据集分析发现LUAD中GBE1的表达模式与HIF1α的表达高度正相关并通过免疫荧光实验进行证实。Western blot和qPCR分析发现GBE1和HIF1α在肿瘤组织中的表达明显高于正常组织(图1e,f)。此外,Western blot和免疫荧光实验证实缺氧后的A549细胞中HIF1α和GBE1表达水平显著升高。PAS染色和透射电镜显示缺氧介导的GBE1表达诱导LUAD细胞的糖原积累(图1j)。作者还构建了HIF1α和GBE1基因敲降的A549细胞(siHIF1α和siGBE1),siHIF1α和siGBE1出现了明显的糖原的积累。这些结果表明缺氧可提高GBE1的表达水平,进一步诱导LUAD中糖原的积累。TCGA数据集评估GBE1表达与临床病理参数之间的关系发现GBE1是LUAD患者潜在的预后生物标志物。
图1:缺氧可提高LUAD细胞的GBE1表达水平和糖原生成。a)基于TCGA数据集的HIF1α和GBE1表达相关性散点图;b)基因富集分析;c)原代LUAD的免疫组化(IHC)和糖原PAS染色;d)LUAD组织的免疫荧光实验DNA(DAPI)、HIF1α(绿色)和GBE1(红色);e)western blotting分析GBE1和HIF1α在LUAD及邻近组织中的表达;f)qPCR法检测正常肺(16HBE)和癌细胞(H460和A549)中GBE1和HIF1α的mRNA表达;g)qPCR检测缺氧和常氧状态下A549细胞GBE1和HIF1α的mRNA表达;h)western blotting法分析缺氧和常氧条件下A549细胞中GBE1和HIF1α的表达;i)缺氧和常氧条件下A549细胞的免疫荧光图像DNA(DAPI)、HIF1α(绿色)和GBE1(红色);j)缺氧和常氧条件下糖原的透射电镜和PAS染色图。
2、GBE1是HIF1α的直接靶基因
Chip实验表明,GBE1启动子区从-1620 bp到-1639 bp之间的序列是HIF1α结合的关键位点。而且缺氧条件下A549细胞中GBE1启动子区有明显的HIF1α的富集,实验最终表明缺氧条件下HIF1α确实作用于A549细胞GBE1的启动子区(图2e),GBE1是HIF1α的转录靶点。
图2:GBE1是HIF1α的直接靶基因验证。a)PROMO和JASPAR网站预测HIF1α与GBE1启动子区可能的结合序列;b)缺氧和常氧条件下A549细胞的Chip检测结果;c)采用HIF1α引物,qPCR检测GBE1的相对表达水平;d)GBE1启动子区示意图e)低氧和常氧条件下A549细胞与pSV-Renilla和荧光素酶报告基因pGL2-HRE1(含有一个包含HIF结合位点的寡核苷酸)共转染。
3、GBE1是肿瘤进展的关键决定因素
为了分析GBE1对肿瘤进程的影响,作者从体外和体内两方面进行验证。作者首先在人肺腺癌细胞系A549中敲降GBE1,各项生化指标检测发现, GBE1敲降后,细胞活力明显降低、细胞凋亡明显增强、细胞迁移和侵袭能力降低、血管生成受损、细胞增殖和集落形成能力明显下降、成球能力显著降低等。
接下来作者将敲降GBE1的 A549细胞皮下注射到裸鼠体内,发现肿瘤生长明显减少,如肿瘤体积和重量明显减少。总之,GBE1是肿瘤进展的关键决定因素,是肿瘤治疗的潜在治疗靶点。
4、GBE1诱导LUAD细胞代谢重编程
通过检测GBE1基因敲降的A549细胞(shGBE1细胞)中各项生化指标,如:细胞外酸化率(ECAR)、耗氧量(OCR)、葡糖糖摄取量、乳酸和ATP生产量、细胞内活性氧(ROS)、NADP+/NADPH比值等,结果发现细胞糖酵解功能降低,戊糖磷酸途径(PPP)可能受到糖原代谢缺乏的影响。
通过RNA测序(RNA-seq)和代谢组GC/LC-MS分析发现shGBE1细胞中代谢途径相关基因,特别是糖异生途径的果糖-1,6-二磷酸酶(FBP1)的表达明显高于对照细胞(图3h,i)。采用葡萄糖代谢PCR阵列检测shGBE1细胞的代谢基因的变化,发现FBP1上调倍数最高,综上表明高表达的GBE1影响LUAD中糖原代谢,而抑制GBE1表达会诱导FBP1高表达,这对糖酵解和PPP途径是至关重要的。
图3:GBE1诱导LUAD细胞代谢重编程。a)shGBE1和shNCA549细胞ECAR和OCR的海马代谢分析;b)shGBE1和shNC A549细胞中胞内2-NBDG的积累; c,d)shGBE1中GBE1基因敲降对乳酸(c)和ATP分泌(d)的影响; e)TCGA数据集中LUAD组织中GBE1表达水平与Glut1和LDHA表达水平之间的相关性; f)荧光成像和流式细胞术分析shGBE1和shNC A549细胞中ROS的表达; g)shGBE1和shNC A549细胞中NADP/NADPH的比值; shGBE1中的h)RNA-seq和i)代谢组学分析; j)基于葡萄糖代谢PCR阵列的差异表达基因热图; k)GBE1基因敲降引起代谢信号通路改变的示意图。
5、FBP1阻止LUAD肿瘤进展
通过TCGA数据集分析果糖-1,6-二磷酸酶(FBP1)表达水平与患者生存率相关性,以及FBP1在不同时期表达水平。结果表明,FBP1低表达,LUAD患者总生存率低。另外,FBP1表达水平与LUAD组织中FBP1甲基化程度呈负相关,表明FBP1启动子甲基化抑制FBP1的转录。
此外,作者成功构建了稳定过表达FBP1基因的A549细胞,通过一系列生化指标的检测发现FBP1的过表达可减弱肿瘤的进展。
6、GBE1通过NF-κB信号增强HIF1α水平进而介导FBP1启动子区高甲基化抑制FBP1表达
虽然GBE1是HIF1α信号通路的下游关键基因,但是并不清楚GBE1调节LUAD肿瘤的作用机制。先前研究表明NF-κB在肿瘤细胞的FBP1基因下调中可能发挥作用,因此作者推测抑制GBE1基因的表达, FBP1启动子甲基化水平会降低,而FBP1的表达水平会升高,这一点已经通过全基因组甲基化测序MethylRAD、特异位点甲基化检测BSP和MSP得到证实。此外,作者证实了FBP1依赖NF-κB途径进行启动子区域的甲基化进而导致FBP1表达沉默。
最后,基于TCGA数据和免疫组化结果证实了LUAD组织中HIF1α和FBP1表达水平呈负相关(图4j)。结合低氧和常氧状态下A549细胞中FBP1的表达等分析证明,缺氧条件下通过GBE1诱导促进肿瘤进展,GBE1介导的FBP1抑制通过FBP1启动子甲基化增强LUAD组织中的NF-κB信号提高HIF1α水平(图4n)。
图4:GBE1通过NF-κB信号增强HIF1α水平从而介导FBP1启动子甲基化抑制FBP1表达。a)采用qPCR和western blotting检测shGBE1 A549细胞中FBP1的mRNA和蛋白水平;b)MethylRAD分析shGBE1和shNC A549细胞中FBP1甲基化水平;c)MSP分析地西他滨(去甲基化功能)处理前后A549细胞中FBP1启动子甲基化水平;d)qPCR和western blotting检测地西他滨处理前后A549细胞中FBP1的表达;e)western blotting检测shGBE1和shNC A549细胞中p-p65和p65的蛋白水平;f)western blotting法检测经QNZ(NF-κB信号通路抑制剂)处理的A549细胞中p-p65和p65的蛋白水平;g)western blotting法分析经QNZ处理的A549细胞中FBP1的蛋白水平;h)QNZ作用下A549细胞FBP1启动子的MSP分析;i)TCGA数据集中LUAD样本FBP1表达水平与HIF1α表达之间的相关性;j)HIF1α和FBP1高或低表达的LUAD组织的免疫组化;k)western blotting法分析正常氧和缺氧条件下A549细胞中HIF1α的表达;l)用qPCR分析有或无FBP1过表达的A549细胞中GLUT1、HK2、LDHA、PDK1和VEGFA的mRNA水平;m)TCGA数据集中LUAD组织中HIF1α、GBE1和FBP1表达的热图;n)缺氧诱导肿瘤进展的信号通路。
7、黄吡咯烷醇作为潜在的GBE1抑制剂可用于LUAD治疗,GBE1是LUAD患者预后的生物标志物
作者利用小分子化合物库分析确定黄吡咯烷醇是GBE1的抑制剂。经黄吡咯烷醇治疗后,A549细胞中GBE1的表达显著降低,导致细胞内糖原水平降低。黄吡咯烷醇处理24小时会导致细胞凋亡增加,克隆形成、迁移和侵袭能力降低。
为了确定黄吡咯烷醇是否足以抑制体内肿瘤的进展,作者对小鼠模型分别注射黄吡咯烷醇或二甲基亚砜(DMSO),发现实验组小鼠的肿瘤生长受到抑制,肿瘤体积和重量明显降低。通过对异种移植小鼠进行IHC和Western blot进一步检测GBE1的表达及特定黄吡咯烷醇剂量下小鼠器官损害程度表明,黄吡咯烷醇是一种有前途的LUAD治疗药物。
最后,通过对75例LUAD患者的临床数据分析表明GBE1可以作为LUAD的预后生物标志物。
研究结论
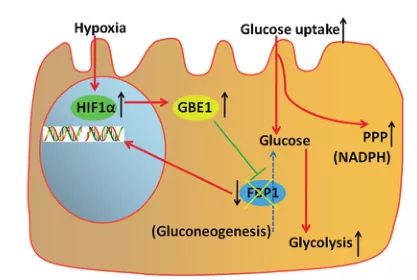
本研究表明缺氧诱导的HIF1α介导GBE1上调,GBE1通过NF-κB介导FBP1启动子的甲基化进而抑制FBP1的表达。FBP1的下调导致HIF1α增强,转化为厌氧糖酵解,并增加了LUAD细胞对葡萄糖摄取(图5)。因此,针对HIF1α/GBE1/NFκB/FBP1的治疗策略可能是LUAD的有效治疗方法。
图5:GBE1在LUAD细胞缺氧代谢途径的图解总结
参考文献
Li L, Yang L, Fan Z, et al. Hypoxia-induced GBE1 expression promotes tumor progression through metabolic reprogramming in lung adenocarcinoma. Signal Transduct Target Ther. 2020;5(1):54. Published 2020 May 22. doi:10.1038/s41392-020-0152-8