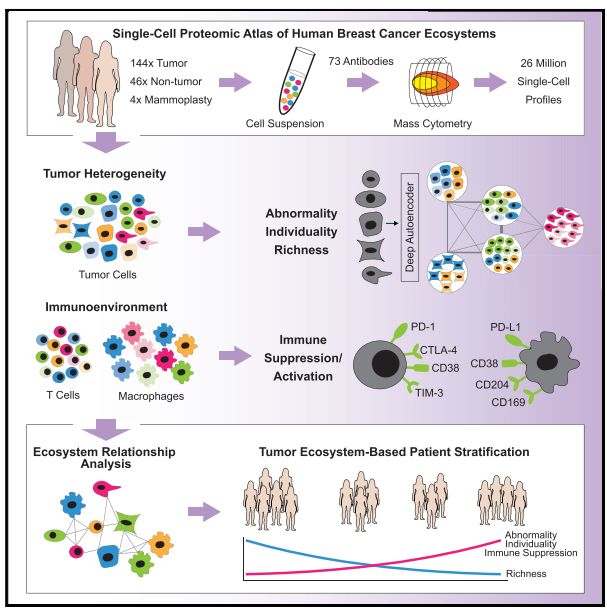
人类乳腺癌肿瘤与免疫生态系统单细胞图谱
A Single-Cell Atlas of the Tumor and Immune Ecosystem of Human Breast Cancer
(Cell, IF=36.216)
背景介绍
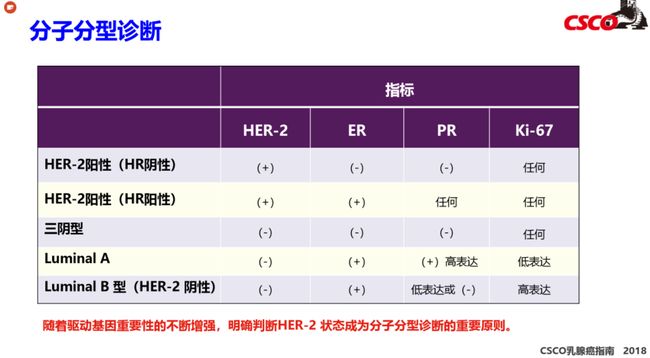
1. 乳腺癌的分子分型
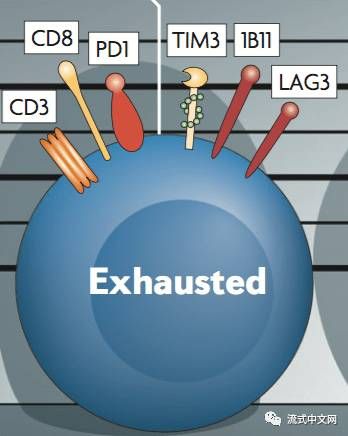
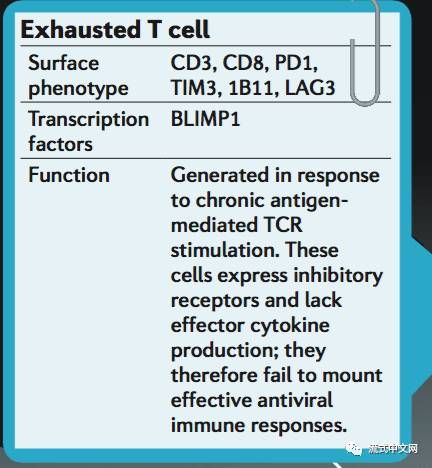
2. 耗竭性T细胞(exhausted T cells):是一群效应功能减弱,持续表达抑制性受体的T细胞,在肿瘤中表现为T细胞功能缺陷状态,主要特征为一系列抑制性受体表达增加及细胞因子分泌减少。耗竭性T细胞主要通过细胞表面的抑制性分子,细胞因子和免疫调节细胞类型改变等参与肿瘤免疫负调控,从而引起肿瘤免疫逃逸。而T细胞耗竭状态并非不可逆转,应用相应单克隆抗体靶向免疫调控点可以有效逆转耗竭性T细胞,恢复机体抗肿瘤免疫反应,提高肿瘤控制率。因此,通过逆转肿瘤患者体内的耗竭性T细胞可能是肿瘤免疫治疗的新途径之一。
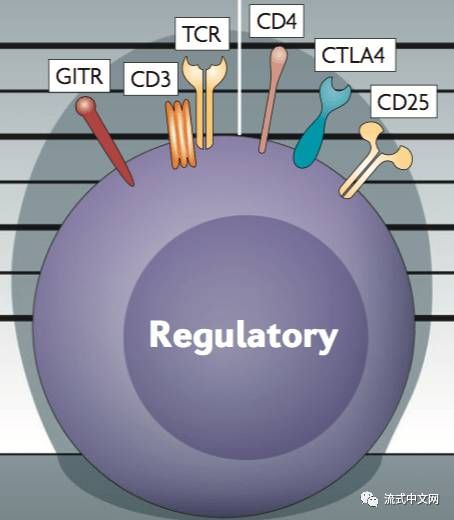
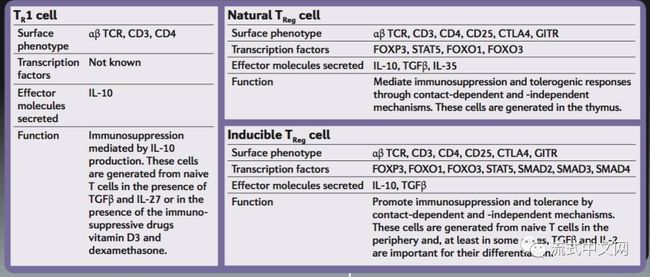
3. 调节T细胞(Regulatory T cells):调节T相对来说,研究还是挺多的,但其实目前很多文献都没有分得很多。正常情况下应该分为三类:TR1(从初始T产生,通过IL-10发挥免疫抑制作用),Natural Treg(胸腺产生,通过接触或非接触机制,介导免疫抑制和耐受性反应),Inducible Treg(从初始T诱导产生,通过接触或非接触机制,介导免疫抑制和耐受性反应)。
4. 在健康的乳腺中,管腔和基底细胞的表型受到严格控制:管腔细胞异质表达ER,PR和细胞角蛋白K7,K8和K18;基底细胞表达K5,K14,K17和平滑肌肌动蛋白(SMA)以实现适当的组织功能。
全文思路
实验结果
Fig1. 乳腺癌生态系统的单细胞蛋白质组图谱;
Fig2. 乳腺癌的免疫景观;
Fig3. 乳腺癌有免疫抑制巨噬细胞表型的富集;
Fig4. 肿瘤上皮细胞异质性和表型异常;
Fig5. 表型异常和肿瘤个体化与预后不良的特征相关;
Fig6. 基于肿瘤生态系统的分类揭示了不同的群体和多个肿瘤单例;
Fig7. 乳腺肿瘤及其免疫环境是相互交织的实体,两者对于肿瘤分型都很重要
Fig1. 乳腺癌生态系统的单细胞蛋白质组图谱
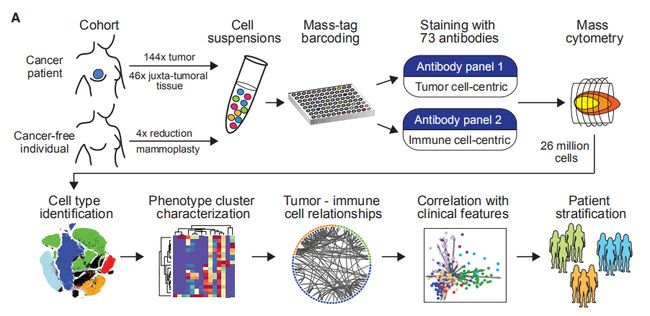
图1A:图文描述:实验研究流程图。结果分析:对144个肿瘤样品其中包括54个管腔A,71个管腔B,6个管腔B-HER2 +,1个HER2 +和6个TN肿瘤。其中以免疫细胞为中心的抗体通道专注于免疫表型,作者此前已研究出肾透明细胞细胞癌免疫细胞图谱(ccRCC)。
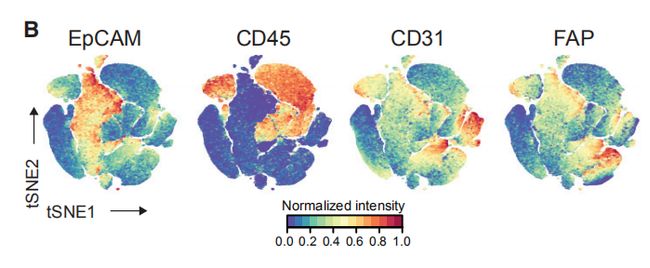
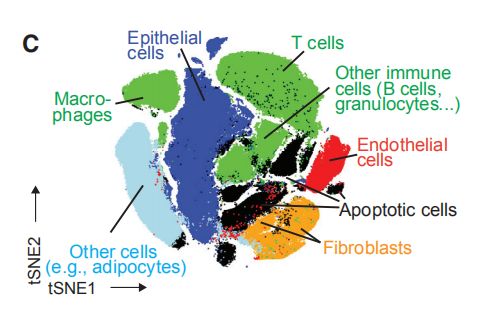
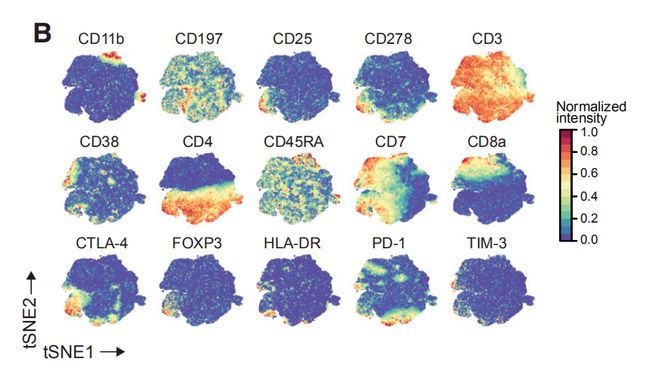
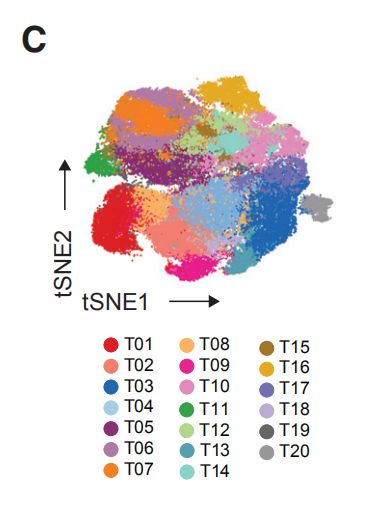
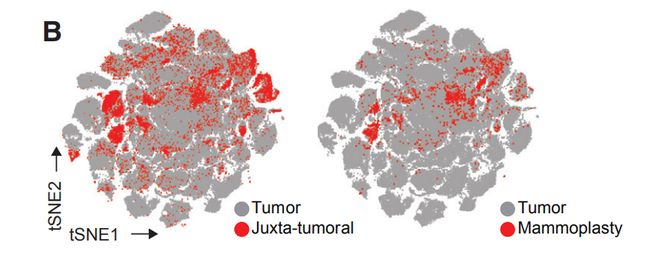
图1B,C,B是使用降维算法0到1归一化处理所有样本的58,000个细胞中EpCAM,CD45,CD31和FAP表达的t-SNE图。图1C是B中的t-SNE,按细胞类型着色。结果分析:其中大部分是上皮细胞(表达EpCAM)和免疫细胞(CD45+),内皮细胞(CD31 +)和成纤维细胞(FAP + )较少。其他成纤维细胞亚群和脂肪细胞被描述为“其他”的细胞中。
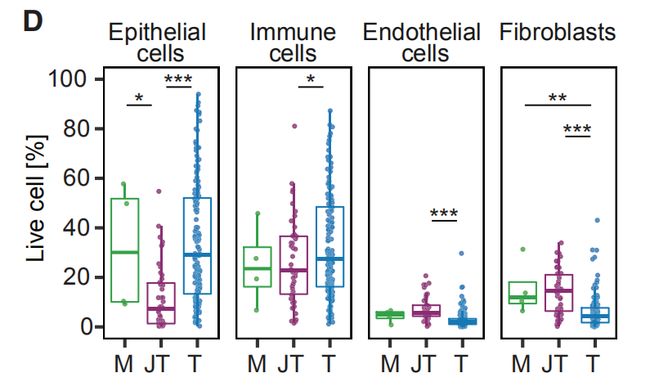
图1D:乳房成形术(M),癌旁组织(JT)和肿瘤(T)样品中的活上皮细胞,免疫细胞,内皮细胞和成纤维细胞的比例。结果分析:乳腺肿瘤中上皮细胞富集,免疫细胞较高,而内皮细胞和成纤维细胞少于非肿瘤组织。
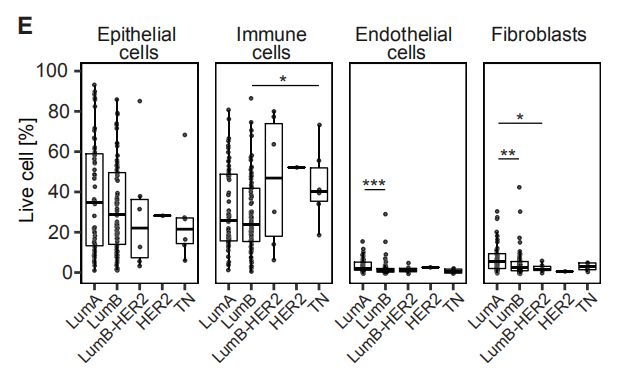
图1E:不同的乳腺肿瘤亚型中的活上皮细胞,免疫细胞,内皮细胞和成纤维细胞的比例。结果分析:与其他乳腺癌类型相比,在TN和HER2 +样品中观察到的免疫细胞比例更高。Fig2. 乳腺癌的免疫景观
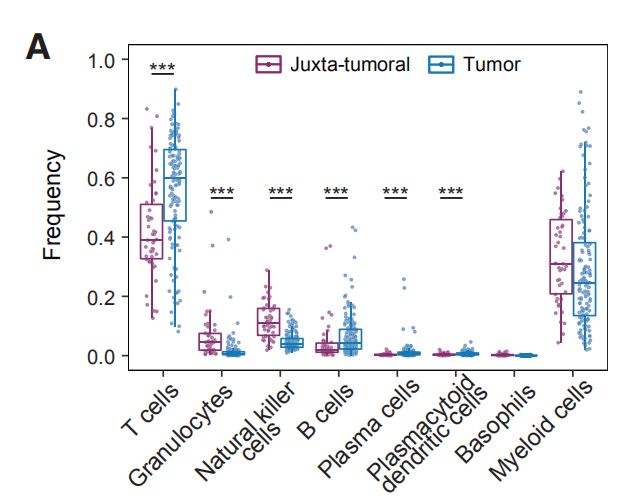
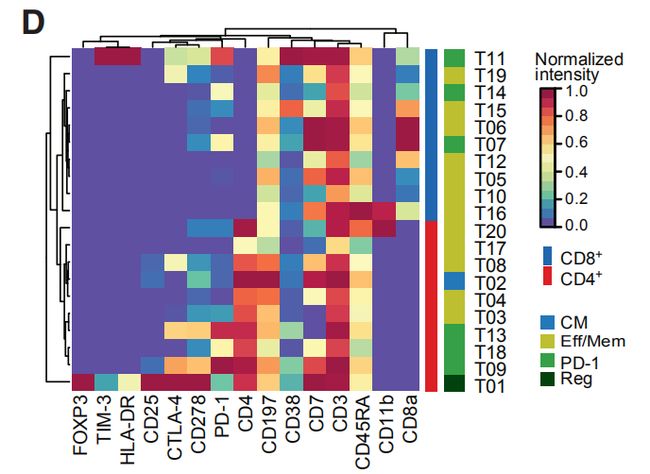
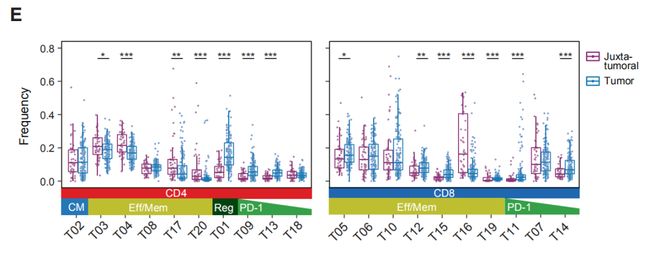
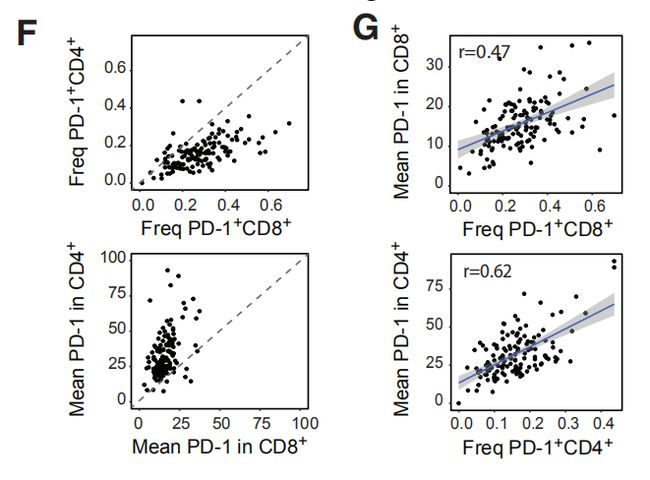
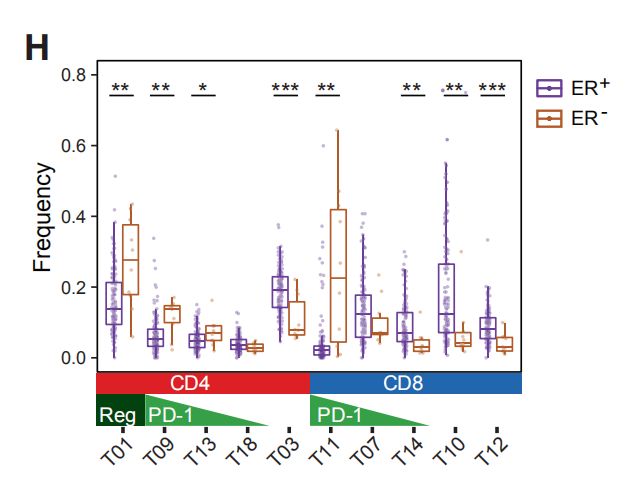
图2A:癌旁组织和肿瘤样本中所选免疫细胞类型的出现频率。结果分析:1. T细胞和髓样细胞是检测到最丰富的免疫细胞类型。检测到的自然杀伤(NK)细胞,B细胞,粒细胞,浆细胞,嗜碱性粒细胞和浆细胞样树突状细胞较少。2. 乳腺肿瘤富含T细胞和B细胞,且NK细胞和粒细胞的出现频率低于癌旁组织。 图2B,C:使用15个抗体来自所有样品的40,000个T细胞的标准化标记物表达的t-SNE图。图C是通过PhenoGraph簇着色的T细胞的t-SNE图。结果分析:通过t-SNE和PhenoGraph对T细胞进行深入分析,鉴定出10个CD4 +和10个CD8 + T细胞簇。 图2D:20个T细胞群归一化T细胞标记物表达的热图。CM, 中心记忆细胞; Eff/Mem, 效应记忆细胞; Reg, 调节性T细胞; PD-1, PD-1+细胞。结果分析:1. T细胞簇中具有效应记忆表型种类最多。2. 在CD8 +(T11,T14和T07)和CD4 + T细胞簇(T09,T13和T18)中检测到了不同水平的PD-1和共抑制受体和激活标记的杂种新共表达。PD-1水平和受体共表达的增加可能表示越来越多的耗竭性T细胞。3. PD-1highCD8 + T细胞(T11)表达共抑制受体TIM-3和CTLA-4以及激活标记HLA-DR和CD38。这种表型与黑色素瘤的T细胞衰竭和抗PD-1治疗反应相关。4. 根据CD4,FOXP3,CD25和CTLA-4的表达鉴定T-reg(T01)。 图2E:箱线图显示癌旁组织和肿瘤样本中CD4 +(左)和CD8 + T细胞簇的出现频率(右)。结果分析:与癌旁组织相比,肿瘤中T-regs(01)和PD-1highCTLA-4 + CD38 + T细胞(T09,T11和T13)比例较高。 图2F,G:F是肿瘤来源的CD4 +和CD8 + T细胞之间的PD-1 + T细胞频率(上图)和平均PD-1表达之间的关系(下图)。G比较CD8 +(顶部)和CD4 + T细胞(底部)的PD-1 + T细胞频率和平均PD-1表达之间的关系。结果分析:1. 大多数PD-1+T细胞是在CD8+T细胞。然而,PD-1在CD4+T细胞中的平均表达水平高于CD8+T细胞。2. 分别在CD4 +和CD8 +T细胞中,PD-1的平均表达水平与PD-1 + T细胞频率呈正相关。 图H:ER +和ER-肿瘤中所选T细胞簇的出现频率。结果分析:据报道,与ER +亚型相比,ER-乳腺癌亚型对免疫检查点抑制剂的反应更好。1. ER-和ER +肿瘤的T细胞分布存在差异,ER-亚型中T-reg(01)的频率更高。2. 分别富集不同的PD-1 +表型:ER-肿瘤中PD-1high CTLA-4 + CD38 + T细胞(T09,T11和T13)更多,而ER +肿瘤中PD-1int CTLA-4- CD38 -T细胞(T14)更常见。3. 但是,有些ER+肿瘤确实显示出与ER-肿瘤相当或更高的PD-1high CTLA-4+ CD38+T细胞(T09,T11和T13)和T-regs频率。因此,作者的数据支持ER-肿瘤患者可以进行免疫治疗,并表明一部分ER +肿瘤患者也应受益。图2I:luminal A 和 luminal B肿瘤中T细胞簇的频率。结果分析:PD-1int CTLA-4-CD38-T细胞(T07)在luminal A亚型中更为常见,而T-regs在 luminal B肿瘤中富集。
Fig3. 乳腺癌有免疫抑制巨噬细胞表型的富集
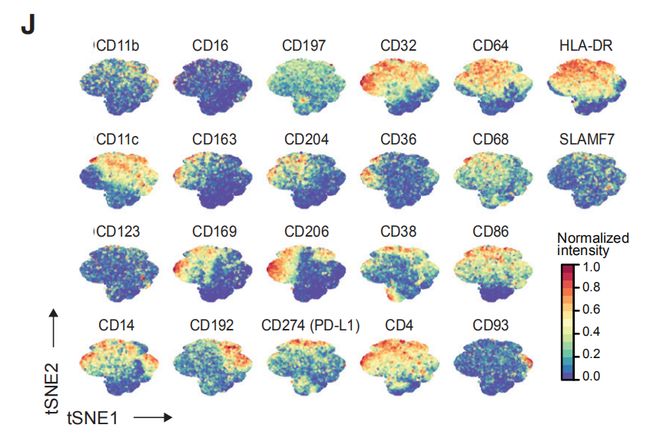
图2J,K:使用22个抗体对所有样本中40,000个髓系细胞归一化标记表达的t-SNE图。由PhenoGraph簇着色的髓系细胞的t-SNE。
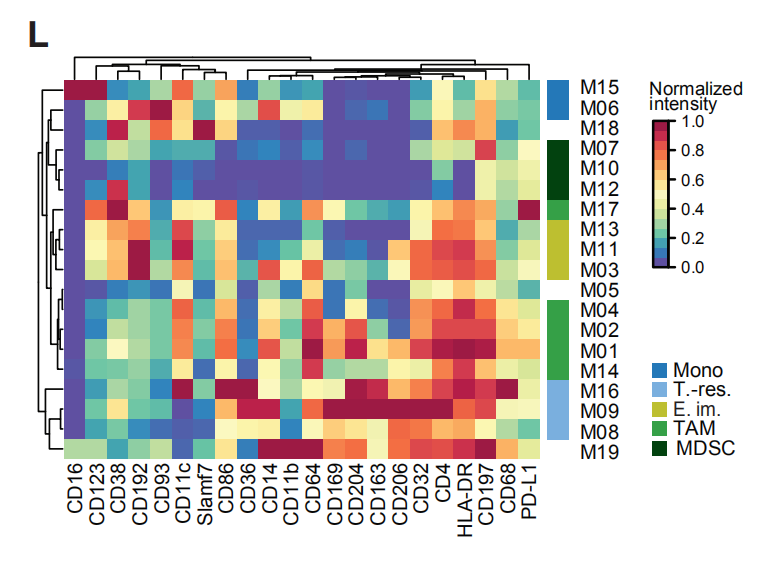
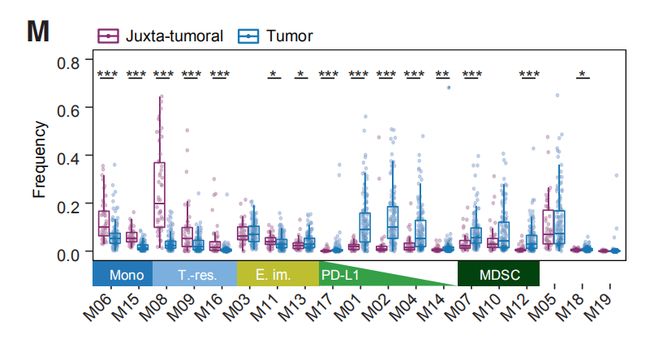
图2L结果分析:19个髓样簇的归一化髓样标志物表达的热图。19个髓系团簇(M01-M19)分为五类:(1)表达CD14的经典细胞(M06,CD14 + CD16-)和炎性单核细胞(M15,CD14int CD16 +);(2)早期转移巨噬细胞(M03,M11,M13,HLA-DRintCD192 +);(3)组织驻留巨噬细胞(M08,M09,M16,CD206 + HLA-DRint);(4) TAMs (M01, M02, M04, M14, M17, CD64high HLA-DRhigh);(5)髓样抑制细胞(MDSC; M07, M10, M12, HLA-DR-/low)。
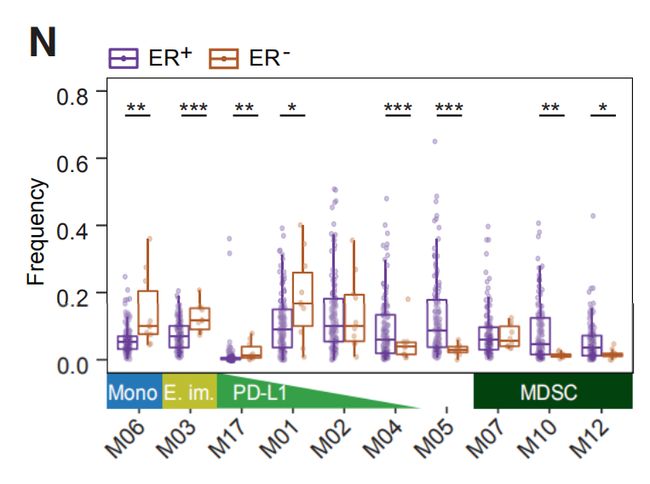
图2M:癌旁组织和肿瘤标本中髓系细胞分组的频率。结果分析:髓样表型空间在肿瘤和癌旁组织之间存在差异。与癌旁组织相比,肿瘤中富含TAM。 图2N:指示髓系簇在ER-和ER+肿瘤中的频率。结果分析:与ER +肿瘤相比,ER-肿瘤包含更高频率的M01和M17( PD-L1 + TAM)。一部分ER +肿瘤的M01和M02 PD-L1 + TAM频率与ER-肿瘤相当或更高。
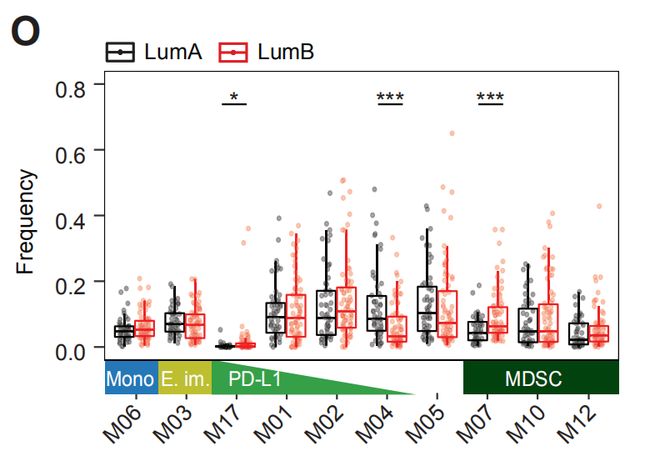
图2O:luminal A 和 luminal B肿瘤中T细胞簇的频率。结果分析:与luminal A 肿瘤相比, luminal B肿瘤包含更多具有M07或M17表型的髓样细胞。
Fig4. 肿瘤上皮细胞异质性和表型异常
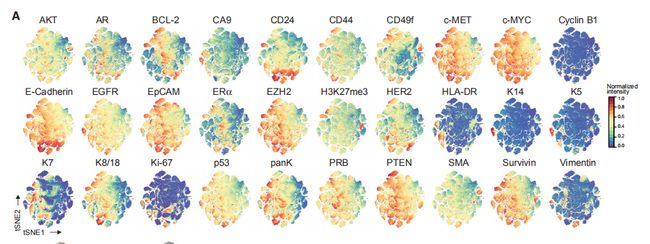
图3A,B:使用了30种抗体。(A)来自所有样品的18万个上皮细胞的标记物表达的t-SNE图。(B)t-SNE突出了来自肿瘤,癌旁组织和正常组织的上皮细胞分布。结果分析:对来自肿瘤和非肿瘤组织的上皮细胞的分析揭示了上皮标记的梯度样表达,表明许多不同的细胞表型。
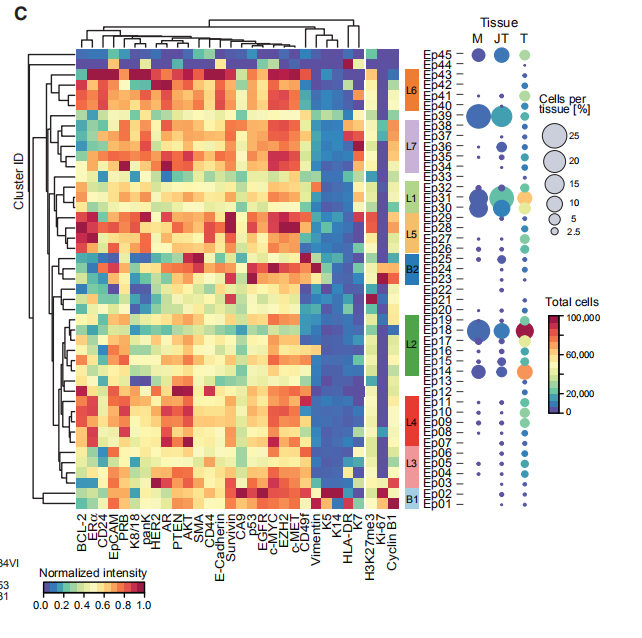
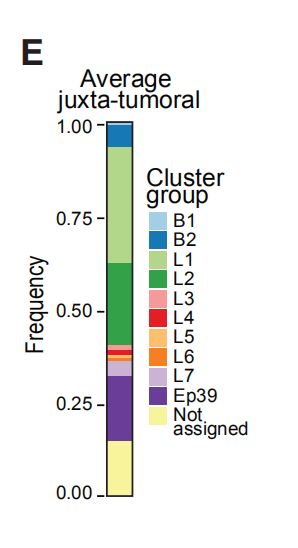
图3C:45个上皮簇的标准化上皮细胞标志物表达的热图(左),以及每个簇的正常组织(M),癌旁组织(JT)和肿瘤(T)组织的细胞百分比和总数。结果分析:显示了45个上皮簇(Ep01–Ep45)。基于标记表达的分层聚类将它们分为七个腔群,L1-L7,和两个基群,B1和B2。L1组和L2组以正常上皮细胞为主,L3-L7组以肿瘤细胞为主。L3组表型表现为高水平的EpCAM和CD49f,低水平的ERa表达,腔祖细胞的特征。L4组表型显示出高水平的激素受体ERa,孕激素受体B(PRB)和AR,以及酪氨酸激酶HER2,EGFR和肝细胞生长因子受体(c-MET),与肿瘤细胞的增殖和迁移有关。L5组观察到强的受体酪氨酸激酶表达和高水平的ERα,甲基转移酶EZH2,其靶标H3K27me3以及抗凋亡因子Survivin和BCL-2。L6组表型表达K7,K8,K18,ERα,HER2,低水平的CD49f,高水平的E-钙黏着蛋白和CD24,表明具有ERa和HER2途径活性的腔内细胞成熟。L7组表型为ERa和HER2low,并表达HLA-DR(与肿瘤免疫原性相关的表面受体)
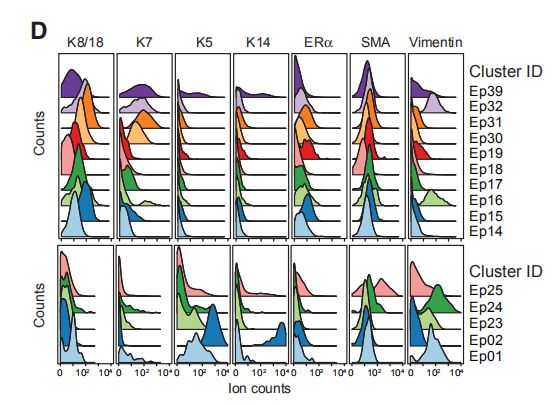
图3D:上皮肿瘤组织细胞中上皮谱系标志物表达的直方图。结果分析:1. 约63%的正常组织上皮细胞和77%的癌旁组织细胞是组成了L1组和L2组,其特征是K7、K8和K18的表达以及低水平或无ERA的表达。2. 上方是L1和L2组的表达,下面是B1和B2组的表达。补充知识点:在健康的乳腺中,管腔和基底细胞的表型受到严格控制:管腔细胞异质表达ER,PR和细胞角蛋白K7,K8和K18;基底细胞表达K5,K14,K17和平滑肌肌动蛋白(SMA)以实现适当的组织功能。
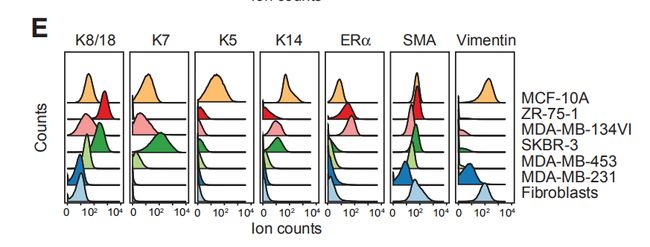
图3E:细胞系衍生的细胞中上皮谱系标志物表达的直方图。结果分析:MCF-10A为正常乳腺上皮,ZR-75-1等为乳腺癌导管上皮细胞。乳腺上皮细胞系证实了这些模式的可靠性。
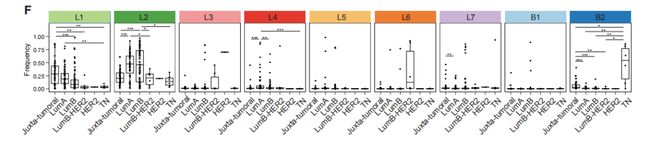
图3F:单个簇群细胞按肿瘤亚型出现的频率。
结果分析:L1-L7组表型在肿瘤亚型中分布不同。L1组和L2组显示成熟腔细胞的表型,L4组显示强表达ERa+的表型,在腔A和B肿瘤中比在HER2和TN肿瘤中更常见。L3和L6组的细胞主要是在Luminal B-HER2+ 和 HER2+肿瘤中较高。
Fig5. 表型异常和肿瘤个体化与预后不良的特征相关
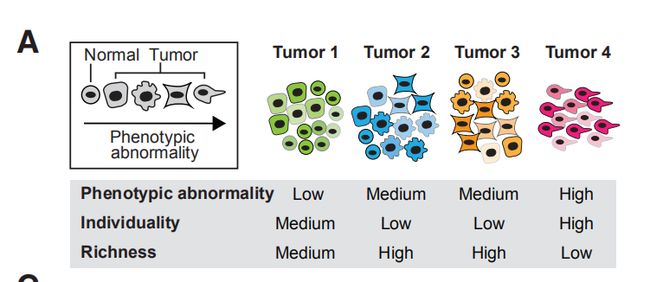
图4A:用假设的表型(形状)和肿瘤(颜色)示意性地显示表型异常、个体化和丰富度结果分析:建立了三个计算评分来量化肿瘤异质性的不同方面。表型异常描述了肿瘤细胞表型偏离非肿瘤上皮细胞的程度。肿瘤个体化量化了基于细胞表型的肿瘤相似性。肿瘤丰富度代表了生态系统中不同的共存肿瘤细胞表型的数量。
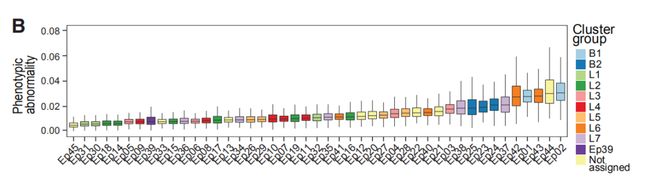
图4B:所有上皮簇的表型异常评分。(为了描述表型异常,作者通过癌旁组织的多维单细胞数据训练了一个人工神经网络(自动编码器)。训练后,自动编码器识别非肿瘤上皮细胞表型,并计算每个肿瘤细胞的均方误差(MSE)。)
结果分析:高MSE值显示异常水平高。上皮簇组L6、L7、B1和B2中肿瘤细胞异常最多。
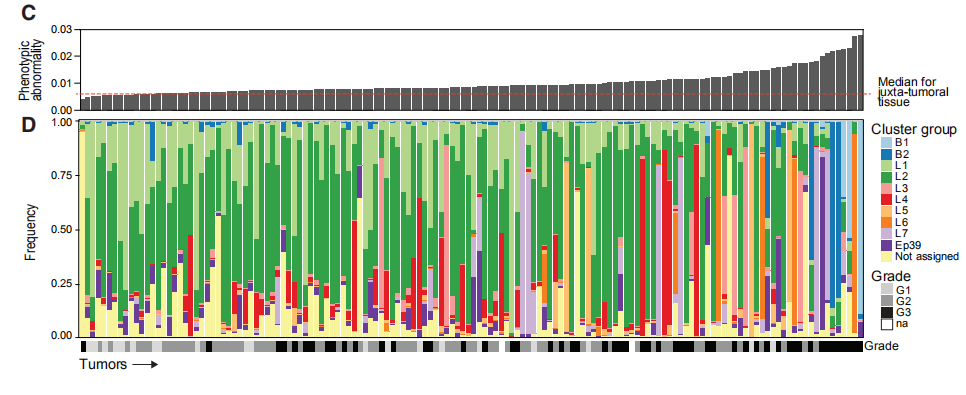
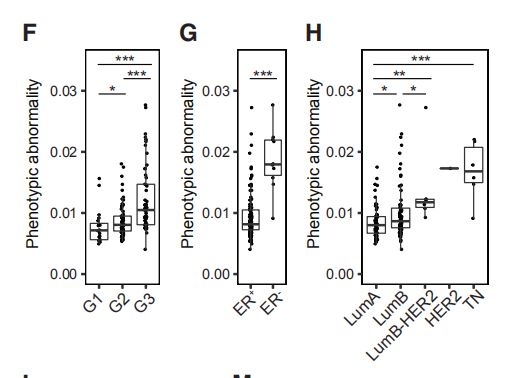
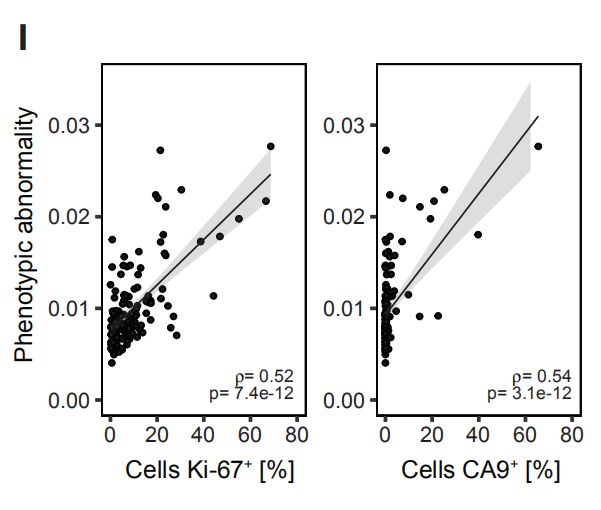
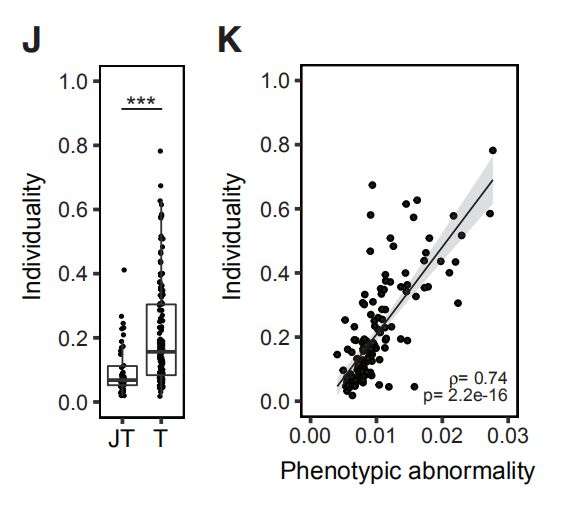
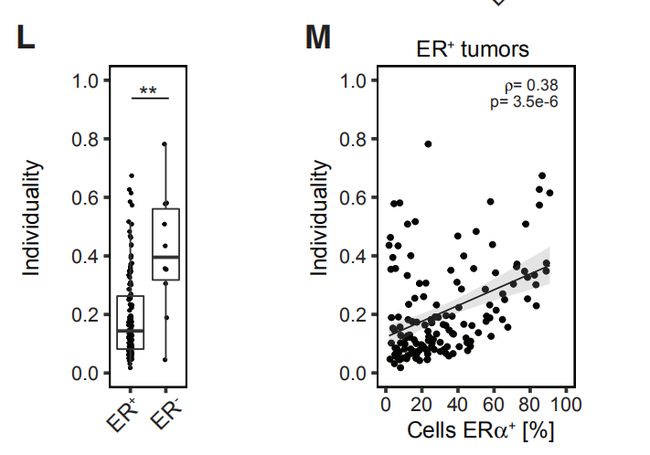
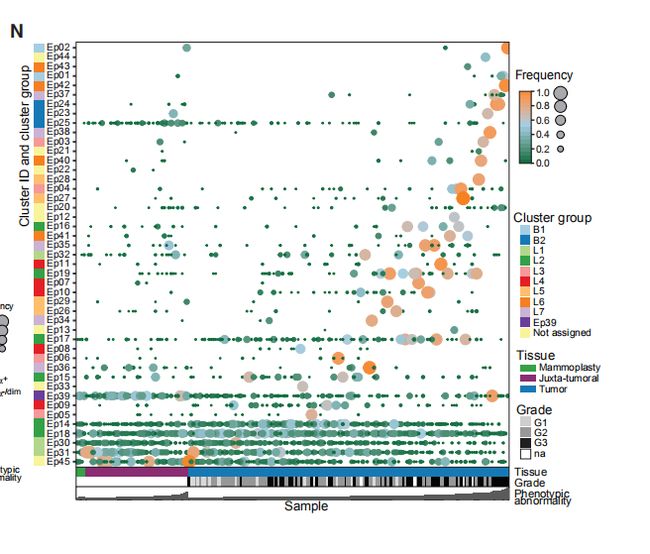
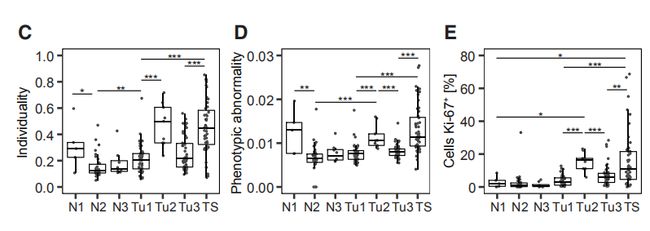
图4C,D,EC是肿瘤表型异常评分和瘤样本中位数评分。D是每个肿瘤上皮簇组细胞组成的频率的堆叠直方图。E是癌旁组织上皮簇细胞组成的平均频率。结果分析:与富含L1和L2组细胞的肿瘤相比,富含L6,L7,B1,B2的肿瘤表型异常程度更高。 图4F,G,H:肿瘤表型异常按病理分级、ER状态和临床亚型评分。结果分析:典型的异常细胞在高级别肿瘤、大多数ER-肿瘤以及预后不良的亚型肿瘤中富集。 图4I:表型异常评分与肿瘤的Ki-67 +和CA9(碳酸酐酶9) +细胞百分比的关系。结果分析:表型异常与缺氧和增殖标志物表达呈正相关。 图4J,K(J)癌旁组织(JT)和肿瘤组织(T)的个体化评分。(K)肿瘤的个体化评分与表型异常评分的关系。结果分析:肿瘤的个体化评分高于癌旁组织,且肿瘤个体化与表型异常有关。 图4L,M(L)ER +和ER-肿瘤的个体化评分。(M)ER +肿瘤的个体化分数与ERa +细胞的百分比的关系。结果分析:ER -肿瘤的个体化评分更高,ER +肿瘤之间的个体差异很大,并且与ERa +细胞的百分比相关。 图4N:所有样本中45个上皮簇的存在和比例的热图。结果分析:为了探索肿瘤富集的概念,作者计算了每个样品中每个上皮细胞簇的频率,并报告了1%以上的簇数。所有肿瘤和非肿瘤样品均包含来自多个簇的细胞。
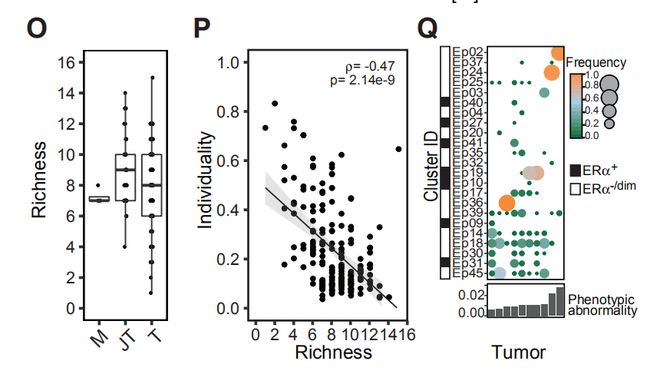
图4O,P,Q值得注意的是,与非肿瘤组织相比,大多数肿瘤并未显示出增加的丰富性,并且肿瘤丰富性与个体化成反相关。Q图对队列中的十种肿瘤进行了分析,这些新肿瘤进行新辅助化疗,但仍未明显消退,治疗后显示出各自的表型组成,表明不同的肿瘤细胞表型在治疗后仍然存在。
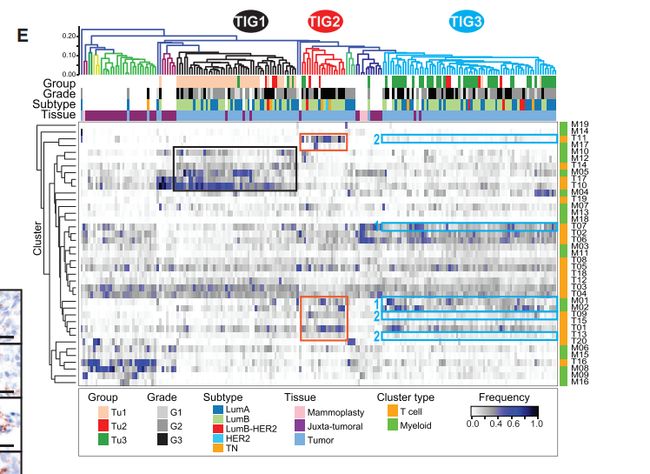
Fig6. 基于肿瘤生态系统的分类揭示了不同的群体和多个肿瘤单例
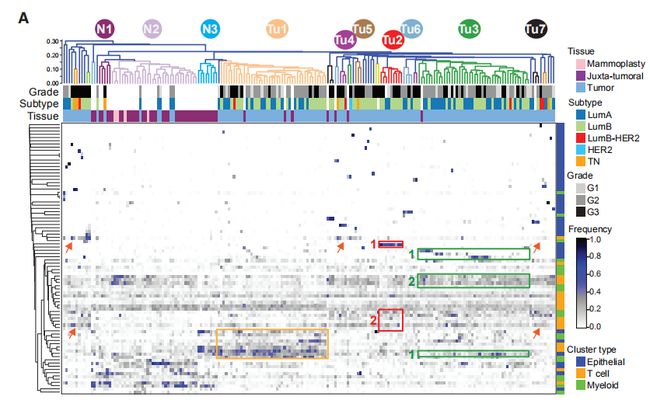
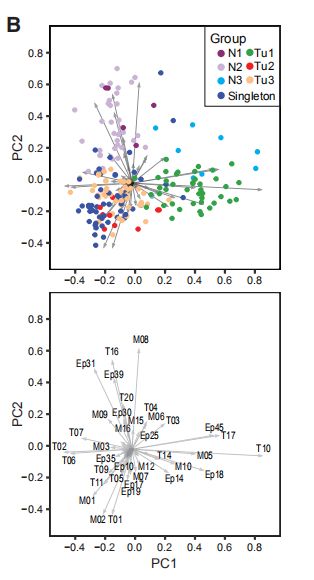
图5A:术后正常组织,癌旁组织和肿瘤组织中上皮,T细胞和髓样PhenoGraph簇的频率热图。图5B:群集频率的最两个主成分(PC)双线图。点代表按组着色的样本,(顶部)。箭头长度和方向指示群集对PC的重要性。
图5A,B结果分析:1. 产生的热图显示三组包含许多肿瘤(Tu1-Tu3),四组包含三个或四个肿瘤(Tu4-Tu7),36个肿瘤单例和三组非肿瘤样品(N1-N3)。2. Tu1组包括42个具有高水平特异性上皮簇(Ep14,Ep18和Ep45),T细胞簇(T10,T14和T17)和巨噬细胞簇(M05,M10和M12)的肿瘤。3. Tu2组的9个肿瘤显示高频率的ERadim细胞(Ep19),T-regs(T01)和PD-L1 + TAM(M01和M02)以及PD-1highCTLA- 4+CD38 + T细胞(T09,T11和T13)。4. Tu3组包括44个具有高水平的ERa +腔表型Ep09和Ep14以及ERa-腔表型Ep17和Ep18的肿瘤。Tu3组肿瘤富含免疫细胞表型T02,T06,T07和M03,这在非肿瘤组织中也很常见。5. 与非肿瘤组织相似,在N2组中发现的五个肿瘤主要包含L1和L2组上皮表型,循环T细胞(T16)和组织驻留巨噬细胞(M08)。
图5C,D,E,F,G:(C)个体化、(D)表型异常评分、(E)Ki-67 +细胞、(F)PD-L1 +巨噬细胞和(GPD-1 + T细胞的箱线图 。结果分析:Tu2组肿瘤比Tu1和Tu3组肿瘤具有更高的个体化和表型异常评分,更多的增殖细胞,PD-L1 + 髓样细胞和PD 1+ T细胞。
Fig7. 乳腺肿瘤及其免疫环境是相互交织的实体,两者对于肿瘤分型都很重要
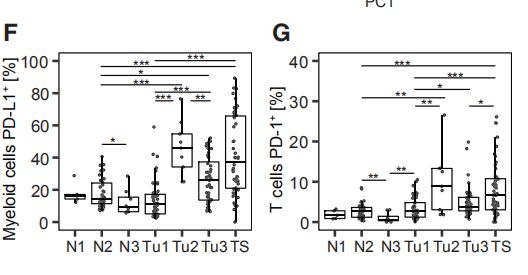
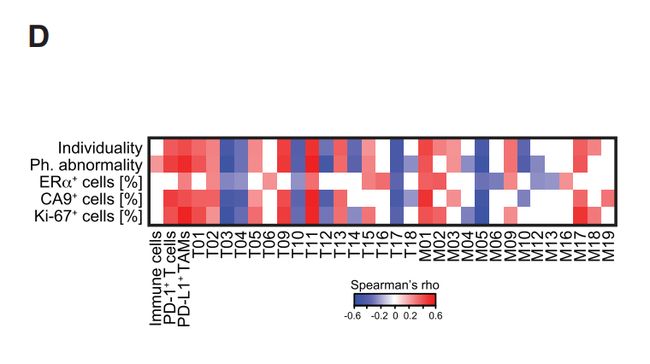
图6D:免疫抑制模式与肿瘤表型异常和个体化评分,缺氧和增殖相关。还观察到免疫抑制性TAM与ERa +细胞的丰度之间的相关性。
图6E在先前的单例肿瘤中,6%放入TIG1中,32%放入TIG2中,50%放入TIG3中。TIG1中的肿瘤富含簇M05,M10,M12,T10,T14和T17(图6E,黑色矩形)TIG3肿瘤显示高频率的PD-L1 + TAM(M01和M02)和PD-1intCTLA-4 -CD38 T细胞-(T07)(图6E,蓝色矩形1),但低水平的PD-1highCTLA-4 + CD38 +耗尽 T细胞(T09,T11和T13)(图6E,蓝色矩形2)。相反,TIG2中的肿瘤表现出高频率的T-reg(T01),PD L1 + TAM和PD-1highCTLA-4 + CD38 +耗尽的T细胞(图6E,红色矩形)。
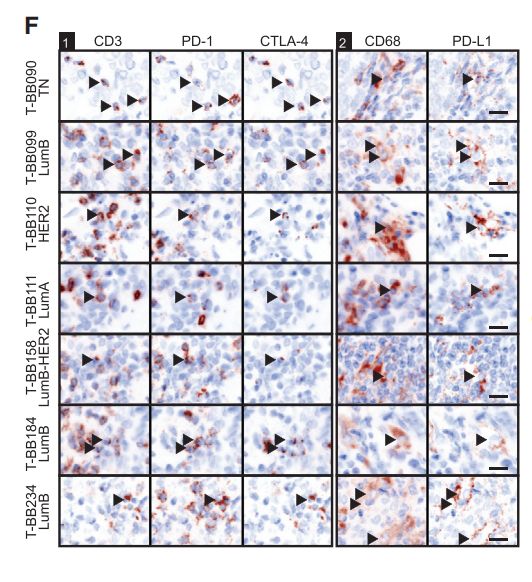
图6F:TIG2分组了包括ER +和ER肿瘤在内的不同亚型的肿瘤,这引发了一个问题,即TIG2中丰富的免疫细胞是否位于肿瘤生态系统。通过免疫组化评估了TIG2肿瘤组织切片中PD-L1 + TAMs和PD-1 +和PD1 + CTLA-4 + T细胞的空间分布,并在ER +和ER-的肿瘤基质和肿瘤上皮细胞中发现了这些标记。
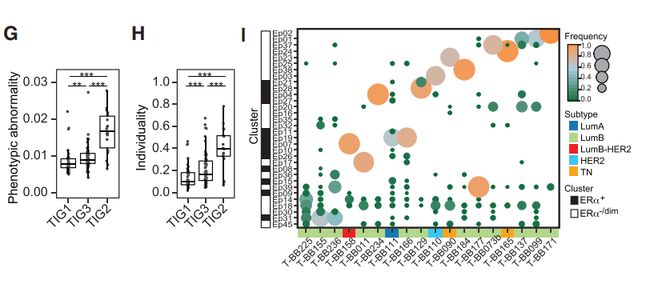
图6G、H、I1. TIG2肿瘤具有比TIG1和TIG3肿瘤更高的表型异常评分,表明肿瘤与非肿瘤组织的表型偏离与肿瘤免疫状况的改变有关。2. TIG2肿瘤也比TIG1和TIG3肿瘤具有更高的个体化评分,并且揭示出独特的肿瘤细胞表型组成。3. 所有TIG2肿瘤都含有ERa+细胞,占肿瘤细胞总数的15%-98%,TIG2肿瘤中,各种肿瘤亚型都有。
优缺点
优点:
1、采用了大量的单细胞测序技术,技术先进;2、全文逻辑清晰,思维全面,先后对比了肿瘤和癌旁组织、正常组织;ER+肿瘤和ER-肿瘤;乳腺癌亚型之间的对比;3、本文研究角度有新意,从宏观上分析肿瘤细胞和免疫以及治疗的关系,而不是去研究基因突变等等。此研究对乳腺癌的分子分型的治疗具有重要的指导意义。
缺点:1、单细胞测序的结果重复性不好。2、本文对乳腺癌的分子分型没有做出一个明确的具体的指导意见。
疑难问题
Q1:图2F那边说,大多数患者PD-1 + T细胞,占肿瘤相关T细胞总数的26.6%,而癌旁组织很少⻅。CD8 + 的区域内能够发 现大多数 PD-1 + T细胞,而PD-1 在CD4 + T细胞中的平均表达水平却高于CD8 + T细胞。并且CD4 + T细胞频率与PD-1 的平均水平具有相关性。这些证据能够支持这些细胞是由T 细胞扩增的。这边为什么就能得出这个结论呢?
A1:这个问题其实也困扰了我,图2F和图2G共同得出了这个结论。后来我仔细看了一下,其实本文和这个结论关系不大,和两篇发表在cell上的引用文献关系比较大,尤其是第二篇。本文的结果是想说明大多数PD-1+T细胞是在CD8+中表达较高。然而,PD-1在CD4+T细胞中的平均表达水平高于CD8+T细胞的平均水平。分别在CD4 +和CD8 +T细胞中,PD-1的平均表达水平与PD-1 + T细胞频率呈正相关。第二篇引用文献主要是说功能失调的T细胞是肿瘤内增殖的主要免疫细胞,先前定义为耗竭的CD8 +T细胞实际上是人肿瘤微环境中高度增殖,克隆且动态分化的细胞群。而第一篇文献是说肿瘤免疫微环境中的组织结构,空间富集分析显示,肿瘤免疫混合和区隔化,与细胞型和定位特异性的PD1、PD-L1和IDO表达一致。总的来说,就是PD1与耗竭的T细胞相关,而耗竭的CD8 +T细胞具有高度增殖的特点。
1. A Structured TumorImmune Microenvironment in Triple Negative Breast Cancer Revealed by Multiplexed Ion Beam Imaging. PMID:30193111
2. Dysfunctional CD8 T Cells Form a Proliferative, Dynamically Regulated Compartment within Human Melanoma. Cell 176, 775–789.e18. PMID:30595452
Q2:文章中的生态系统是强调整体吗?但是如何去计算生态系统的评分呢?
A2:肿瘤生态系统由癌细胞,浸润的免疫细胞,基质细胞和其他细胞类型以及非细胞组织成分组成。这个是官方解答,对于本文来讲,我的理解是实体瘤的重要组成是上皮细胞,其余还有间质细胞,老生常谈的非常重要的免疫细胞和髓样细胞,把这些因素都考虑进去再进行分类,就是一个新的名词生态系统。生态系统的评分是作者设计出的评分系统,其中降维和聚类是t-SNE algorithm (Van Der Maaten and Hinton, 2008),上皮细胞和免疫细胞的表征是采用的 PhenoGraph (Levine et al., 2015)。
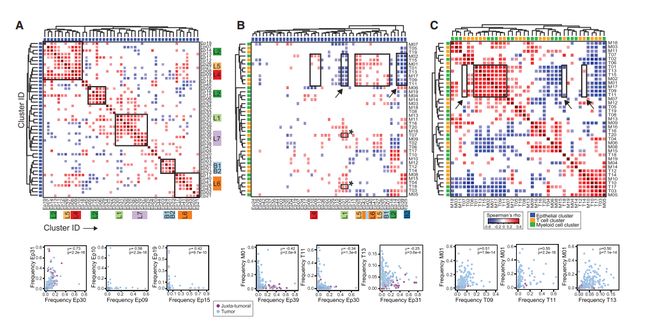
Q3:Fig 2L将 19个髓细胞亚群(M01-M19)根据PhenoGraph和t-SNE分为图2L的5类,具体的分类依据是什么?
A3:方法学中的介绍是对于图2D,2L和3C中所示的热图,使用Spearman相关性作为距离函数和平均连锁度,对所示标记的丰度水平进行聚类。而5类是依据以往对这些细胞的免疫组化的标记来进行判别,作者对髓样细胞进行了22种免疫组化的标记。
Q4:结果的第5部分(图4)中主要说明 表型异常和肿瘤的个体化与预后不良相关,但是并没有表明预后相关的指标?
A4:表型异常的临床证明比较多,比如说G3,ER-,TN组,如图4F,G,H。以及4I中显示了KI67和CA9,这些都是预后不良的标志。而个体化差异只显示了ER-组。
Q5:图4M(ER+肿瘤的个体化差异性很大,且与ERa+细胞所占百分比相关)具体说明了什么问题?
A5:说明了临床上以ER阳性或阴性来对病人进行分类并不是最准确的,作者对这种传统意义上的分类提出质疑,作者的实验表明有一些ER+的病人也可以使用免疫抑制治疗。