本文译自:Preclinical Characteristics of the Irreversible Pan-HER Kinase Inhibitor Neratinib Compared with Lapatinib: Implications for the Treatment of HER2-Positive and HER2-Mutated Breast Cancer
作者:Denis M. Collins来自NationalInstitute for Cellular Biotechnology, Dublin City University
文章于2019年5月发表于Cancers。
摘要:据估计,有15-20%的乳腺癌患者人体内表皮生长因子受体2 (HER2/ERBB2/neu)为过表达。两种小分子酪氨酸激酶抑制剂(TKIs),Lapatinib和Neratinib,已经被批准用于治疗HER2阳性(HER2+)乳腺癌。Lapatinib,表皮生长因子受体(EGFR / ERBB1 / HER1)和HER2的可逆抑制剂,与capecitabine联用用于治疗晚期HER2 +乳腺癌,与曲妥珠单抗联用治疗激素受体阴性的转移性乳腺癌患者,与aromatase抑制剂联用为HER2 +乳腺癌的一线治疗方案。Neratinib是新一代、不可逆的泛HER TKI,在美国用于1年曲妥珠单抗治疗的早期HER2+乳腺癌成年患者的延长辅助治疗。在欧洲,Neratinib被用于曲妥珠单抗辅助治疗完成一年之内的早期HER2+乳腺癌患者的延长辅助治疗。临床前研究表明,这些药物的独特性可能影响其临床活性。本篇综述描述了Lapatinib和Neratinib的临床前特征,重点介绍了可能对患者管理有影响的两种药物之间的差异。
1. 前言
五种HER2/ERBB2/neu的靶向治疗目前已获得美国食品和药物管理局(FDA)批准:trastuzumab、pertuzumab、trastuzumab emtansin (T-DM1)、lapatinib和neratinib,用于治疗HER2阳性(HER2+)乳腺癌。这些药物可分为三类:抗HER2单克隆抗体(trastuzumab和pertuzumab)、抗体-药物结合物(T-DM1)和小分子泛- HER酪氨酸激酶抑制剂(TKIs; lapatinib和neratinib)。其他一些HER靶向的TKIs目前正在开发中,包括tucatinib、poziotinib和pyrotinib。本文综述了两种经批准的小分子泛HER
TKIs药物lapatinib和neratinib的临床前研究结果,以期为临床前研究提供更深入和全面的综述。涉及lapatinib和neratinib的临床试验已在其他地方进行了综述,本综述未涉及。
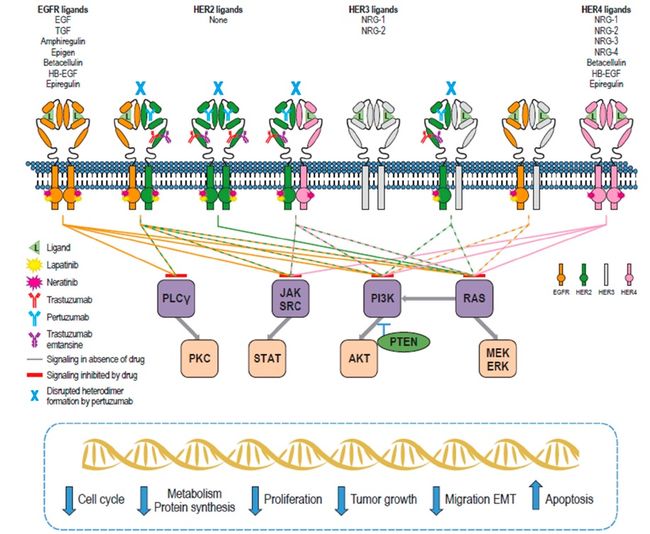
Lapatinib和neratinib的异同参见表1。两者有两处最大的差异分别是:Lapatinib与靶点可逆结合而neratinib结合不可逆;它们对EGFR、HER2以及HER4的亲和力不同。其他的区别包括:激酶谱、体外细胞毒性、对HER家族二聚作用的影响、对HER2内吞作用的影响、对突变的EGFR、HER2或HER4的抑制以及耐受机制等。
2. The HER/c-ERBB家族概述
HER家族包含一组与肿瘤发生相关的受体酪氨酸激酶(RTKs)。该家族有4个成员:EGFR、HER2、HER3 (ERBB3)和HER4。这些受体广泛表达,对正常发育至关重要。HER家族RTKs具有一个共同的结构类型,包括一个配体胞外结构域(ECD)、一个单跨膜段和一个具有羧基尾巴的胞内蛋白激酶结构域。ECD包含四个子域。当与配体结合时,子域I与子域III结合,引发构象变化,暴露子域II,即二聚域,允许同源或异源受体发生二聚化并激活激酶。域II和域IV参与二硫键的形成。HER家族成员C端酪氨酸激酶的反式或者自磷酸化可以招募信号分子Src 2和磷酸化酪氨酸结合域,并启动细胞内的信号级联反应,包括MAPK和PI3K信号通路。这些通路随后激活转录因子,实现细胞存活、增殖、运动和分化等等功能。
已知的表皮生长因子(EGF)样配体有11种。这些配体可能特异性的,如结合EGFR的EGF、TGF-ɑ和epigen,也可能是非特异性的,如结合HER3和HER4的neuregulins、结合EGFR和HER4的epiregulin。HER2没有已知的配体。每个配体大约包含55个氨基酸,都有一个EGF样的三个二硫键保守区域和一个富含loop的结构。理论上HER家族的异质二聚体组合有十种;然而,HER2是首选的二聚伙伴,因为它以类似于配体激活状态的开放构象存在。与其他二聚体相比,含HER2的二聚体解离率更低,信号转导更强。
2.1. HER2的过表达
HER2在15-20%的乳腺癌中过表达。在其他恶性肿瘤中,有报道在胃癌、食管癌、膀胱癌和胆囊癌中,HER2过表达率分别为4.7%、11.3%、12.4%和9.8%,在上皮胆管癌中,HER2过表达率为6.3%。Trastuzumab是首个临床批准的HER2靶向药物,它的应用彻底改变了HER2+乳腺癌患者的预后。在Trastuzumab出现之前,HER2+乳腺癌被认为是预后最差的临床亚型。此后,多种HER2靶向制药物被开发出来,包括抗体疗法如pertuzumab和小分子TKIs,如lapatinib和neratinib,这是仅有的两种被批准用于治疗HER2+乳腺癌的TKIs。
2.2. HER2突变
HER家庭的四个成员的基因点突变在各种癌症中已有报道,COSMIC数据库中也有更新(https://cancer.sanger.ac.uk/cosmic)。在没有HER2过表达的情况下,病人体内往往存在HER2激活突变,这些患者群体也可能通过HER2靶向药物得到治疗。
3. Lapatinib和Neratinib: HER靶向的小分子TKIs
小分子,如Lapatinib和Neratinib,与单克隆抗体疗法相比具有许多固有的优势特性,如能够同时靶向多个激酶家族成员,直接作用于细胞内信号转导位点,并可能跨越血脑屏障。此外,由于这些TKIs在细胞内结合,它们可以抑制p95HER2,而p95HER2是一种高度活跃的、截短的HER2形式,缺乏ECD的大部分,而Trastuzumab和其他ECD靶向的抗体治疗对其不起作用。Lapatinib和Neratinib的相似点和不同点见下表1。
3.1. Lapatinib:可逆型TKI
Lapatinib (Tykerb®;Tyverb®;瑞士巴塞尔诺华国际公司)是EGFR和HER2的可逆TKI。Lapatinib于2007年获得FDA批准,并与capecitabine联用,针对trastuzumab治疗后仍发生进展的转移性HER2+乳腺癌患者。2010年,Lapatinib被批准与letrozole联用针对HER2+、雌激素受体阳性(ER+)的乳腺癌患者的治疗。2008年,Lapatinib获得了欧盟委员会(European Commission)的上市许可:与capecitabine联用,用于已经接受anthracyclines和taxanes治疗后仍然恶化的晚期或转移性疾病(转移后接受过trastuzumab治疗)的患者;与trastuzumab联用,用于前期接受trastuzumab联合化疗仍然发生进展的激素受体阴性的转移性乳腺癌患者;与aromatase抑制剂联用,用于目前不打算用于化疗、激素受体阳性转移性疾病的绝经后妇女。
2001年,Rusnak等人描述了GW2016在临床前模型中的活性(GW572016; Lapatinib)。体外激酶实验显示,其对纯化的EGFR和HER2的半数抑制浓度(IC50)分别为10.8和9.2 nM。EGFR和HER2过表达的肿瘤细胞系模型增殖的IC50值< 160nm,比正常组织细胞系模型低100倍。在头颈(HN5)和HER2+乳腺癌(BT474)细胞系模型中,使用体外增殖和BrdU掺入试验以及PI染色,证实了Lapatinib的细胞毒性而非生长阻滞。使用相同的细胞系模型,Lapatinib在体内也显示出浓度依赖性的对肿瘤异种移植物生长的抑制。当与HER2结合时,Lapatinib抑制PI3K/蛋白激酶B (AKT)和MAPK信号通路。MAPK信号抑制导致BCL2相互作用的细胞死亡介质(BIM)表达增加,导致细胞凋亡。Lapatinib还可以通过降低survivin水平和增加mcL-1水平来诱导细胞凋亡。Lapatinib还诱导HER2在细胞表面的稳定和积累,这可能增加trastuzumab诱导的ADCC。
3.2. Neratinib: 不可逆TKI
Neratinib (Nerlynx®;彪马生物技术公司(Puma Biotechnology, Inc.)是一种不可逆的pan-HER TKI,于2017年获得FDA批准。Neratinib可用于辅助Trastuzumab治疗后的早期HER2过表达乳腺癌的延长辅助治疗。欧盟委员会于2018年批准Neratinib上市,用于Trastuzumab治疗一年内的早期激素受体阳性HER2过表达乳腺癌成人患者的辅助治疗。
激酶实验显示,Neratinib抑制HER2和EGFR活性的IC50分别为59±13 nM和92±17 nM,对包括AKT、cyclin D1/ CDK4、cyclin E/CDK2、cyclin B1/CDK1、c-RAF以及c-Met在内的其他激酶没有明显抑制活性。据报道,Neratinib抑制HER4活性的平均IC50为19 nM。对一系列EGFR和HER2表达不同的细胞进行的增值实验也证实了Neratinib对受体的选择性:对HER2过表达细胞系(SKBR3、BT474和3T3/neu)的IC50值很低(2–3 nM),对EGFR过表达的表皮样癌细胞系A431的IC50略高(81±9 nM),HER2/ EGFR阴性细胞系(3T3、MDA-MB-435和SW620)的IC50的平均值均为690 ±84 nM。Neratinib抑制了配体依赖和非配体依赖的HER2和EGFR活性及其下游的MAPK和AKT信号通路。尽管已经停药,但在细胞系模型中,Neratinib仍被证实具有共价结合的抗增殖功能,并发现其对细胞周期相关的cyclin D1、蛋白27和视网膜母细胞瘤蛋白具有浓度依赖性的影响。最后,在过表达HER2 (3T3/neu和BT474)和EGFR (SKOV-3和A431)的异种移植模型中,Neratinib可显著抑制体内肿瘤生长。
4. Lapatinib和Neratinib的差异
4.1. 对HER家族蛋白二聚化的影响
不仅抑制细胞内受体磷酸化,Lapatinib和Neratinib还会干扰HER受体的二聚作用,这一点与其他TKIs如Gefitinib和Erlotinib不同。Lapatinib和Neratinib与HER家族成员的非活性构象结合,从而限制了配体诱导的激活。然而,Claus等人最近从HER2+乳腺癌的二维和三维模型中发现,Lapatinib和neuregulin协同增强了的增殖。作者认为,Lapatinib诱导的HER2/HER3构象与典型配体诱导的异源二聚体不同,它依赖于HER3结合ATP,并可被neuregulin激活。有趣的是,在同一模型中,没有观察到Neratinib和neuregulin的协同效应。作者假定,与可逆的非共价Lapatinib结合相反,Neratinib的结合具有不可逆的共价性质,这解释了这种差异。
4.2. Lapatinib和Neratinib激酶谱的差异
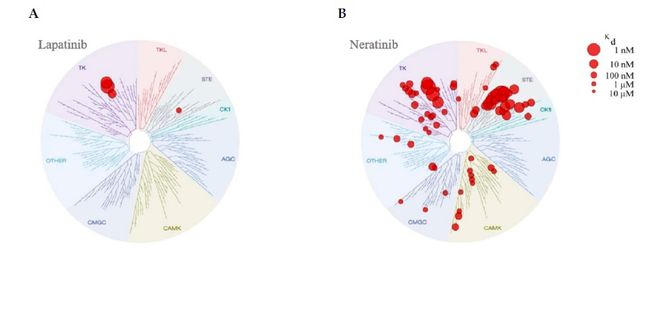
小分子激酶抑制剂是针对激酶功能和结构保守的ATP结合位点设计的。这经常导致多重药理作用或者脱靶效应。II型激酶抑制剂,包括Lapatinib和Neratinib,在DFG (asp - phe - gly)之外结合非激活构象的激酶结构域,这使得它们能够进入ATP位点附近的变构结合口袋,在大多数(但不是所有)病例中具有更好的选择性。I型激酶抑制剂通常在ATP位点结合活性构象的激酶,无法进入变构结合口袋,从而选择性变异性更大。
激肽组抑制实验表明,Lapatinib和Neratinib的结合模式存在显著差异。Davis等人筛选了包括Lapatinib和Neratinib在内的72种已知激酶抑制剂对一组442种激酶竞争结合测定的活性,这442种激酶覆盖了超过80%人蛋白激酶。因为ɑ-c螺旋不寻常的位移,Lapatinib不能归入典型的II型抑制剂,但在测试的72种抑制剂中,Lapatinib的选择性非常好。与Lapatinib相比,Neratinib的选择性较低,靶向EGFR、HER2和HER4以及TK和STE子域的成员,特别是KHS1/KHS2,在TKL、CMGC、AGC、CK1和CAMK子域中也发现了具有较低结合度的靶向激酶。Klaeger等使用化学蛋白组学方法(kinobeads)和定量质谱分析了243个临床相关激酶抑制剂的靶蛋白组。他们的发现也证实了Davis等人的研究结果,Lapatinib比Neratinib更具选择性。更多数据可以参考proteomics DB(https://www.proteomicsdb.org/#projects/4257)和KinMap (http://kinhub.org/index.html)。
激酶抑制剂的高选择性通常对由特定靶标驱动的癌症亚型有优势,也会降低脱靶效应从而降低细胞毒性;然而,靶向较多kinome也有其优势。Neratinib对疾病相关HER家族成员的更完全的不可逆抑制,阻止了疾病绕过治疗靶点发展形成耐药。Lapatinib对EGFR和HER2具有较高的亲和性,但是可逆的,这导致其作用靶点的不能完全被抑制。Neratinib还与HER家族下游的MEK1和MEK2具有高亲和性,可能增加其抗增殖作用的。
Neratinib的脱靶效应可能有助于增强与其他靶向治疗和化疗的协同作用,如dasatinib,它也抑制TK、TKL和STE子域中的激酶。然而,应该注意的是,尽管激酶组抑制实验显示Neratinib是一种比Lapatinib选择性更低的抑制剂,它不会不可逆结合缺乏必要半胱氨酸残基的脱靶位点。此外,测定亲和力为100 – 3000 nm的激酶组靶点结合说明许多相互作用可能没有临床意义,因为在患者中使用批准的剂量可能无法达到所需的肿瘤内浓度。
4.3.与HER家族成员的相互作用机制
除了选择性的差异,Lapatinib和Neratinib与HER家族成员的作用方式也有不一样。Tsou等以现有EGFR-Erlotinib相互作用的晶体结构数据为模板,建立了HER2催化域的同源模型。作者提出Neratinib是这样起作用的:Neratinib头部插入ATP结合口袋,使得一个吸电子集团靠近一个双键(迈克尔受体),从而定位至EGFR的半胱氨酸残基或是其他家族成员的半胱氨酸残基,进一步地,β-碳和半胱氨酸残基之间形成共价键。Neratinib与EGFR的Cys-797不可逆的共价结合克服了EGFR T790M突变导致的耐药性——如同L858R突变肺癌对Erlotinib或Gefitinib的常见耐药机制。
4.4. 对HER2+ 和EGFR+细胞株的细胞毒性作用
Lapatinib和Neratinib的细胞毒性已被广泛研究。这两种药物在体内和体外都证明了对HER2和EGFR过表达乳腺癌细胞系的抑制作用,其中Neratinib在细胞系模型中表现出更低的IC50值。在每个细胞系中,Neratinib都比Lapatinib更有效,见表2。
Canonici等人使用36个乳腺癌细胞系(包括12个HER2+细胞系)中检测了Neratinib的敏感性。根据之前发表的相同细胞系中Lapatinib的IC50值,所有HER2+细胞系对Neratinib比对Lapatinib更敏感。Neratinib敏感性与HER2阳性乳腺癌小组中HER2总水平和磷酸化水平相关。同样地,Konecny等人表明,HER2总水平而不是EGFR水平,是药物体外敏感性的预测指标。在一组trastuzumab敏感细胞系中,trastuzumab加Neratinib比比单独使任何一种药物更有效。相反,在一组对trastuzumab耐药的HER2+细胞系中,对Neratinib敏感的HER2+细胞系中,添加trastuzumab没有提供额外的益处。
在11个HER2+乳腺癌细胞系中,将Neratinib与Lapatinib和另一个不可逆的pan-HER TKI进行比较。在这项研究中,Neratinib在11个细胞系中比Lapatinib更有效,在9个细胞系中比Afatinib更有效。按照TKIs敏感或耐药给每个细胞系分类:三个细胞系显示出对所有三个TKIs的固有抗性(JIMT-1、MDA-MB-453和UACC-732)。我们对3个HER2+乳腺癌细胞系进行了联合用药增殖检测:对trastuzumab/Lapatinib敏感的SKBR3;对trastuzumab/Lapatinib/Neratinib/Afatinib联用耐受的MDA-MB-453和对Lapatinib敏感/对trastuzumab耐受的HCC1569)。三种TKIs均可改善SKBR3对trastuzumab的应答,但添加pertuzumab无效。联合TKI不能增强MDA-MB-453或HCC1569细胞系对trastuzumab的反应,但trastuzumab/pertuzumab/neratinib三组表现出最强的抗增殖效果。配体Amphiregulin和heregulin的加入改变了应答;在两种配体任意一个存在的情况下,单独增加trastuzumab,pertuzumab或neratinib浓度都没有效果,但三种抑制剂联合使用时生长显著被抑制。
Stanley等人的一项综合性研究检测了一组乳腺癌细胞系的HER家族蛋白表达、对单独的可逆和不可逆HER家族抑制剂或联合其他靶向激酶和化疗药物的敏感性。在所有检测的细胞系中,Neratinib的IC50值都低于Lapatinib。Neratinib IC50值与Afatinib相当或低于后者。作者发现EGFR、HER2或HER3的表达与Lapatinib或Neratinib的反应之间没有统计学意义上的关系。在EGF配体存在与否、肝素结合EGF存在与否、neuregulin 存在与否等不同条件下,对SKBR3细胞系中HER家庭成员磷酸化水平进行分析发现,不可逆的HER家族受体TKIs比可逆TKIs对HER家族受体及其下游信号分子受体(AKT/ MAPK)磷酸化水平的抑制作用更强。
总之,对细胞毒性的临床前评估表明,Neratinib和Lapatinib之间存在若干差异。在HER2+乳腺癌细胞系模型中,Neratinib比Lapatinib或Afatinib有更强的抑制增殖和阻断下游信号通路的作用,还可以增强trastuzumab对trastuzumab敏感的HER2+乳腺癌细胞系的作用。具有trastuzumab抗性的细胞系模型对Neratinib敏感,而耐Neratinib的细胞系模型对trastuzumab、Lapatinib和Aafatinib具有交叉抗性。Lapatinib对HER家族成员的不完全抑制可能是细胞通过激活EGFR/HER3和HER4而产生耐药性的决定性因素。在trastuzumab中加入TKI是有益的,Lapatinib和Neratinib均可改善trastuzumab对trastuzumab敏感的HER2+细胞的反应;添加pertuzumab并没有增强这种效果。Neratinib与Trastuzumab、Pertuzumab三联用药在HER2靶向治疗耐药细胞系模型中比Lapatinib三联用药更有效。
4.5. 对HER2突变细胞的细胞毒性
最近发现的可能受益于HER2抑制剂的患者群体是那些即使在没有基因过表达的情况下肿瘤也会激活HER2突变的患者。多项研究报道,致瘤HER2突变主要发生在HER2的激酶结构域。八个乳腺癌基因测序研究分析从25非HER2过表达乳腺癌患者中确定了13 HER2激活突变。与野生型HER2相比,根据HER3和EGFR磷酸化的增加把这13种突变分成HER2激活功能不同的七类。在小鼠异种移植研究中,接种了三突变(V777L、D769H和G309A) NIH3T3细胞的动物比接种了野生型HER2细胞的对照组肿瘤生长更快。
了解哪些HER2突变对哪些HER2抑制剂有反应十分必要。例如,已知HER2 L755S突变与Lapatinib耐药有关。逆转录诱导的MCF-10A中HER2 L755S通过抑制细胞生长和HER2磷酸化来介导对Lapatinib (但不包括Neratinib)的耐药性。HER2 L755S的进一步研究表明,来自BT474的两种耐药细胞系分别独立产生了该突变:Lapatinib耐药株BT-474-AZ/LR和Lapatinib耐药株和曲妥珠单抗株BT474/ATCC-LTR细胞系。HER2 L755S的小干扰RNA敲除逆转了这种耐药,而HER2 L755S的异位表达在BT474、SKBR3和AU565细胞系的治疗初期即对Lapatinib产生耐药性。Neratinib还克服了两种携带L755S突变的BT474细胞系模型对Lapatinib和Lapatinib/曲妥珠单抗的耐药性。此外,非小细胞肺癌相关的HER2 L755P突变也介导了Lapatinib的耐药。Neratinib对6个HER2突变株转化MCF10A和HER2野生型转化MCF10A细胞的抑制作用比Lapatinib强几个数量级。在3d Matrigel®(BD)检测中,HER2突变P780_Y781insGSP对曲妥珠单抗和Lapatinib有抗性,但对Neratinib没有抗性。一个HER2 L869R突变型乳腺癌患者在接受Neratinib治疗后最初出现部分应答,随后病情进展,出现继发性‘看门人’HER2突变T798I。体外分析表明,尽管Neratinib对HER2双突变体无效,但Afatinib和Osimertinib代谢物AZ5104可以抑制HER2的磷酸化。
也有人提出,含有能够介导Lapatinib/曲妥珠单抗耐药的外显子20突变的癌症可能对Neratinib治疗敏感。Koga等报道了Neratinib在HER2外显子20插入突变A775_G776insYVMA、G776delinsVC和P780_Y781insGSP的肺腺癌中的敏感性指数低于Lapatinib。在SUMMIT试验中,观察到外显子20插入的乳腺癌患者中50%对Neratinib治疗有反应,而携带相同突变的非小细胞肺癌患者对Neratinib的反应有限。
也有先关研究分析了HER2过表达和突变并存的记录。筛查1248例原发性乳腺癌中的22个HER2外显子和18个匹配的转移性样本,发现2.24%的肿瘤(1248例中有28例)存在HER2突变。在该研究中,HER2+和HER2阴性肿瘤的突变率相似:在HER2+肿瘤中,HER2的突变率为2.31%(910中21例),而在HER2阴性肿瘤中为2.07%(338中7例)。这些突变的功能分析表明,L755S和K753E突变与Lapatinib和曲妥珠单抗耐药有关,而与Neratinib耐药无关。在NIH3T3细胞中,携带HER2 L768S和V773L突变的细胞比携带野生型HER2的细胞更快形成肿瘤。携带K753E突变的MCF10A、BT474和MDA-MB-231细胞对Lapatinib耐药,但对Neratinib没有抗性,耐药HER2 K753E和L755S突变在转移病灶中富集。
在对HER2扩增和突变的乳腺肿瘤的研究中,Cocco等人发现,HER2的突变和扩增与培养细胞系中曲妥珠单抗和Lapatinib的不良反应相关。在小鼠中,一例HER2+肿瘤患者在接受曲妥珠单抗治疗后发生了获得性D769Y突变,该患者建立的异种移植对曲妥珠单抗和Lapatinib有耐药性,但对Neratinib敏感,Neratinib治疗导致肿瘤持续缩小。
在临床上,SUMMIT (NCT01953926)验证了以HER家族突变为靶点的治疗相关性,这是一项正在进行的、多中心、多组织学、II期精密医学一篮子试验,旨在研究Neratinib对HER2突变型癌症患者的疗效和安全性。有趣的是,Neratinib的有效性依赖于特异性突变和肿瘤组织,其中乳腺癌、宫颈癌和胆道癌应答最大。考虑到HER2突变的相对稀缺性,基因组筛选方案HER-Seq (NCT03786107)旨在通过对从转移性乳腺癌或宫颈癌患者收集的血浆进行HER2靶向测序,来识别可能适于加入Neratinib治疗方案(如SUMMIT)的患者。
4.6. 对下游信号和基因表达的影响差异
如上所述,Lapatinib和Neratinib特性的差异可以影响下游信号通路,从而导致细胞对药物的差异反应。经Lapatinib处理后,有5个基因(RB1CC1、FOXO3a、NR3C1、ERBB3和CCND1 [cyclin D1])的表达水平发生改变,且与Lapatinib敏感性相关。后续研究使用TaqManTM实时PCR检测了这些基因在三个HER2+细胞系(TKI敏感的SKBR3和BT474,以及对Lapatinib不敏感的MDA-MB-453)中对Lapatinib、Neratinib和Afatinib的响应表达。据报道,Lapatinib和Neratinib对所有三个细胞系的基因panel有类似的影响模式,不过,相比Lapatinib,Neratinib处理的SKBR3和BT474细胞中有4个基因表达的变化幅度更大。有报道称,在Neratinib治疗后,CCND1水平也发生了改变。
定量的、无标签的、液相色谱-质谱的蛋白质组学方法被用来研究短期TKIs治疗后HER2+乳腺癌的细胞系模型。BT474细胞系分别经Lapatinib、Neratinib和Afatinib处理12小时。Neratinib (150 nM)作用后发现21个蛋白发生显著变化,而Lapatinib (1 μM)处理后有16个蛋白发生显著变化。根据收集到的数据发现,短期暴露在Lapatinib或Neratinib使得6个蛋白水平显著改变,它们分别是:lamina相关多肽2、依赖DNA的蛋白质激酶催化亚基、drebrin、myristoylated alanine-rich
C激酶底物,78 kDa葡萄糖调节蛋白质和多(ADP-ribose)聚合酶1,但Afatinib对它们并无如此显著影响。三种蛋白质被Afatinib和Neratinib共同影响了3种蛋白质,它们是异质核核糖核蛋白H、白细胞介素增强结合因子3和线粒体三功能酶亚单位β,分别参与mRNA剪接、凋亡/蛋白代谢和蛋白乙酰化,但Lapatinib对它们并无相应作用。最后,三种抑制剂都能够引起改变的蛋白只有两个:三功能酶亚基ɑ和异质核核蛋白R。这些蛋白的功能广度表明,TKI间差异可能在肿瘤细胞对这些治疗的反应中具有潜在的意义。在蛋白质组学研究中,作为五基因小组的一部分所检测的基因的蛋白质产物并不明显,这可能与RNA和蛋白质表达对药物暴露应答的时间差异有关。
4.7. HER2受体水平和胞吞作用
细胞内吞作用可以调节细胞表面的RTKs水平,通过内吞作用RTKs内化为内吞小体,在内吞小体中,RTKs可被回收到细胞表面或进入溶酶体降解,配体结合会加速这一过程。EGFR同型二聚体和EGFR/HER2异型二聚体的亲和力相当,EGFR/HER2复合物内化为单一实体。对HER2内化的研究表明其细胞表面的稳定性依赖于HSP90。HSP90抑制剂会诱导HER2通过蛋白酶体或溶酶体途径降解,后者受泛素化调控。据报道,HSP90抑制剂NVP-AUY922可抑制HER2+和曲妥珠单抗耐受的乳腺癌细胞的生长。体外实验中,NVP-AUY922能够增强对曲妥珠单抗的应答,但不能增强对化疗的反应。增殖细胞中,配体激活HER3的核定位与不依赖于网格蛋白的内吞机制有关。据报道,HER2、HER3和HER4的内化和溶酶体靶向性低于EGFR,表明EGFR调控可能受到其他家族成员过表达的影响。越来越多的证据表明,Lapatinib和Neratinib对HER2在细胞表面水平相反的影响,Lapatinib使之升高,Neratinib使之降低。Zhang等人对这些现象的潜在机制提出了假设。在3个HER2+细胞系(SKBR3、AU565和HCC1954)中,Neratinib通过增加泛素化增强了HER2的内吞降解,而HER2转录水平仅有中度升高,而Lapatinib则导致HER2转录水平的强烈上调,使HER2的内吞作用更加有限。
TKI改变HER2水平对曲妥珠单抗诱导的ADCC反应的促进作用是两者联用的有利指征。Lapatinib诱导的HER2增加导致了HER2+腺、胃和间皮瘤细胞系模型中曲妥珠单抗介导的ADCC增强。
然而,Lapatinib和Neratinib对ADCC的影响可能还与HER2抗原水平以外的其他因素有关,因为这两种TKIs均可导致ADCC在体外升高,其程度与使用的免疫效应细胞的细胞毒能力相关。Lapatinib耐药HER2+乳腺癌细胞系的谱分析表明,体外TKI耐药表型与曲妥珠单抗相关的ADCC降低有关,而这也与HER2的表达水平无关。HER2的ECD可被基质金属蛋白酶切掉,释放出可溶性形式的HER2 (sHER2)进入外周循环。较高的sHER2基线水平是早期切除HER2+乳腺癌患者无病生存期预后较短的指标;复发时较高的sHER2水平也可预测较短的生存期。曲妥珠单抗已被证明通过抑制HER2基础和激活的蛋白水解裂解来抑制sHER2的脱落。相反,Lapatinib增加了肿瘤细胞表面HER2的非活性水平,增加了sHER2的释放。在晚期乳腺癌患者中,较高的sHER2水平可预测Lapatinib治疗可改善无进展生存期。目前Neratinib还没有类似的数据。
5. Lapatinib和Neratinib的耐药性
尽管HER2靶向治疗取得了临床成功,但耐药性仍是一个棘手的问题。体外细胞系模型已广泛用于研究Lapatinib和Neratinib耐药的可能机制。这包括持续暴露于TKI、剂量增加治疗或单细胞克隆。
5.1. Lapatinib耐药
许多潜在的Lapatinib抗性机制已经被提出。大致可分为:激活替代性的其他RTKs;下游PI3K或MAPK信号的重新激活;或表型转换。
虽然HER2+乳腺癌细胞的增殖是由HER2信号驱动的,但当HER2信号被抑制时,冗余的生存机制可能被激活。这包括其他RTKs的上调,如其他HER家族成员、MET、成纤维细胞生长因子受体-2(FGFR-2)和胰岛素样生长因子-1受体(IGF-1)。一项研究中使用了4个具有获得性Lapatinib抗性的细胞系,发现尽管没有PIK3CA突变或PTEN缺失,Lapatinib也抑制了HER2活性,但下游PI3K信号仍持续存在。抗性是由EGFR-HER3二聚化作用介导的,而EGFR-HER3二聚作用是由膜结合heregulin水平的增加调节的。有趣的是,Neratinib克服了这种Lapatinib抗性。HER4信号通路也可能是一种耐药机制:Canfield等研究表明,HER2+乳腺癌细胞系模型中Lapatinib和曲妥珠单抗耐药(BT474-LR、SKBR3-TR、SKBR3-LR和SKBR3-LTR)细胞株的生存依赖于HER4的表达,这与它们的母细胞系不同。作者认为,几种pan-HER家族抑制剂(Afatinib,Canertinib,Dacomitinib,Varlitinib和Neratinib)在HER2+Lapatinib耐药乳腺癌模型中的疗效可能取决于其抑制HER4活性的能力。作者还报道了一项体内研究,发现在所有Lapatinib治疗的HER2+肿瘤中均有膜性肿瘤HER4的表达。
另外,Lapatinib耐药还可能是通过下游的PI3K活化而发生,后者的活化可能由胰岛素受体底物4 (PIK3CA的间接胞质激活剂)-Src家族激酶激活或PIK3CA/HER2突变激活引起。ER通路的激活也可能导致HER2靶向治疗的耐药性。Li等人发现,在5 μm Lapatinib存在的情况下,HER2和PIK3CA受到抑制,获得Lapatinib抗性的BT474细胞通过ER和MAPK信号通路增强而获得增殖,该增值可以通过添加fulvestrant得到抑制。蛋白磷酸酶2A (PP2A)也可能在体外提供Lapatinib抗性:在两个获得Lapatinib抗性的细胞系中证实了PP2A活性的增加,PP2A的抑制导致对Lapatinib的再度敏感。
上皮-间质转化(EMT)形成干细胞样表型,该过程与抗肿瘤治疗相关。临床前研究表明,EMT与HER2靶向治疗耐药的出现有关。抗Lapatinib SKBR3细胞表现出EMT标记物以及HER2表达下降,利用抗整合素抑制抗体AIIB2可重建上皮样表型。
5.2. Neratinib耐药
尽管Neratinib最近才被批准用于治疗HER2+乳腺癌,几种耐药机制已被发现,包括降低促凋亡的BCL2家族成员表达、加细胞色素P450 (CYP) 3A4活性等。Karakas等在使用来自SKBR3、ZR75-30和BT474的Neratinib耐药HER2+细胞系的研究中发现,SKBR3和ZR75-30耐药株细胞中抗凋亡的MCL-1水平升高、促凋亡的BCL2家族成员BIM和p53上调凋亡调节剂(PUMA)水平下降。BT474耐药细胞也表现出BIM和PUMA水平下调,BCL2和BCL-XL水平升高,以克服Neratinib诱导的细胞凋亡。此外,尽管在Neratinib作用下,这些细胞系仍表现出下游ERK-1/2的持续激活。使用ERK1/2特异性抑制剂SCH772984和pan-BCL2抑制剂ABT -737,进一步研究了耐药细胞株对ERK抑制以及BCL2/BCL-XL抑制的敏感性发现,Neratinib和SCH772984联用可以诱导SKBR3-NR和ZR75-30-NR的细胞凋亡,但Neratinib、SCH772984和ABT -737三种药物联用才能克服BT474-NR细胞对Neratinib的耐药性。
Neratinib也是CYP3A4的底物,CYP3A4活性增加已被证明会在细胞系模型中引起Neratinib抗性。Breslin等人通过体外持续Neratinib暴露培养出HCC1954-NR和EFM192A-NR细胞系。这些细胞系不仅耐Neratinib,还具备Lapatinib和Afatinib交叉耐药,比母细胞更具移动性和侵袭性,HER2表达降低。
PI3K通路激活是否可以使细胞株耐受Neratinib机制似乎取决于肿瘤类型和疾病环境。临床前实验证实,Neratinib可以抑制HER2扩增、PIK3CA突变的肿瘤细胞系的增殖,也可以抑制HER2阳性、PIK3CA突变异种移植模型的肿瘤生长。在III期ExteNET实验中,曲妥珠单抗标准基础治疗后,与安慰剂对照组相比,1年的Neratinib辅助治疗降低了PIK3CA突变或过表达癌症患者的绝对风险,但这种降低没有统计学意义。在第一批HER2-mutant一篮子试验的125名患者中,Neratinib单一疗法治疗的转移性实体瘤中,治疗小于24周比那些治疗大于24周的患者的PIK3CA基因突变更为广泛,尽管这差异并不显著。要确定PIK3CA突变对HER2驱动的肿瘤对Neratinib反应的影响,可能需要对特定肿瘤类型进行更大规模的临床试验。
在最近的一项研究中,Sudhan等人证明,激活HER2突变的耐Neratinib 5637和OVCAR8细胞系与其Neratinib敏感的亲代细胞相比,增加了S6激酶活性和S6磷酸化,且表现出对Lapatinib和Afatinib的交叉抗性。S6的激活主要是通过哺乳动物雷帕霉素(mTOR)复合物1 (mTORC1)通路的激活介导的,这至少部分归因于RAS通路的上调;Neratinib和everolimus联合用药克服了体内外Neratinib抗性。此外,在SUMMIT研究中,同时发生HER2突变和mTOR激活改变的患者对Neratinib的反应很差。作者得出结论,mTOR通路改变导致HER2信号再激活是组织学上不同HER2突变类型癌症中重要的Neratinib耐药性机制,Neratinib和mTORC1抑制剂联用对HER2和mTOR通路均发生突变患者可能有很大的临床意义。体细胞HER2突变也可能在耐Neratinib中发挥作用,最近有报道称,在一名接受Neratinib治疗的ER+/HER2突变(L869R)乳腺癌患者中获得了T798I看门人突变。
在SUMMIT试验中,一些HER2突变阳性的癌症患者在接受Neratinib治疗时出现了HER2的其他第二位点(“靶向”)突变和扩增。这表明,HER激酶信号过度激活超过有效的Neratinib抑制的阈值,可能同时导致原发和获得性耐药。
6. 新的靶向治疗联合用药方案
如第4.2节所述,Lapatinib和Neratinib与其他靶向药物联用时,其性质的差异可能会影响药效。组蛋白去乙酰化酶(HDACs)和组蛋白乙酰转移酶(HATs)在基因表达的表观遗传学调控中起关键作用。HDAC抑制剂对癌细胞有多种作用:细胞周期阻滞、分化和细胞死亡;减少血管生成以及对免疫反应的影响。Lapatinib和Entinostat联用在HER2+乳腺癌的两种体内模型(BT474和SUM190)中显示出协同作用,Entinostat通过诱导BIM1使曲妥珠单抗/Lapatinib耐药细胞系对Lapatinib敏感。HDAC抑制剂可以增强Neratinib的细胞毒性,另外的好处是,这种组合已被证明可以改善Afatinib耐药非小细胞肺癌和乳腺癌的临床前模型的抗肿瘤免疫反应。将周期蛋白依赖性激酶(CDK)4/6抑制剂Palbociclib加到Neratinib和HDAC抑制剂丙戊酸盐中,可抑制患者来源的铂/紫杉醇耐药的卵巢异种移植模型的生长。Neratinib +丙戊酸盐也增强了小鼠同系乳腺癌模型中程序性细胞死亡-1 (PD-1)抗体的敏感性。
P-糖蛋白 (P-gp;多药耐药蛋白1 [MDR1]/ ATP结合盒亚家族B成员1 [ABCB1])是一种药物排泄泵,在药代动力学和药效学中具有生理作用,是肿瘤多药耐药的主要介质。Lapatinib和Neratinib已被证明具有P-gp抑制剂的功能,能够在体外逆转多药耐药。Lapatinib已被证明可在癌细胞模型中增加P-gp,而Neratinib则相反。至于这些效应是否依赖于细胞系谱系还需要进一步的工作加以确定。这两种TKIs对P-gp的抑制可被认为是次级抗肿瘤功能,它们联合P-gp底物化疗可能对P-gp过表达肿瘤的治疗有价值。
ER被认为是抵抗HER2靶向治疗的一种代偿性信号通路。临床前研究发现在Lapatinib和Neratinib中添加抗雌激素是有意义的。Neratinib相对于Lapatinib对HER家族信号更完全的抑制可能进一步消除ER抑制下HER家族旁路通路,增加抗雌激素的活性。Neratinib和抗雌激素的联用在HER2突变模型中也具有协同作用。
此外,HER4在配体诱导的蛋白水解后产生的的胞内结构域(4ICD)已被证明,在ER+/HER2低表达细胞的细胞核中作为ER的辅激活因子。与Lapatinib不同,Neratinib有效抑制HER4的能力可能会对4ICD转录辅助因子活性产生负面影响。SUMMIT试验中研究了Neratinib 联合fulvestrant对ER+/ her2突变体的作用。研究这些试验中4ICD水平和翻译蛋白的定位可能会阐明4ICD对Neratinib和抗雌激素应答的作用机制。
其他组合也在临床前模型中显示出协同作用。多激酶抑制剂Regorafenib与Lapatinib在结直肠癌的临床前模型中显示出协同作用。此外,Lapatinib在体内增强了Regorafenib和磷酸二酯酶-5抑制剂Sildenafil对HER2+乳腺肿瘤生长的抑制作用。Neratinib在体内已显示出增强Regorafenib/Sildenafil对结肠癌细胞的抗肿瘤作用的能力。
7. 结论
Lapatinib和Neratinib的临床前活性取决于三个关键特性:Neratinib受体家族靶点的广度;Neratinib对Lapatinib的药效更强以及Neratinib不可逆抑制EGFR和HER2/4的能力。这些特性概括了Neratinib在体外评估用于治疗初治、难治性和HER突变乳腺癌模型中的TKIs细胞毒性时的明显优势。更完全的HER家族抑制使得Neratinib对曲妥珠单抗介导的ADCC的潜在影响及其与新靶向治疗相结合提供了更多可能。
在临床前模型中,Neratinib不可逆、有效和泛HER结合特性在多大程度上影响了TKI的临床特征,特别是与Lapatinib临床特征的关系仍有待确定。迄今为止,唯一比较Lapatinib和Neratinib的随机性研究是III期NALA试验,研究的是Neratinib加capecitabine与Lapatinib加capecitabine对三线HER2阳性转移性乳腺癌患者的疗效(NCT01808573)。顶线结果表明,Neratinib加capecitabine治疗可显著提高中央确诊无进展生存率,总体生存率较Lapatinib加capecitabine呈上升趋势。试验结果还表明,与Lapatinib加capecitabine相比,Neratinib加capecitabine治疗有症状的脑转移(研究的次要终点)的干预时间明显缩短。预防性治疗腹泻改善了Neratinib的主要临床副作用,允许在其他临床环境中使用Neratinib对HER2阳性或HER2突变肿瘤患者进一步研究。鉴于其独特的强效、不可逆、泛HER激酶抑制剂的特性,Neratinib有可能与多种分子靶向治疗协同作用,如在治疗初期或治疗难的情况下与曲妥珠单抗、T-DM1、抗雌激素、Src抑制剂、CDK4/6抑制剂、HSP90抑制剂和HDAC抑制剂等的联合作用。事实上,这几种组合策略已经在临床前模型中得到证明,并在早期临床试验中起到作用,目前我们期待正在进行的Neratinib研究中有进一步发现。