介绍
恶性肿瘤的发展和进展需要与肿瘤微环境中的其他细胞(包括免疫细胞)相互作用。由于肿瘤细胞中改变的蛋白的表达,免疫系统能够识别恶性肿瘤和诱导免疫应答,越来越多的证据表明,评估肿瘤浸润淋巴细胞(TIL)在许多类型的肿瘤中具有预后意义。
最近的研究表明,在辅助治疗的好处,免疫治疗5例只有一个。这些研究显示出明显的毒性,包括五分之一的甲状腺功能低下症和一百分之一的死亡,这些观察结果值得采用预后测试,该测试可以确定哪些患者可以幸免。
传统上,TILs在标准苏木和曙红(H&E)染色部分上的得分为半定量,即不存在,无轻度或轻度。一些使用包括TIL分布和密度8的四级分级系统。这些评分方法已经建立了很多年,但由于机构之间缺乏标准化以及对病理医生之间的可重复性的关注,尚未在临床决策中得到广泛采用。在乳腺癌,国际TIL工作组已经把认真抓好TIL的得分的标准化和出版由病理学家对HE切片的视觉评价做出了指导。尽管TIL指南的鲁棒性已在国际环试验中得到证明,但主观方法不太可能足够准确和可重现以用于选择要从治疗中幸免的患者。数字图像分析(DIA)可能会提供解决此问题的方法。DIA可以促进复杂空间格局的分析,并可以提供严格的验证的标准化指标。经典分割和神经网络的方法已在各种DIA平台广泛应用于克服细胞分类挑战。DIA平台能够评估TIL,但尚未发表任何研究来显示自动TIL评分在黑色素瘤中的稳健性。因此,我们建立了一种算法(称为eTIL%),用于对黑素瘤H&E染色切片上的肿瘤浸润淋巴细胞(TIL)进行基于图像的自动评估。
结果
TMA队列中自动TIL评分的性能交叉验证后,Xtile中具有统计学意义的最佳阈值为16.6%(p = 0.01)。
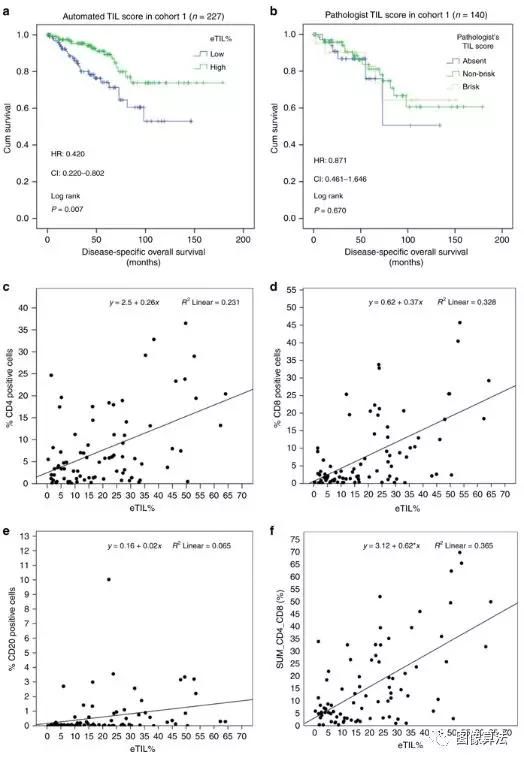
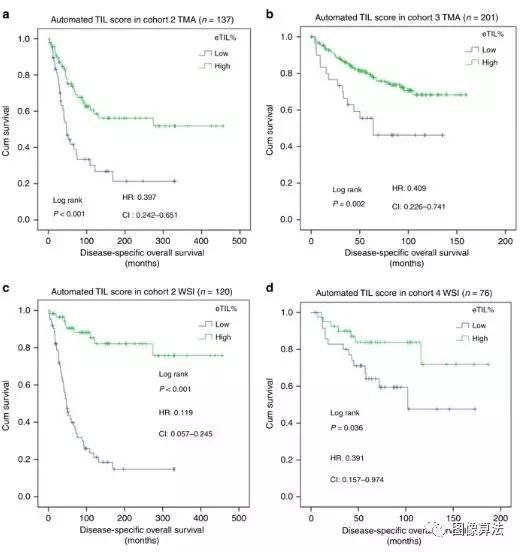
自动化的TIL评分算法显示,与低eTIL%相比,高eTIL%的患者表现出明显更好的疾病特异性总体生存率(Log rank p = 0.007;HR =0.420,CI = 0.220-0.802;图 1a)。TILs评分较高与预后良好相关。相比之下,传统的病理学家阅读的TIL视觉评估(修改为在TMA上评估)未能区分具有不同DSOS的患者队列(对数秩p = 0.821;HR = 0.871,CI = 0.461–1.646;图 1b)。)。使用定量荧光方法16也测试了同一队列的CD4,CD8和CD20表达。这些结果表明,每种淋巴细胞亚型与eTIL%的相关性较弱(图 1c–e),但是,尽管CD4趋于但未达到显着水平,但均未预后。我们发现eTIL与CD4和CD8的总和之间存在显着的相关性和公平相关性(Spearman r = 0.466,p <0.001)。使用队列2和队列3的TMA图像中队列1中定义的16.6%的切入点,eTIL%将患者分为预后良好的子集(队列2:对数等级p <0.001;HR = 0.397,CI = 0.242 –0.651;图 2a;同类群组3:对数排名p = 0.002;HR = 0.409,CI = 0.226-0.741;图 2b)。临床病理因素在单因素分析中是预后的(补充表 1)。我们还调查了eTIL%与临床病理因素之间的关联。#1,#2和#3队列中没有溃疡且肿瘤深度较小的患者,eTIL%评分较高。在队列#4中,eTIL%与任何临床病理因素之间未发现明显关联。
图1:队列1中的肿瘤浸润淋巴细胞(TIL)得分。队列#1 中自动TIL评分(a)和病理学家的TIL评分(b)的预后潜力。eTIL%评分与CD4阳性(+),CD8 +和CD20 +免疫细胞之间的相关性,通过定量免疫荧光(c – f)进行测量。
图2:在三个独立的队列中验证自动肿瘤浸润淋巴细胞(TIL)算法。在队列#2,#3和#4中对组织微阵列(TMA幻灯片)(a,b)和整个幻灯片(c,d)进行自动TIL评分的预后潜力。
整个幻灯片队列中自动TIL评分的性能
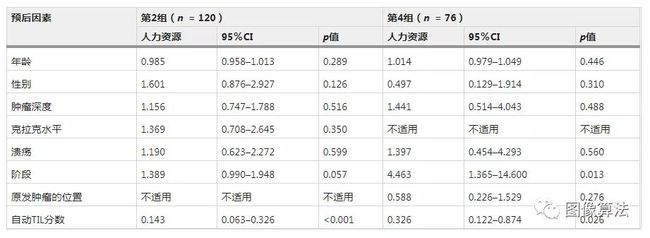
在临床环境中,必须对整个组织切片进行评估。因此,我们将NN192算法应用于群组2和群组4的全幻灯片图像的每个视场。再次eTIL%高,高于16.6%,在两个队列(队列2:对数等级p <0.001;HR = 0.119,CI = 0.057-0.245,图 2c)和队列4中(对数等级p = 0.036;HR = 0.391,CI = 0.157-0.974;图 2d)。所述ETIL%得分即使在调整了性别,年龄,溃疡,阶段(使用组织收集日期的系统并发),布瑞斯罗夫深度,克拉克水平后仍留在两个队列显著,以及原发肿瘤的位置(表 1)。在eTIL%评分方面,我们发现相应的TMA和WSI病例之间存在显着差异,并且重复性较低。
表1关于疾病特异性总体生存率的全滑动队列2和4中eTIL%得分和临床病理因素的多元Cox回归分析。
讨论
尽管早已承认,肿瘤浸润淋巴细胞可能在黑色素瘤提供预后和预测信息,但还没有被广泛用于临床黑素瘤管理采取由于机构间的变异。可变性主要参与者包括分析前和分析步骤,也是最显著,在得分缺乏可重复性的。为了解决主观差异的问题,已经发表了一些研究,提出使用卷积网络对胃癌,乳腺癌,前列腺癌和结肠癌中基于图像的免疫组化(IHC)染色切片进行TIL量化。但是,在这些研究中,TIL量化依赖于IHC标记(例如CD3和CD8)的检测,在某些情况下,还取决于它们相对于肿瘤前缘的定位。在我们以前的工作中,我们显示了CD8检测的数字图像分析与转移性黑色素瘤中的抗PD-1反应相关,但没有预后。此处,eTIL%的预后价值可能来自一系列淋巴细胞的结合以及通过相邻黑素细胞数量的标准化而实现的结合。虽然TIL的亚型可能在免疫疗法的预测中变得很重要,但也需要图像分析,但eTIL%和定量CD8的组合可能是寻找可以在佐剂环境中避免进行免疫疗法的患者的最佳方法。在我们的研究中,我们发现eTIL与CD4,CD8和CD20表达之间存在显着的相关性,并且存在弱公平相关性。可能的解释可能是肿瘤中的免疫异质性,因为未在连续切片上进行HE和CD4,CD8,CD20 IF染色。另一个可能的解释是CD4,CD8,在自动定量荧光研究过程中,CD20和CD20(免疫标记)得分的计算方式不同。关于免疫标志物,以感兴趣标志物阳性细胞的数量相对于其被测量的细胞群的百分比来计算分数,而eTIL%被定义为(TILs / TILs +肿瘤细胞)×100。
TIL的检测可能提供一种经济高效且可靠的预后标志物,尤其是在没有其他分子检测可用的情况下。在Heindl等人的最新研究中,在ER阳性(+)乳腺癌中研究了自动TIL评分的预后潜力。作者在H&E染色切片上对DIA使用了细胞分割分类方法,他们发现DIA获得的免疫空间聚类评分与ER +乳腺癌内分泌治疗后不良的无复发生存有关。在我们的研究中,我们使用了类似的方法,即无监督的核分割,然后进行基于神经网络机器学习的细胞分类。基于分段的对象检测的优势在于,它需要相对较少的训练集。在另一方面,分割的灵敏度和分类的准确性受到生物技术的图像变化,这可能导致过度拟合对于训练集。因此,我们在三个独立的人群中测试了我们算法的性能,这些人群的诊断时间,组织准备时间以及在TMA和全玻片上进行的H&E染色均不同。我们在所有验证集中发现了自动TIL评分的重大预后潜力。
这项工作有很多限制。最重要的是,所有队列均被回顾性收集,包括最早可追溯至1990年代的肿瘤。尽管在免疫治疗之前的治疗在结局方面大致相同,但如临床试验中所见,没有一个队列得到统一治疗。另一个限制是,所有病例都是由一家扫描仪制造商进行扫描的,尽管在不同的机构和放大率下也是如此。虽然软件算法NN192看起来具有同等的性能,但尚不清楚该算法是否会对来自其他扫描仪的图像具有类似的性能。需要进一步的研究来验证该算法在更多独立队列中的预后潜力,并确定图像采集的技术要求。即使这是一个开放源代码的软件,因此可以广泛使用,但在佐剂免疫治疗人群或临床实践中使用eTIL%评分之前,必须进行质量控制和系统的性能评估。在我们的研究中,病理学家对这三种算法进行了质量控制,以对检测到的细胞进行分类。尽管我们在这里没有尝试验证TMA技术,但是值得注意的是,我们发现TMA和整张幻灯片的eTIL%得分之间只有适度的相关性。这可能是由于这样一个事实,即平均黑色素瘤整个玻片上分析的肿瘤面积比TMA点大20–25倍。然而,eTIL%是预后的,与对TMA或整张病例的评分无关。
总之,这项研究表明,自动TIL评分是黑色素瘤的可靠,独立的预后指标。通过验证,我们相信可以在免疫治疗佐剂环境中对该方法进行测试,以定义可能免于接受治疗的患者子集及其显着毒性。
方法
患者队列和组织准备
我们收集了641个黑色素瘤肿瘤,其中包括四个独立的队列,三个来自耶鲁纽黑文医院(YNHH),一个来自哥伦比亚大学欧文医学中心(CUMC)。
训练组队列1由1993年至2005年之间诊断为227例患者,中位随访时间为44个月。
验证集队列2:1999年至2011年之间诊断为137例患者,中位随访时间为59.9个月;
队列3:1981年至2010年之间诊断为201例患者,中位随访时间为79个月;
队列4:76名来自CUMC的患者,在2000年至2012年之间被诊断,中位随访时间为61.5个月(表 2))。
队列1、2和3被评估为组织微阵列(TMA)。病理学家根据H&E染色的载玻片选择代表性的肿瘤区域。在每种情况下都打出重复的芯子(每个直径0.6毫米)。在本研究中,对TMA的H&E染色部分进行了扫描以进行分析。对于队列2和队列4,对原始H&E幻灯片的每个字段进行了评估,得出平均评估面积为7.46 mm 2和5.88 mm 2,而TMA点的平均评估面积为0.28 mm 2。选择由病理学家选择的每位患者完整的载玻片进行研究。
表2患者的临床病理资料。
数字图像分析(DIA)
在队列#1,#2和#3中,使用Aperio ScanScope XT平台以×20的分辨率对载玻片进行数字化处理,像素大小为0.4986 µm×0.4986 µm。在第4组中,使用Aperio ScanScope XT平台以×40的分辨率对载玻片进行数字化处理,像素大小为0.2500 µm×0.2500 µm。
QuPath开源软件平台用于构建自动TIL评分算法。由于H&E染色的日期在各组之间和各组之内都不同,因此我们改进了每个数字化玻片的H&E染色估计(使用QuPath中的“估计染色向量”命令)。
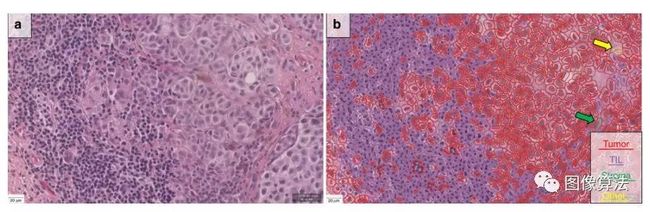
我们使用细胞检测通过以下设置分割图像中的细胞:检测图像:苏木精OD;要求的像素大小:0.5 µm;背景半径:8 µm;过滤器中值半径:0 µm;sigma:1.5 µm;最小单元面积:10 µm 2;最大单元面积:400 µm 2;阈值:0.1; 最大背景强度:2.细胞切片的质量控制由病理学家进行。为了将检测到的细胞分类为肿瘤细胞,免疫细胞(TIL),基质细胞等(错误检测,背景)(图 3),我们使用神经网络32作为具有八个隐藏层(最大迭代次数:100)。分类中使用的功能在补充表2中进行了描述 。为了帮助算法进行准确的分类,我们还添加了半径为25 µm和50 µm的平滑对象特征,以补充单个单元格的现有测量值。为了使训练集达到最佳结果,需要进行多次轮优化,最终以一种名为“ NN192”的算法完成,该算法计算机器定义的TIL的百分比,计算方法如下:(TIL / TIL +肿瘤细胞)×100,称为“ eTIL% ”。病理学家对分类检测到的细胞的算法进行质量控制。在全玻片队列(队列2和队列4)中,对整个肿瘤进行了分析,并根据病理学家的标记进行了定义。
黑色素瘤病例样本的代表性图片,其中显示H&E图像(缩放倍数:×20,a)和数字图像分析(DIA)蒙版(b)。比例尺代表20 µm。使用NN192算法,分割显示红色表示肿瘤细胞,紫色标记免疫细胞,绿色表示基质细胞,黄色表示其他(错误的细胞检测或未知或背景)。由于基质细胞和“其他”细胞很少见,因此包含了大箭头以显示示例细胞。
统计分析
为了进行统计分析,使用了SPSS软件。使用X-tile软件确定TIL分数的统计显着性临界值,该软件使用结果信息定义阈值。χ 2值计算人口的每一个可能的分裂和最佳截止(最高χ 2值)进行交叉验证,以通过使用从训练集得出的切点分析单独的验证集来评估统计显着性。
执行Log-rank检验支持的Kaplan-Meier分析以评估预后潜力,为了测试独立的预后潜力,应用了多元Cox回归分析。疾病特异性总体生存期(DSOS)定义为从肿瘤的初次诊断日期到黑素瘤引起的死亡日期之间的经过时间,或患者因非黑素瘤原因死亡或仍然活着而最后被检查的时间。Mann-Whitney检验用于调查TIL评分与临床病理因素之间的关联。为了测试相应的TMA和有关TIL的全幻灯片案例之间的可重复性,散点图和Wilcoxon符号秩检验支持类内相关性。在所有统计分析中,显着性水平设置为p <0.05。
论文或源码数据集下载地址:关注“图像算法”微信公众号 回复“细胞检测”