摘要:
短链脂肪酸主要是由不可消化的碳水化合物如膳食纤维的细菌发酵产生的。
SCFA的功能: SCFAs 具有非常特殊的功能,作为活性微生物代谢物,能够调节肠道和其他组织中免疫细胞的功能。
对疾病的作用与关系:
最近的研究强调了 SCFAs 在几种自身免疫性和炎症性疾病中的免疫调节潜力,如多发性硬化症、结肠炎、1型糖尿病和类风湿性关节炎。
对T细胞的影响:
SCFAs 通过增强 mTOR 复合物的活性和调节 t 细胞的葡萄糖代谢,诱导 t 细胞的代谢改变。一旦进入 t 淋巴细胞,SCFA 衍生的乙酰基群参与细胞乙酰辅酶 a 池,影响组蛋白乙酰化和细胞因子基因的表达。
本文综述了 SCFAs 如何调节 t 细胞的代谢状态,从而影响表观遗传修饰和 t 细胞功能。我们也将讨论如何从 SCFA 生物学最近的发现可能被用于各种自身免疫性疾病的潜在免疫治疗。
尽管细菌多样性很强,人类肠道微生物群的组成主要由两个门,厚壁菌门和拟杆菌门。
梭状芽孢杆菌和普雷沃特菌等菌门中的优势菌都表达多种酶,这些酶参与短链脂肪酸的生成,短链脂肪酸是肠腔4-6中的一类主要微生物代谢产物。
锻炼脂肪酸的来源:
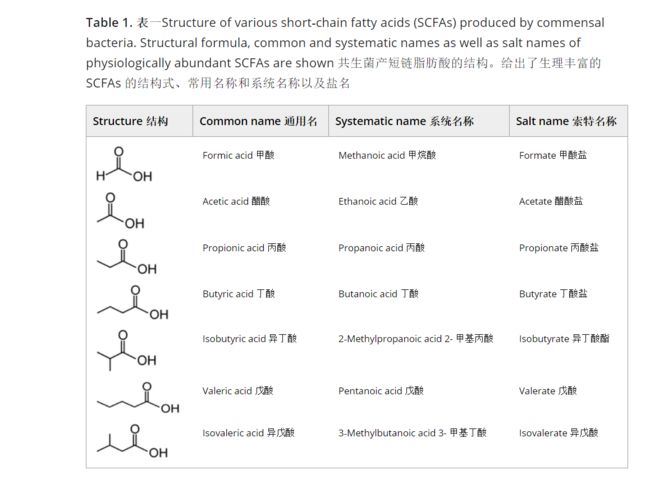
大多数难以消化的复杂多糖,如膳食纤维,能够通过肠粘膜的上半部分,并在盲肠和结肠的厌氧环境中被细菌代谢。SCFAs 是主要由不可消化碳水化合物产生的微生物发酵产物,是一种脂肪尾巴少于六个碳原子的饱和有机酸(表1)。
最丰富的锻炼脂肪酸:哺乳动物肠道中含量最丰富的 SCFAs 是乙酸、丙酸和丁酸。
在人类和啮齿类动物的肠道中检测到:甲酸、戊酸、支链脂肪酸异丁酸和异戊酸等可溶性不饱和脂肪酸。
无菌(GF)动物缺乏肠道微生物群不能降解膳食纤维和产生 SCFAs 。此外,GF 小鼠表现出一些免疫缺陷,如免疫球蛋白(Ig) a 减少,粘膜调节性 t 细胞(Tregs)和 Th17细胞(10-12)的细胞数量减少。
最近的研究阐明了 SCFAs 在结肠 Tregs 扩增、促进 IgA 反应和维持肠耐受中的特异性作用。健康个体的 SCFA 内稳态需要肠腔中大量产生 SCFA 的细菌和持续摄入不可消化的碳水化合物,如膳食纤维。
SCFAs 和受限肠道微生物群的异常产生与几种代谢紊乱、进行性肠道炎症和结肠炎相关的癌变有关。
短链脂肪酸对肠上皮细胞的作用:
一般来说,肠腔内高浓度的 SCFAs 可以通过扩散方式轻易穿过肠上皮,并与固有层免疫细胞的表面分子相互作用。GPR41和 GPR43等 g 蛋白偶联受体(g-protein coupled receptors,GPRs)是主要的 SCFA 受体,能够协调多种信号通路,调节免疫细胞的基因表达。SCFAs 和 GPRs 之间的相互作用可能通过调节 NF-b、 ERK 和 p38丝裂原活化蛋白激酶(MAPK)通路等炎症级联而对宿主有利。
另外,SCFAs 可以通过钠偶联转运蛋白主动地转运到细胞内,甚至被动地扩散到免疫细胞膜18。SCFA 可能通过抑制组蛋白去乙酰化酶(HDAC)活性来调节 t 淋巴细胞核的功能。
因此,SCFAs 是小而活跃的细菌分子,影响我们身体免疫防御的第一道防线。本文就 SCFAs 对 t 细胞免疫代谢和功能的影响作一综述。由于效应 t 细胞参与各种炎症和病理状态,我们也将讨论与预防和减轻自身免疫反应和炎症反应相关的 SCFAs 的潜在治疗能力。
1 对肠上皮细胞的影响:Influence of SCFAs on intestinal regulatory T cells (Tregs)
免疫细胞:
CD4 + t 细胞具有分化为各种效应器亚型的能力,例如 Th1和 Th17细胞,支持细胞介导的宿主对细菌病原体的防御,Th2细胞促进对肠道蠕虫的保护性免疫,Tregs 抑制不良的免疫反应,维持免疫耐受和肠道内环境稳定。
最近在小鼠身上的研究已经证实了 SCFA 产生菌和 SCFAs 在各种 t 细胞介导的炎症条件下作为 t 细胞强有力的调节剂的作用。特别是,不同的共生梭状芽胞杆菌是 SCFA 的高产菌株,在诱导结肠 IL-10产生和扩大粘膜 Tregs 方面发挥重要作用,从而维持肠道内稳态24,27。
SCFA 触发 Tregs 的诱导被认为是通过与 GPR43的相互作用和 HDACs 5的抑制来调节的。有趣的是,GPR43在结肠 Tregs 上的表达明显高于从脾脏或肠系膜淋巴结13纯化的 Tregs,其表达主要依赖于微生物来源的信号。近年来的研究表明,丁酸可能通过抑制组蛋白 H3乙酰化的方式调节 Tregs 的去向。
这使得染色质结构更加宽松,并诱导 Foxp3基因表达。乙酸盐和丙酸盐也能增加肠 Tregs 的出现频率,戊酸盐似乎不能支持 Treg 扩张。
此外,分子机制的研究表明,丁酸能够促进 Foxp3蛋白的乙酰化,从而防止蛋白酶体降解,并提高转录因子的稳定性和活性。乙酰化修饰是蛋白质翻译后最常见的修饰之一。
最近,更长的 PTMs,介导的 SCFAs 作为假定的共基质组蛋白修饰,已被描述28,29。全基因组的组蛋白丙酰化和丁酰化最近被描述为 HeLa 细胞活跃染色质的新标志。有趣的是,特别是在肠道上皮细胞中,微生物群衍生的 SCFAs 能够促进组蛋白巴豆转化(一个四碳单位 PTM) ,从而直接将肠隐窝中基因表达的表观遗传调控与肠道微生物群联系起来。将来可能会在 t 淋巴细胞和其他免疫细胞中发现几种 SCFA 衍生的 ptm。
2 对T细胞代谢的影响 Effects of SCFAs on the immunometabolism of T cells SCFAs
即效应 t 细胞在分化过程中会发生相当大的代谢变化。与代谢活性较低的天真 t 细胞相比,鼠类和人类效应 t 细胞的代谢程序都发生了改变,主要是进行有氧糖酵解(即使在有氧条件下,葡萄糖也能发酵成乳酸盐,沃伯格效应) ,同时也增加了线粒体氧化磷酸化31-34。据认为,t 细胞的代谢改变为调节促炎症和抗炎症免疫反应之间的平衡提供了微调。
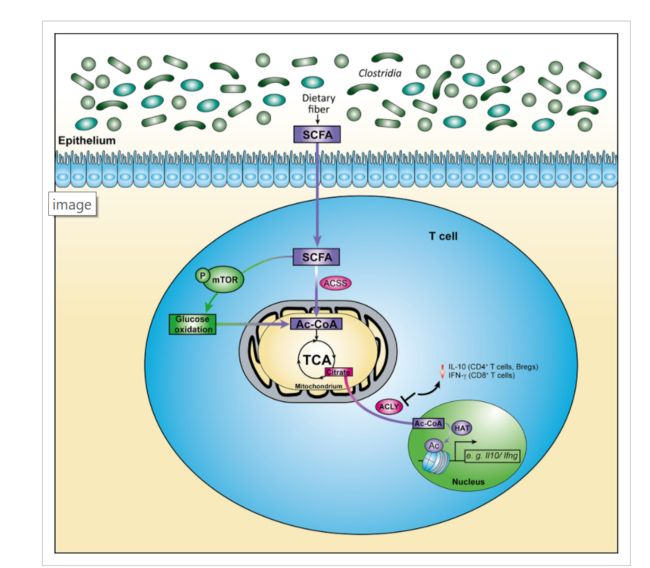
微生物短链脂肪酸与 t 细胞免疫代谢的相互作用。一旦被 t 细胞吸收,细菌 SCFAs 增强 mTOR 复合物的活性,从而增加葡萄糖源丙酮酸转化为乙酰辅酶 a (葡萄糖氧化)。另外,SCFAs 中的乙酰基可以通过乙酰辅酶 a 合成酶(ACSS)连接到辅酶 a 的细胞池中。乙酰辅酶 a 在三元羧酸周期的积累导致柠檬酸盐水平的增加,这是从线粒体输出到细胞质。ATP-柠檬酸裂解酶将柠檬酸转化为乙酰辅酶 a,组蛋白乙酰转移酶用于组蛋白乙酰化和细胞因子基因表达的调控。ACLY 活性的阻断导致淋巴细胞 IL-10和 IFN-的产生减少。
微生物 SCFAs 促进 IL-10的产生5,41,但 SCFA 介导的免疫抑制细胞因子上调的分子机制仍然不清楚。
免疫调节细胞因子 IL-10是由各种淋巴细胞亚群分泌的,它甚至可以与促炎症介质如 IFN-和 IL-17a42同时产生。
T 细胞诱导 IL-10表达对于限制炎症反应和自身免疫是必不可少的。
在效应性 t 细胞中,特别是肠道 Th1细胞特异性的微生物源性抗原上调 IL-10的表达,抑制丁酸盐治疗小鼠结肠炎的发展。机制上,丁酸酯的这种抗炎作用被证明是通过激活肠道 CD4 + t 细胞41,44中的 mTOR 和 Blimp-1介导的。
mTOR 的活性主要受生长因子和氨基酸等细胞营养素的可利用性调节。同样,已知可通过 HDAC 抑制增加组蛋白乙酰化的 SCFAs,似乎能够调节 mTOR 的功能(图1,44,46)。
除丁酸外,戊酸 SCFAs 通过增加 mTOR 复合物的活性、促进葡萄糖氧化和产生额外的乙酰辅酶 a,强烈诱导 IL-10在 t 细胞和调节性 b 细胞中的表达(图1)。
有趣的是,ACLY 的药理抑制,而不是 HDAC 抑制,降低了小鼠 CD4 + t 细胞 IL-10的产生,提示 SCFAs 的代谢输入而不是它们的 HDAC 抑制能力参与了这种作用。此外,SCFA 介导的 IL-10的诱导作用被2- 脱氧葡萄糖(抑制糖酵解)或雷帕霉素(mTOR 抑制)44处理 CD4 + t 细胞减弱。
值得注意的是,即使没有 SCFAs,丙酮酸脱氢酶激酶(PDHK)抑制剂二氯乙酸酯(DCA) ,在小鼠 CD4 + t 细胞中显著增加了乙酰辅酶 a 和 IL-10水平,这表明这种代谢途径对调节 IL-10表达的重要性。
DCA 抑制 PDHK 对丙酮酸脱氢酶(PDH)丝氨酸残基的磷酸化抑制作用。因此,PDH 活性的增加促进葡萄糖衍生的丙酮酸转化为乙酰辅酶 a。有趣的是,体外 DCA 处理小鼠 Th17细胞选择性地抑制 IL-17A 和 ror t 的表达,并增加 Foxp3水平,这表明 PDH 通过将细胞质葡萄糖代谢与线粒体三元羧酸周期48联系起来,调节致病性 Th17细胞和免疫抑制 Tregs 之间的平衡。在 t 细胞中,细菌 SCFAs 可能作为中央真核代谢物乙酰辅酶 a 的前体分子,参与许多细胞过程,包括脂肪酸合成和组蛋白乙酰化。
我们认为 SCFAs 不仅通过 HDAC 抑制和激活 GPR41/GPR43信号级联来调节 t 细胞的命运,而且通过改变 t 细胞的代谢状态和将代谢途径与表观遗传修饰联系起来。
3 在自身免疫性疾病中的治疗潜力 Therapeutic potential of SCFAs in autoimmune diseases
微生物代谢物 SCFAs 与宿主共同进化为活跃的信号分子,具有多种对宿主有益的活性和潜在的治疗能力。
例如,表面受体 GPR109A 对丁酸介导的肠道保护作用至关重要,因为缺乏这种分子的小鼠比野生型(WT)动物更容易发生肠道炎症和结肠炎相关的癌症。
值得注意的是,SCFAs 对人类健康的积极作用也可能包括这些微生物代谢物的系统活性。
高纤维饮食喂养小鼠可以增加循环中 SCFAs 的水平,改善肺部过敏性气道炎症。最近,有研究表明,给老鼠喂食富含阿糖基木聚糖的饮食,这种饮食可以抵抗消化,并通过肠粘膜进入结肠,从而增加醋酸盐和丁酸盐的产量,并保护动物免受1型糖尿病的侵害。此外,SCFAs 在实验性小鼠模型类风湿性关节炎25中减轻了疾病。
在小鼠中,在实验性自身免疫性脑脊髓炎(EAE)的发展过程中,通过对固有层来源的 Tregs 23的长期影响,丙酸多发性硬化症已被证明可以改善疾病的进展。我们的新研究表明,SCFA 戊酸完全抑制了丝状细菌(SFB)47在 GF 小鼠体内的 Th17介导的 EAE 发育。
SFB 是一种共生细菌,已知在小鼠51,52肠道中诱导 Th17反应,并支持 EAE 的进展。这些发现为通过调节微生物群-宿主代谢相互作用来治疗自身免疫性疾病提供了一系列新的机会。值得注意的是,不仅有益的效果与 SCFAs 对宿主生理的影响能力有关。
在一个肾脏疾病的实验模型中,过量的 SCFAs 已被证明促进 t 细胞介导的肾组织炎症与进展性输尿管炎和肾积水。最近的一份报告表明,可溶性膳食纤维的摄入量和 SCFA 丁酸的产生参与了诱导小鼠黄疸性肝细胞性肝癌(HCC)的过程。必须更好地了解微生物代谢物和宿主代谢物之间的功能相互作用,以尽量减少可能的有害副作用,并使 SCFA 能够治疗人类的炎症和自身免疫性疾病。
肠道微生物群、饮食和我们的免疫系统之间的相互作用的复杂机制在过去的几年里已经得到了深入的研究。
未分化的 t 细胞在分化为效应 t 细胞的过程中会发生动态的代谢变化。新的数据表明 SCFAs 将效应 t 细胞的代谢与其表观遗传修饰联系起来。它们可能通过抑制 HDAC 和提供乙酰辅酶 a 来调节细胞因子的表达和 t 细胞功能,乙酰辅酶 a 是 HATs 介导组蛋白乙酰化的供体底物。SCFAs 对许多炎症性疾病的有益作用已被描述。富含 SCFA 的饮食似乎能够抑制 t 细胞介导的自身免疫反应。
在未来,必须了解 SCFAs 是如何融入 t 细胞的免疫代谢的,以便确定特定的代谢目标,可以在治疗上进行处理。未来的研究也可能集中在与其他治疗性抗炎药的联合,以有效地靶向人类免疫病理。