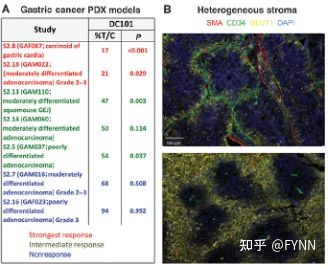
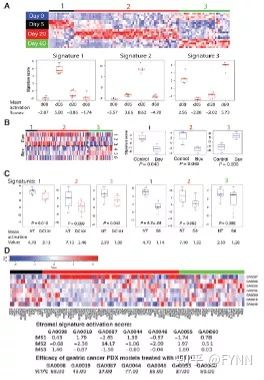
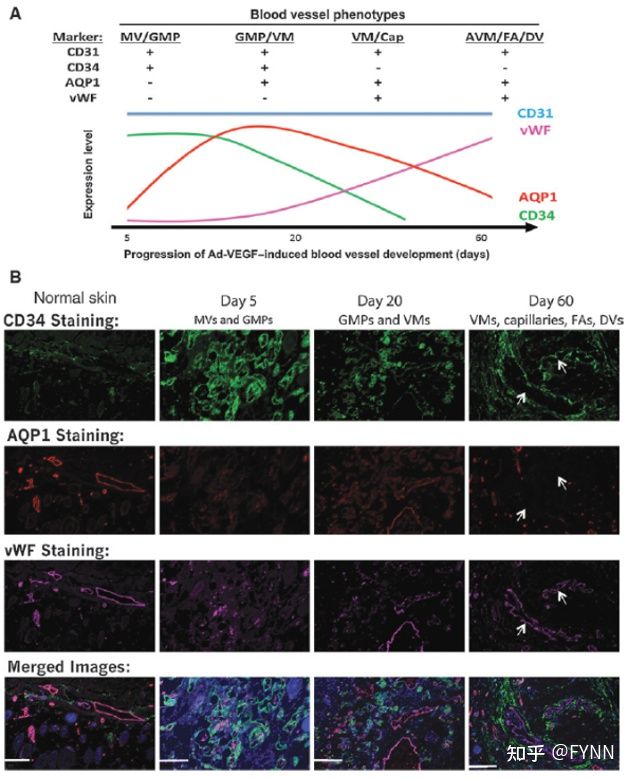
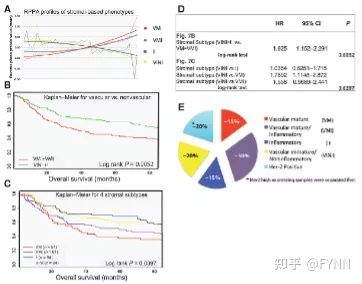
- 发起请求并处理响应:`XHR` 与 `axios` 使用指南来啦[特殊字符]~
又又又要长脑子呐~了解到通过发起HTTP请求并在不刷新页面的情况下更新页面内容是一种常见的需求。学习使用XMLHttpRequest或axios来实现,现在进行对比两者,比较项目使用时候的优缺点,文末使用表格进行对比学习1.使用XHR实现下面是一个使用XMLHttpRequest发起GET请求并处理服务器响应的示例:html体验AI代码助手代码解读复制代码//创建一个新的XMLHttpReques
- Kali系统MSF模块暴力破解MySQL弱口令漏洞
一、实验环境1.攻击方:攻击环境使用KALI系统(使用虚拟机搭建)的Metasploit模块,msfconsole是metasploit中的一个工具,它集成了很多漏洞的利用的脚本,并且使用起来很简单的网络安全工具。这里要特别强调:被攻击的环境必须开启mysql远程登陆服务,通常MySQL开启的端口号是3306,故而一般情况下要求被攻击的服务器开启了3306端口号。2.被攻击MySQL环境:Wind
- 在C#中,可以不实例化一个类而直接调用其静态字段
就是有点傻
C#c#
这是因为静态成员(staticmembers)属于类本身,而不是类的实例。这是静态成员的核心特性1.静态成员属于类,而非实例当用static关键字修饰字段、方法或属性时,这些成员会绑定到类级别,而不是实例级别。它们在类加载时(通常是在程序启动或首次访问时)由CLR(公共语言运行时)分配内存并初始化,与是否创建实例无关。2.为什么不需要实例化?内存分配:静态字段的内存空间在程序运行期间只有一份,所有
- 如何在YashanDB数据库中实现数据查询优化
数据库
在现代信息技术环境中,数据量的快速增长使得数据库的性能优化成为重要课题。如何提升查询速度,降低资源消耗,成为了数据库管理人员和开发者必须面对的挑战。有效的数据查询优化不仅能提高响应时间,还能显著提升用户体验与系统效率。在YashanDB数据库中,优化数据查询需从多个技术角度进行综合考量与实际应用。利用索引技术优化查询索引是提升数据库查询性能的常用手段。在YashanDB中,主要支持BTree索引、
- 如何在YashanDB数据库中管理用户权限
数据库
在数据库管理系统中,用户权限的管理是保障数据安全和系统稳定运行的关键环节。合理的权限控制能有效防止未经授权的访问和误操作,同时满足业务需求的灵活性。对于YashanDB数据库,充分理解其权限体系与管理机制,有助于构建安全、稳定且高效的数据库应用环境。本文将深入解析YashanDB中用户权限管理的技术原理、实现功能和最佳实践。YashanDB的用户与角色机制YashanDB管理权限的核心实体为“用户
- 如何在YashanDB数据库中进行高效的JSON数据存储
数据库
随着业务对非结构化和半结构化数据存储需求的增加,JSON数据类型逐渐成为数据库支持的关键特性。然而,JSON数据的高效存储与访问面临性能瓶颈、一致性保障及空间利用率等挑战。YashanDB作为现代企业级数据库,需提供有效的机制解决上述难题,从而满足实时查询、高并发访问及数据一致性的需求。本文针对YashanDB数据库的体系架构、存储引擎及索引机制,深入分析如何实现高效的JSON数据存储与访问,旨在
- 如何有效管理YashanDB的访问控制
数据库
引言在当今数字化的业务环境中,数据安全性和访问控制是数据库管理的核心问题。随着数据规模的不断扩大,以及对数据隐私和合规性的要求日益增强,如何有效管理数据库的访问权限已成为企业面临的重大挑战。YashanDB作为一个高性能的数据库管理系统,具备丰富的访问控制功能,但同时也带来了复杂的管理需求。本篇文章将深入探讨YashanDB的访问控制机制,包括用户管理、角色权限、身份认证及其他相关策略,旨在为数据
- 如何设计基于YashanDB数据库的高效查询
数据库
在当今数据驱动的业务环境中,提高数据库查询性能已经成为各类企业面临的重大挑战。随着数据量的快速增长,许多机构遭遇了性能瓶颈、数据一致性问题和查询响应延迟等一系列问题。在这样的背景下,优化数据库架构、提高查询效率迫在眉睫。本文将集中在YashanDB数据库的查询设计上,提供技术分析和操作指导,以帮助开发人员设计高效的查询策略,实现优越的性能。YashanDB的体系架构YashanDB支持多种部署形态
- MySQL使用POINT类型+空间索引快速过滤区域
在MySQL中使用POINT类型和空间索引来快速过滤区域数据是一种非常有效的策略,尤其是在处理地理位置信息时。POINT类型是MySQL空间数据类型之一,用来表示二维空间中的点。通过使用空间索引(例如R-tree索引),可以显著提高查询性能,尤其是在处理大量地理数据时。1.创建空间表和空间索引首先,你需要有一个包含POINT类型字段的表,并为这个字段创建空间索引。下面是一个示例:CREATETAB
- 【优秀文章】7月优秀文章推荐
优秀文章智能自主运动体与人工智能技术——环境感知、SLAM定位、路径规划、运动控制、多智能体协同作者:fpga和matlabC++之红黑树认识与实现作者:zzh_zao【手把手带你刷好题】–C语言基础编程题(十)作者:草莓熊Lotso飞算JavaAI:从“码农”到“代码指挥官”的终极进化论作者:可涵不会debug前端网页开发学习(HTML+CSS+JS)有这一篇就够!作者:一颗小谷粒
- 【学习】搭建个人Hexo博客网站
程序员
一、准备环境1、安装node访问Node.js官网:https://nodejs.org/下载LTS(长期支持版本)安装时保持默认选项即可安装完成后,打开命令提示符验证安装:node-v2、安装npmnpm已包含在Node.js安装包中,安装Node.js时会自动安装打开命令提示符验证安装:npm-v更新npm到最新版本(可选):npminstall-gnpm3、安装hexo打开命令提示符,以管理
- 如何为看板产品接入实时行情 API
后端教程观点程序员web3
以下是一个基于Java的完整示例,演示如何通过WebSocket接入InfowayAPI提供的实时行情接口,并展示如加密货币BTC/USDT的实时价格更新。文末附有完整代码。步骤1:准备工作注册账号并申请免费APIKey阅读接入文档(可选)Java环境准备:JDK11+添加jakarta.websocket依赖添加fastjson2依赖(用于构造/解析JSON)步骤2:建立WebSocket连接W
- GitHub账号注册与Git关联:从零到一的完整指南
Android洋芋
前行路黑科技经验历程githubgitGitHub注册Git关联SSH密钥团队协作
简介GitHub是开发者协作与代码管理的核心平台,而Git则是实现版本控制与团队协作的必备工具。本文将从零开始,手把手教你完成GitHub账号注册、Git环境搭建、SSH密钥生成、本地仓库初始化及与GitHub仓库的绑定。通过代码示例、Mermaid图解及企业级应用场景,帮助你全面掌握GitHub与Git的关联技巧,为个人开发与团队协作打下坚实基础。一、GitHub账号注册与基础配置1.1注册Gi
- Flutter 入门
TE-茶叶蛋
Flutterflutter
文章目录前言一、Flutter入门篇1.环境搭建2.Dart语言基础3.第一个Flutter应用4.核心组件与布局5.状态管理(基础)二、Flutter进阶篇1.深度状态管理2.路由与导航3.网络与数据持久化4.动画与自定义绘制5.插件与平台交互6.性能优化7.测试与调试三、高级实战技巧1.架构设计2.跨平台适配3.混合开发4.国际化与无障碍四、学习资源推荐五、学习建议前言以下是一份系统的Flut
- Flutter UI 测试
2401_89317650
flutterui
在Flutter中,UI测试被称作集成测试。Flutter集成测试类似iOS的XCUITest或Android的Expresso一样来执行UI自动化测试。Flutter的集成测试在一个单独的环境运行,可以运行在真实的设备或者模拟器上面。Flutter提供了一个flutter_driver包来编写UI测试。Flutter应用程序的UI测试是如何执行UI测试:FlutterUI测试作为黑盒运行,与主应
- Redis GEO vs MongoDB 地理空间 关键指标对比
方案对比:RedisGEO:优点:性能极快(微秒级)简单易用,支持距离计算缺点:仅支持位置查询,无法直接关联其他属性(如商家类型)需要额外存储详细信息(需要二次查询MySQL或MongoDB)数据同步:需要维护数据一致性(当商家位置更新时,需要同步更新Redis)MongoDB地理空间索引:优点:支持地理位置+属性联合查询(如查找附近且类型为“餐饮”的商家)数据与业务模型存储在一起,避免二次查询提
- Node.js REPL 教程
红衣大叔
nodejs帮助文档node.jsvim编辑器
Node.jsREPL(Read-Eval-PrintLoop)是一个交互式环境,允许你直接输入和执行JavaScript代码,无需创建文件。它是学习Node.js、测试代码片段和调试的强大工具。启动REPL有几种方式可以启动Node.jsREPL:直接运行node命令:node在特定文件目录下启动(如果需要访问当前目录的模块):node使用环境变量(如设置特殊选项):NODE_REPL_HIST
- mysql下载不是运作宝教程_MySQL下载与安装 8.0详细版
喵琛CC
mysql下载不是运作宝教程
MySQL下载与安装一、下载地址:https://dev.mysql.com/downloads/mysql/当前最新是8.0版本,我选择上一个最新的mysql-5.7.24-winx64.zip二、安装MySQL安装文件分两种.msi和.zip,.msi需要安装zip格式是自己解压,解压缩之后其实MySQL就可以使用了,但是要进行环境变量配置zip格式是自己解压我的电脑->属性->高级->环境变
- linux环境中配置中文输入法
王慧-tyger
linuxlinux中文
rpm方式。在安装盘上已经有各种语言包了,我们只需要找到他们,并安装就可以了。中文的是fonts-chinese-3.02-9.6.el5.noarch.rpmfonts-ISO8859-2-75dpi-1.0-17.1.noarch.rpm进入各文件对应目录,运行下面命令:#rpm-ivhfonts-chinese-3.02-9.6.el5.noarch.rpm#rpm-ivhfonts-ISO
- 求平方根:牛顿迭代法
mjfztms
leetcode算法
应用牛顿迭代法求解方程近似解,收敛速度很快牛顿迭代法求解平方根给你一个非负整数x,计算并返回x的算术平方根n,结果只保留整数部分。算法流程图由题意得,n2=xn^2=xn2=x,即为对f(n)=n2−xf(n)=n^2-xf(n)=n2−x求解。第一步:易得:x2−x1=0−f(x1)f′(x1)x_2-x_1=\frac{0-f(x_1)}{f'(x_1)}x2−x1=f′(x1)0−f(x1)
- 利用systemd启动部署在服务器上的web应用
不是吧这都有重名
遇到的问题服务器前端运维
0.背景系统环境:Ubuntu22.04web应用情况:前后端分类,前端采用react,后端采用fastapi1.具体配置1.1前端配置开发态运行(启动命令是npmrundev),创建systemd服务文件sudonano/etc/systemd/system/frontend.service内容如下:[Unit]Description=ReactFrontendDevServerAfter=ne
- Oracle 12C 在线移动datafile 不需要归档模式! 只要在线就行
非归档模式也可以!!!GoalInthisrelease,adatafilecannowbemovedonlinewhileitisopenandbeingaccessed,evenfordatafilesinsystemtablespace.Beingabletomoveadatafileonlinemeansthatmanymaintenanceoperations,suchasmovingd
- SQLite - C/C++编程环境搭建与使用指南
lsx202406
开发语言
SQLite-C/C++编程环境搭建与使用指南引言SQLite是一款轻量级的数据库管理系统,广泛应用于嵌入式系统、移动设备、Web应用等场景。其独特的架构和易用性使其成为许多开发者的首选。本文将详细介绍如何搭建SQLite的C/C++编程环境,并探讨如何在C/C++程序中集成SQLite数据库。环境搭建1.获取SQLite首先,我们需要从SQLite的官方网站(https://www.sqlite
- 如何自定义R语言函数?参数中的省略号`...`有什么用?
「已注销」
python编程语言java人工智能c++
学习R未必要学习很多工具包,有时候根据自己的理解去自定义函数也是一个不错的选择。本篇推文主要介绍两方面的内容:在R语言中自定义函数的一般方法;函数参数中...的作用。在看函数的帮助文档时会发现许多函数的参数中都有...符号,它是表示被省略的参数吗?如果是,作者为什么会省略它?如果不是,那又表示什么含义呢?不久前,学堂君分享了自己编写的计算空间可达性的函数,详见推文:两步移动搜索法(2SFCA)计算
- ViP-LLaVA: 使大型多模态模型理解任意视觉提示
AI专题精讲
Paper阅读多模态人工智能AI
摘要现有的大型视觉-语言多模态模型主要关注整体图像理解,但在实现区域特定的理解方面仍存在显著差距。目前,使用文本坐标或空间编码的方法通常无法为视觉提示提供用户友好的接口。为了解决这个问题,我们提出了一种新颖的多模态模型,能够解码任意(自由形式)视觉提示。这使得用户可以通过自然提示(如“红色边框”或“指向箭头”)直观地标记图像并与模型互动。我们的简单设计直接将视觉标记叠加在RGB图像上,避免了复杂的
- openai-agents记忆持久化(neo4j)
ZHOU_CAMP
oi_agentsagent中的记忆模块neo4jpython开发语言
目录环境安装模型配置Memory配置测试环境安装mem0ai[graph]安装uvpipinstall"mem0ai[graph]"docker启动neo4j数据库dockerrun\-p7474:7474-p7687:7687\-eNEO4J_AUTH=neo4j/password\neo4j:5模型配置fromdotenvimportload_dotenvimportosfromopenaii
- MyBatis Mapper.xml核心属性详解
代码的余温
mybatisxml
在MyBatis的Mapper.xml文件中,statement标签(如、等)包含多个关键属性,用于定义SQL语句的行为和映射规则。以下是核心属性及其含义:一、基础属性id作用:当前命名空间下SQL语句的唯一标识,必须与对应Mapper接口的方法名一致。示例:对应接口方法UsergetUserById(intid)。parameterType作用:指定输入参数的类型(如java.lang.Inte
- 基于高斯两步移动搜寻法(2SFCA)的城市绿地可达性分析
yorov
GIS技巧算法
【2SFCA的基本思路,可以略过】对每个供给点j,搜索所有在j搜寻半径(d0)范围内的需求点(k),计算供需比Rj;对每个需求点i,搜索所有在i搜寻半径(d0)范围内的供【数据】成都市城区绿地数据、各街道小区数据、路网数据OSM【那再来理解一下高斯两步移动搜索法】对于最初的两步移动模型相当于二分,而高斯型相当于是缓慢下降—急速下降—趋于平缓的状态。很像上次莫兰指数里说的空间关系概念化。第一步,对于
- 两步移动搜索法(2SFCA)python
我在北京coding
pythonpython开发语言
实现两步移动搜索法(Two-StepFloatingCatchmentAreaMethod,2SFCA)是一种广泛应用于地理信息系统(GIS)领域的方法,用于评估设施的空间可达性。以下是基于Python和GeoPandas的一种实现方式。准备工作为了实现2SFCA方法,需要准备以下数据集:供给点:表示服务提供方的位置及其服务能力。需求点:表示潜在使用者的位置及其需求量。距离矩阵:描述供给点与需求点
- MCP协议:开发者生态系统的未来基石?
Echo_Wish
Python进阶人工智能大数据
MCP协议:开发者生态系统的未来基石?近年来,随着物联网(IoT)、工业自动化、智能设备互联的爆发式增长,通信协议的标准化成了关键。而MCP(MessageCommunicationProtocol)协议正逐步成为开发者生态的重要成员,它提供了高效、灵活、可扩展的消息通信机制,使得不同设备、服务和系统可以无缝协作。那么,MCP协议究竟有什么优势?开发者应该如何利用它?以及它在当前技术环境中的实际应
- java类加载顺序
3213213333332132
java
package com.demo;
/**
* @Description 类加载顺序
* @author FuJianyong
* 2015-2-6上午11:21:37
*/
public class ClassLoaderSequence {
String s1 = "成员属性";
static String s2 = "
- Hibernate与mybitas的比较
BlueSkator
sqlHibernate框架ibatisorm
第一章 Hibernate与MyBatis
Hibernate 是当前最流行的O/R mapping框架,它出身于sf.net,现在已经成为Jboss的一部分。 Mybatis 是另外一种优秀的O/R mapping框架。目前属于apache的一个子项目。
MyBatis 参考资料官网:http:
- php多维数组排序以及实际工作中的应用
dcj3sjt126com
PHPusortuasort
自定义排序函数返回false或负数意味着第一个参数应该排在第二个参数的前面, 正数或true反之, 0相等usort不保存键名uasort 键名会保存下来uksort 排序是对键名进行的
<!doctype html>
<html lang="en">
<head>
<meta charset="utf-8&q
- DOM改变字体大小
周华华
前端
<!DOCTYPE html PUBLIC "-//W3C//DTD XHTML 1.0 Transitional//EN" "http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd">
<html xmlns="http://www.w3.org/1999/xhtml&q
- c3p0的配置
g21121
c3p0
c3p0是一个开源的JDBC连接池,它实现了数据源和JNDI绑定,支持JDBC3规范和JDBC2的标准扩展。c3p0的下载地址是:http://sourceforge.net/projects/c3p0/这里可以下载到c3p0最新版本。
以在spring中配置dataSource为例:
<!-- spring加载资源文件 -->
<bean name="prope
- Java获取工程路径的几种方法
510888780
java
第一种:
File f = new File(this.getClass().getResource("/").getPath());
System.out.println(f);
结果:
C:\Documents%20and%20Settings\Administrator\workspace\projectName\bin
获取当前类的所在工程路径;
如果不加“
- 在类Unix系统下实现SSH免密码登录服务器
Harry642
免密ssh
1.客户机
(1)执行ssh-keygen -t rsa -C "
[email protected]"生成公钥,xxx为自定义大email地址
(2)执行scp ~/.ssh/id_rsa.pub root@xxxxxxxxx:/tmp将公钥拷贝到服务器上,xxx为服务器地址
(3)执行cat
- Java新手入门的30个基本概念一
aijuans
javajava 入门新手
在我们学习Java的过程中,掌握其中的基本概念对我们的学习无论是J2SE,J2EE,J2ME都是很重要的,J2SE是Java的基础,所以有必要对其中的基本概念做以归纳,以便大家在以后的学习过程中更好的理解java的精髓,在此我总结了30条基本的概念。 Java概述: 目前Java主要应用于中间件的开发(middleware)---处理客户机于服务器之间的通信技术,早期的实践证明,Java不适合
- Memcached for windows 简单介绍
antlove
javaWebwindowscachememcached
1. 安装memcached server
a. 下载memcached-1.2.6-win32-bin.zip
b. 解压缩,dos 窗口切换到 memcached.exe所在目录,运行memcached.exe -d install
c.启动memcached Server,直接在dos窗口键入 net start "memcached Server&quo
- 数据库对象的视图和索引
百合不是茶
索引oeacle数据库视图
视图
视图是从一个表或视图导出的表,也可以是从多个表或视图导出的表。视图是一个虚表,数据库不对视图所对应的数据进行实际存储,只存储视图的定义,对视图的数据进行操作时,只能将字段定义为视图,不能将具体的数据定义为视图
为什么oracle需要视图;
&
- Mockito(一) --入门篇
bijian1013
持续集成mockito单元测试
Mockito是一个针对Java的mocking框架,它与EasyMock和jMock很相似,但是通过在执行后校验什么已经被调用,它消除了对期望 行为(expectations)的需要。其它的mocking库需要你在执行前记录期望行为(expectations),而这导致了丑陋的初始化代码。
&nb
- 精通Oracle10编程SQL(5)SQL函数
bijian1013
oracle数据库plsql
/*
* SQL函数
*/
--数字函数
--ABS(n):返回数字n的绝对值
declare
v_abs number(6,2);
begin
v_abs:=abs(&no);
dbms_output.put_line('绝对值:'||v_abs);
end;
--ACOS(n):返回数字n的反余弦值,输入值的范围是-1~1,输出值的单位为弧度
- 【Log4j一】Log4j总体介绍
bit1129
log4j
Log4j组件:Logger、Appender、Layout
Log4j核心包含三个组件:logger、appender和layout。这三个组件协作提供日志功能:
日志的输出目标
日志的输出格式
日志的输出级别(是否抑制日志的输出)
logger继承特性
A logger is said to be an ancestor of anothe
- Java IO笔记
白糖_
java
public static void main(String[] args) throws IOException {
//输入流
InputStream in = Test.class.getResourceAsStream("/test");
InputStreamReader isr = new InputStreamReader(in);
Bu
- Docker 监控
ronin47
docker监控
目前项目内部署了docker,于是涉及到关于监控的事情,参考一些经典实例以及一些自己的想法,总结一下思路。 1、关于监控的内容 监控宿主机本身
监控宿主机本身还是比较简单的,同其他服务器监控类似,对cpu、network、io、disk等做通用的检查,这里不再细说。
额外的,因为是docker的
- java-顺时针打印图形
bylijinnan
java
一个画图程序 要求打印出:
1.int i=5;
2.1 2 3 4 5
3.16 17 18 19 6
4.15 24 25 20 7
5.14 23 22 21 8
6.13 12 11 10 9
7.
8.int i=6
9.1 2 3 4 5 6
10.20 21 22 23 24 7
11.19
- 关于iReport汉化版强制使用英文的配置方法
Kai_Ge
iReport汉化英文版
对于那些具有强迫症的工程师来说,软件汉化固然好用,但是汉化不完整却极为头疼,本方法针对iReport汉化不完整的情况,强制使用英文版,方法如下:
在 iReport 安装路径下的 etc/ireport.conf 里增加红色部分启动参数,即可变为英文版。
# ${HOME} will be replaced by user home directory accordin
- [并行计算]论宇宙的可计算性
comsci
并行计算
现在我们知道,一个涡旋系统具有并行计算能力.按照自然运动理论,这个系统也同时具有存储能力,同时具备计算和存储能力的系统,在某种条件下一般都会产生意识......
那么,这种概念让我们推论出一个结论
&nb
- 用OpenGL实现无限循环的coverflow
dai_lm
androidcoverflow
网上找了很久,都是用Gallery实现的,效果不是很满意,结果发现这个用OpenGL实现的,稍微修改了一下源码,实现了无限循环功能
源码地址:
https://github.com/jackfengji/glcoverflow
public class CoverFlowOpenGL extends GLSurfaceView implements
GLSurfaceV
- JAVA数据计算的几个解决方案1
datamachine
javaHibernate计算
老大丢过来的软件跑了10天,摸到点门道,正好跟以前攒的私房有关联,整理存档。
-----------------------------华丽的分割线-------------------------------------
数据计算层是指介于数据存储和应用程序之间,负责计算数据存储层的数据,并将计算结果返回应用程序的层次。J
&nbs
- 简单的用户授权系统,利用给user表添加一个字段标识管理员的方式
dcj3sjt126com
yii
怎么创建一个简单的(非 RBAC)用户授权系统
通过查看论坛,我发现这是一个常见的问题,所以我决定写这篇文章。
本文只包括授权系统.假设你已经知道怎么创建身份验证系统(登录)。 数据库
首先在 user 表创建一个新的字段(integer 类型),字段名 'accessLevel',它定义了用户的访问权限 扩展 CWebUser 类
在配置文件(一般为 protecte
- 未选之路
dcj3sjt126com
诗
作者:罗伯特*费罗斯特
黄色的树林里分出两条路,
可惜我不能同时去涉足,
我在那路口久久伫立,
我向着一条路极目望去,
直到它消失在丛林深处.
但我却选了另外一条路,
它荒草萋萋,十分幽寂;
显得更诱人,更美丽,
虽然在这两条小路上,
都很少留下旅人的足迹.
那天清晨落叶满地,
两条路都未见脚印痕迹.
呵,留下一条路等改日再
- Java处理15位身份证变18位
蕃薯耀
18位身份证变15位15位身份证变18位身份证转换
15位身份证变18位,18位身份证变15位
>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>
蕃薯耀 201
- SpringMVC4零配置--应用上下文配置【AppConfig】
hanqunfeng
springmvc4
从spring3.0开始,Spring将JavaConfig整合到核心模块,普通的POJO只需要标注@Configuration注解,就可以成为spring配置类,并通过在方法上标注@Bean注解的方式注入bean。
Xml配置和Java类配置对比如下:
applicationContext-AppConfig.xml
<!-- 激活自动代理功能 参看:
- Android中webview跟JAVASCRIPT中的交互
jackyrong
JavaScripthtmlandroid脚本
在android的应用程序中,可以直接调用webview中的javascript代码,而webview中的javascript代码,也可以去调用ANDROID应用程序(也就是JAVA部分的代码).下面举例说明之:
1 JAVASCRIPT脚本调用android程序
要在webview中,调用addJavascriptInterface(OBJ,int
- 8个最佳Web开发资源推荐
lampcy
编程Web程序员
Web开发对程序员来说是一项较为复杂的工作,程序员需要快速地满足用户需求。如今很多的在线资源可以给程序员提供帮助,比如指导手册、在线课程和一些参考资料,而且这些资源基本都是免费和适合初学者的。无论你是需要选择一门新的编程语言,或是了解最新的标准,还是需要从其他地方找到一些灵感,我们这里为你整理了一些很好的Web开发资源,帮助你更成功地进行Web开发。
这里列出10个最佳Web开发资源,它们都是受
- 架构师之面试------jdk的hashMap实现
nannan408
HashMap
1.前言。
如题。
2.详述。
(1)hashMap算法就是数组链表。数组存放的元素是键值对。jdk通过移位算法(其实也就是简单的加乘算法),如下代码来生成数组下标(生成后indexFor一下就成下标了)。
static int hash(int h)
{
h ^= (h >>> 20) ^ (h >>>
- html禁止清除input文本输入缓存
Rainbow702
html缓存input输入框change
多数浏览器默认会缓存input的值,只有使用ctl+F5强制刷新的才可以清除缓存记录。
如果不想让浏览器缓存input的值,有2种方法:
方法一: 在不想使用缓存的input中添加 autocomplete="off";
<input type="text" autocomplete="off" n
- POJO和JavaBean的区别和联系
tjmljw
POJOjava beans
POJO 和JavaBean是我们常见的两个关键字,一般容易混淆,POJO全称是Plain Ordinary Java Object / Pure Old Java Object,中文可以翻译成:普通Java类,具有一部分getter/setter方法的那种类就可以称作POJO,但是JavaBean则比 POJO复杂很多, Java Bean 是可复用的组件,对 Java Bean 并没有严格的规
- java中单例的五种写法
liuxiaoling
java单例
/**
* 单例模式的五种写法:
* 1、懒汉
* 2、恶汉
* 3、静态内部类
* 4、枚举
* 5、双重校验锁
*/
/**
* 五、 双重校验锁,在当前的内存模型中无效
*/
class LockSingleton
{
private volatile static LockSingleton singleton;
pri