BP:基于静息态功能连接生物标志物的四种阿尔茨海默病亚型
摘要
背景:阿尔茨海默病(AD)是一种具有显著异质性的神经退行性疾病。不同的AD表型可能与特定的脑网络的改变有关。利用功能网络揭示疾病的异质性可以为精确诊断提供见解。
方法:我们使用非负矩阵分解聚类,对先前确定的AD和正常对照之间的216个不同的静息态功能连接,研究了AD的亚型。我们使用发现数据集(n = 809)和验证数据集(n = 291)进行了分析。接下来,我们根据在AD组中获得的模型对患有轻度认知障碍的个体进行分组。最后,比较各亚型之间的临床测量和脑结构特征,以评估它们与功能网络差异的关系。
结果:AD患者可重复地聚集成四个亚型,其中包括一个弥漫和轻度功能连接中断(亚型1),另一个主要是减少连接默认模式网络伴随着前额叶连接增加的亚型(亚型2),第三个主要表现为前扣带皮层连接减少并伴随着前额叶皮层连接增加的亚型(亚型3),和最后一个基底神经节连接减少伴随着前额叶皮层连接增加的亚型(亚型4)。除了这些在功能连接上的差异外,AD亚型之间在认知、结构测量和认知衰退模式方面也存在差异。
结论:这些全面的结果提供了新的见解,可能推进AD的精确医疗,并为未来的临床试验提供策略。
关键词:阿尔茨海默病;异质性;非负矩阵分解;功能连接;亚型;轻度认知障碍
1.引言
阿尔茨海默病(AD)是一种神经退行性疾病,在其临床特征、影像学特征、病理和疾病进展等方面均表现出表型异质性。AD的典型临床表现是最初的遗忘为主的损伤,早期主要分布在内侧颞叶神经纤维缠结病理;异常的AD亚型的tau蛋白病理空间模式和认知衰退方面存在差异。根据目前基于生物标志物的诊断标准进行评估,异常表型可能导致更多的误诊和延迟诊断。此外,不同的病理模式可能会影响治疗反应,不同的亚型可能有不同的认知能力下降的轨迹,这可能会影响临床试验。因此,需要对AD的异质性进行研究,以揭示控制各种表型的方法,并进一步有助于个性化医疗。
根据尸检和体内的神经生物学特征,对AD的异质性进行了研究。在一些大规模的尸检研究中,神经纤维缠结主要位置不同的AD患者被分为三种亚型,如边缘优势型、海马保留型和典型型。基于结构磁共振成像(MRI)、弥散张量成像和氟脱氧葡萄糖正电子发射断层扫描(FDG-PET)发现的体内萎缩模式,也对具有不同损伤模式和认知特征的异常亚型进行了研究。使用tau-PET和淀粉样PET也发现了神经病理的异常扩散模式。然而,与认知密切相关的功能网络的异质性尚未得到很好的研究。
在AD中观察到静息态功能网络的广泛破坏,这表明神经元丢失区域不仅存在局部功能活动损伤,而且还存在整体网络损伤。更重要的是,tau蛋白模式的变异与功能网络相一致,tau蛋白和淀粉样蛋白-β(Aβ)负担的传播与功能连接的改变有关,这表明功能脑网络参与了AD的异质性神经生物学。在AD萎缩亚型中也报道了功能网络特性的不同改变,但研究结果仅限于解剖亚型,并不能提供对AD的异质性功能网络的全面理解。我们之前使用了一个大型的多中心数据集,显示了AD患者和正常对照组(NCs)之间不同的216个功能连接,我们的结果显示,这些连接可以用于准确区分具有高泛化性的AD患者。这些功能标注也显示了一种聚类模式,激励我们继续研究不同的功能亚型是否与AD中的特定网络模式相关。
在本研究中,我们直接研究了AD中功能网络发生异质性改变的假设,这种异质性可以解释认知障碍和结构改变的变化。为了检验这些假设,我们应用非负矩阵分解(NMF)聚类来识别AD和轻度认知障碍(MCI)的功能亚型,使用两个多中心的大样本数据集,并进一步研究了这些亚型之间的功能连接、大脑结构和临床认知能力的差异(图1)。
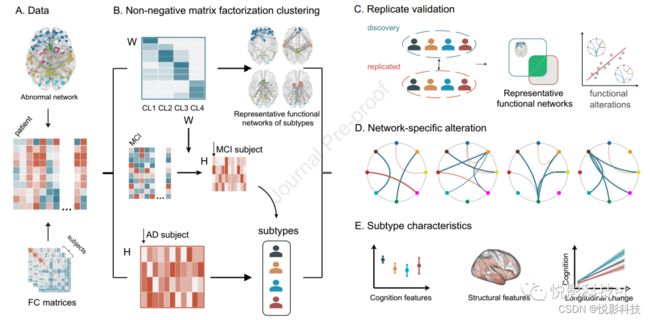
图1.异质性分析流程示意图。(A)所使用的数据是基于由脑网组图谱构建的功能连接矩阵和先前研究中构建的异常功能连接指数。(B)在AD患者中,应用NMF同时识别特征簇和被试。顶部:每一行代表一个功能连接,每一列都是一个功能连接集群。颜色越饱和,功能连接对功能连接集群的贡献就越大。AFN内的功能连接聚为四个功能连接集群,可以用RFN表示。底部:每一列代表一个被试,颜色越饱和,该RFN对被试AFN的贡献就越大。根据RFN的最小贡献,将AD患者聚为不同的亚型。中:根据AD患者的聚类特征对MCI个体进行分配。©在一个独立的数据集上复制分析,以验证亚型的重现性,比较了两个数据集之间亚型的RFN和与亚型相关的变化。(D)通过比较AD亚型患者和NCs患者,研究了这些亚型的网络特异性改变。(E)采用统计分析,包括临床测量比较、区域结构特征比较和认知下降轨迹,以揭示该亚型的特征。
2. 材料和方法
2.1 被试
我们首先从多中心阿尔茨海默病成像联盟数据集(MCADI)中确定了AD患者的亚型,该数据集作为一个发现数据集(AD:n = 295,MCI:n = 257,NC:n = 257)。来自阿尔茨海默病神经成像倡议(ADNI)数据集的291名被试(AD:n = 82,MCI:n = 93,NC:n = 116)作为一个独立的验证集。
2.2 图像采集、预处理和聚类特征的定义
在发现数据集中,个体在7种不同的MRI扫描仪中的一种上进行扫描,以获得T1加权图像和静息态功能图像。在ADNI数据集中,T1加权图像和静息态功能图像在每个站点使用标准化协议进行扫描。
使用CAT12工具箱中的标准步骤对结构性MRI图像进行预处理,并根据脑网组图谱提取每个脑区域的区域灰质体积和皮质厚度。采用ComBat协调,以年龄、性别和临床诊断,去除站点效应,将MCADI和ADNI的数据作为协变量。
使用脑网络组工具包对MCADI和ADNI的功能MRI(fMRI)扫描结果进行预处理。经过质量控制后,我们通过对该区域中包含的所有体素的fMRI信号进行平均,得到了263个区域中每个区域的区域fMRI信号。
每个个体的功能连接是通过所有对263个区域之间的皮尔逊相关系数来测量的。然后,216个异常功能连接来自我们之前研究的MCADI数据中的前6个数据点的荟萃分析,直接作为聚类特征,称为异常功能网络(AFN)。接下来,将ComBat协调应用于聚类特征,以减少与年龄、性别和临床诊断分别作为MCADI和ADNI的协变量的部位效应。
2.3 采用非负矩阵分解方法进行聚类分析
为了研究AD亚型,我们使用NMF基于患者组中AFN中的功能连接进行了聚类分析(图1B)。NMF作为一种数据驱动的双聚类方法,允许根据数据库中特征聚类的权重同时识别特征聚类(如功能连接)和个体聚类,这意味着我们可以获得功能连接聚类和权重为每个个体提供的每个功能连接集群。我们根据每个聚类的前20%加权功能连接度对每个特征聚类进行特征化,称为参考功能网络(RFN)来表示功能连接聚类。由于AD与功能功能障碍和断开机制相关,根据被试在AFN内的功能连接的最小权重(最高断开)将被试分为亚型。为了获得MCI中相应的亚型,我们使用拟合的AD 的NMF模型对MCI的功能连接数据进行分解。
我们通过评估共相关系数、轮廓系数和残差平方和(RSS)的变化来确定最优聚类数量。我们在R中实现了基于NMF软件包的NMF算法。
2.4 统计分析
采用适当的方差分析和/或双样本t检验来确定每个AD亚型和NCs在功能连接、认知和结构特征上的差异(P < .05)。我们分别比较了每个数据集的子类型之间的功能连接,其他临床特征也在数据集之间进行了z转换和合并。接下来,我们使用ADNI数据集中的3年随访数据,分析了AD亚型之间认知测量的纵向变化。采用线性回归模型来评估亚型间纵向变化的差异。模型包括基线随访月数、亚型、年龄、性别、月份和亚型的交互项(P < .05)。最后,比较脑网组图谱中不同区域的灰质体积和皮质厚度,以阐明功能亚型和结构亚型之间的关系。上述比较是在控制了性别、年龄、站点和总颅内容积(仅在结构特征上)后进行的。
3 结果
3.1 在AD中发现的四种亚型
根据MCADI和ADNI中的共相关系数、轮廓系数和和RSS变化,4个聚类均表现出最佳拟合。
图2A显示了每个子类型的RFN(即占功能连接集群前20%的功能连接),表示两个数据集中每个子类型的特定网络(也见图S3)。值得注意的是,这两个结果显示出相似的模式,MCADI的RFNs与ADNI之间的Dice系数分别为0.72、0.76、0.72和0.88(图2B)。为了精确地描述特定的网络,我们通过提取两个结果的交点,得到了每个亚型的复合RFN(图2C)。亚型1与前额叶和广泛的额顶枕网络特异性相关。亚型2与内侧前额叶、内侧颞叶、海马体和顶叶的功能连接明显相关;这些区域与默认模式网络(DMN)的区域相似。亚型3的特征是连接前扣带皮层(ACC)与其他区域的功能连接,特别是顶叶、基底神经节和枕叶。亚型4的RFN顶部功能连接,其连接基底神经节(主要在双侧尾状背侧)与小脑、枕叶、颞叶和丘脑。亚型在不同的脑图谱,控制头部运动,有无站点协调中都是可重复的。
3.2 AD患者亚型的功能特征
与NCs相比,个体聚类结果显示,不同亚型的患者存在复杂的功能连接性损伤,这与多个RFN相关。与NCs相比,亚型1的AFN改变呈轻度和弥漫性减少,而其他亚型的前额叶改变增加(主要是亚型1的RFN),主要是特定的不同连接减少(图2D)。在ADNI数据中也发现了类似的功能连接模式的改变。此外, AD患者改变的连接强度(t值)显示显著相关性在MCADI和ADNI数据集(亚型2、3和4的皮尔逊相关系数分别为r = 0.71,0.67,0.84)(图2E),这一发现表明,结果是可重复的。由于聚类在两个数据集中显示出相似的特征,因此我们在数据集中汇集了每个亚型的被试以进行进一步分析。
图2F显示了不同亚型中RFN的平均功能连通性的具体变化。结果显示,如上所述(图2D),在亚型中可以识别出网络特异性的改变,并且在RFN中存在亚型特异性的改变。简而言之,与每个亚型相关的RFN的平均功能连接明显弱于与其他亚型相关的RFN。
图2. AD的功能分型结果。(A)4个亚型的RFN的说明。较大的大脑代表来自MCADI数据集的结果,而右边较小的大脑代表来自ADNI的结果。大脑中该节点的大小代表了与该节点相连的异常连接的相对数量。(B)在两个数据集之间的再现性。热图显示了两个数据集中4个RFN之间的空间相似性的Dice系数。©复合RFN的表征。复合RFN来自于两个数据集的结果的交集。(D)与NCs相比,4种亚型的AFN内的变化,其中较大的圆圈代表MCADI的结果,而右边较小的大脑代表ADNI的结果。圆形图中的条带颜色对应于脑节点的颜色,连接颜色代表AD患者与NCs之间的t检验得到的t值。(E)散点图显示了两个数据集中AD患者与异常网络内的比较得出的无阈值t值之间的关系,相关性越高,说明两个数据集之间AD改变模式越相似。(F)4种AD亚型的4个复合RFN的平均功能连接,以NCs的平均功能连接为参考(误差条代表标准误差)。
3.3亚型的人口统计学和认知特征
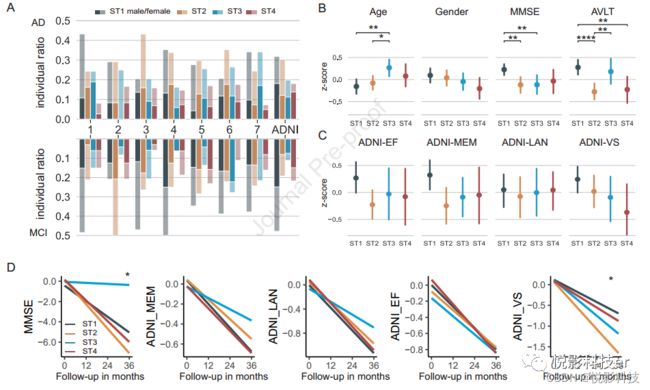
图3A显示了每个站点的亚型比例;每个站点包括4个亚型,每个亚型都包括男性和女性的AD患者。MCADI中7个部位的亚型分布显示,在发现数据集中,90例患者分为亚型1, 94例患者分为亚型2, 70例患者分为亚型3, 41例患者分为亚型4。在ADNI中,分配到四个簇的样本数量分别为27、26、14和15个。
图3B显示了功能定义的AD亚型显示出人口统计学和认知差异。不同亚型的年龄不同(F = 4.45,P = .004),亚型3的被试年龄大于亚型1(P < .001)、亚型2(P = .007)或亚型4(P = .25)。所有亚型的女性比例相似(P = .24)。亚型1患者的小型精神状态检查(MMSE)评分(F = 4.71,P = .003)高于亚型2(P = .001)、亚型3(P < .001)或亚型4患者(P = .026)。此外,在控制了年龄、性别和站点后,亚型1的MMSE和RFN的平均功能连接有显著的皮尔逊相关性(r=-0.16,P=0.006)。亚型2和亚型4在听觉语言学习测试(AVLT)(F = 5.55,P = .002)中单词学习能力表现差于亚型1(分别为P < .001和P = .007)和亚型3(分别为P = .011和P=.055)。除了总体认知能力外,在ADNI数据集中的复合认知得分的方差分析模型中没有显著的发现。亚型1在数值上表现出最好的执行、记忆和视觉空间功能(ADNI-VS)功能,而亚型4在数值上表现出最差的视觉空间功能(图3C)。有趣的是,四种AD亚型在认知能力衰退进展方面表现出差异。虽然亚型1在基线时有更好的认知能力,但只有缓慢的ADNI-VS下降,其他认知下降轨迹与亚型4相似。亚型2的MMSE和ADNI-VS下降最快,亚型3较MMSE的其他3种亚型下降最慢(图3D)。
此外,MCI基于AD亚型模式进行了聚类(图3A)。MCI亚型表现出与AD相似的特征。
图3. AD亚型的特征。(A)AD和MCI亚型在MCADI和ADNI的7个数据点上的分布。(B)比较两个数据集中不同亚型之间的共同人口统计学和认知特征。©在ADNI数据集中的各亚型之间的综合分数的比较。(D)在ADNI中,认知能力的纵向变化。这些图表说明了从基线到36个月随访的回归线,“*”表示亚型间下降率的显著差异。
3.4 AD患者亚型的结构特征
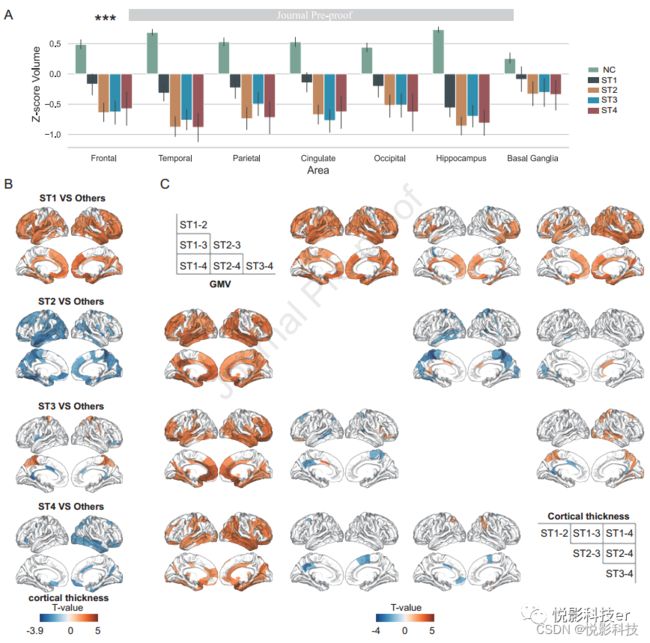
不同亚型的额叶、颞叶、顶叶、枕叶和扣带皮层的灰质体积均有差异(所有Ps < .05,Bonferroni校正),但Bonferroni校正后枕叶、海马和基底神经节的体积无显著差异。图4A显示了平均灰度体积,说明亚型1在4个亚型中体积最大,但其他3种亚型的差异很小。
图4B显示了皮质厚度比较,图4C显示了未校正的成对比较,以显示亚型之间的微小差异。与其他亚型相比,亚型1最大的皮质厚度最大的区域,包括额叶,颞叶,扣带回,以及更多的灰质体积在皮层下区域,包括丘脑、海马和基底神经节(P <.05,错误发现率(FDR)修正)。亚型2的皮质厚度最小,主要分布在楔前叶、梭状回、眶回和左侧颞中回(P <.05,FDR校正)。亚型3有较大的皮质厚度在旁中央小叶和楔前叶,以及扣带皮层前部和腹侧的体积较小(P <.05,FDR校正)。亚型4的皮质厚度相对较低,主要分布在右侧扣带皮层、右侧颞中回、右侧眶回和右侧枕叶皮层(P <.05,FDR校正)。
图4. AD各亚型间的结构特征分析。(A)柱形图显示了亚型和NCs的区域平均z分数体积。与NCs相比,所有脑区的灰质体积(GMV)均显著减少(P < .001);星形表示不同亚型之间的方差分析的P值。(B)通过将一种亚型与其他亚型(图中的“其他”)进行比较,以证明其亚型特异性的解剖特征。©左下区域为GMV的两对比较,右上区域为皮质厚度结果。
4. 讨论
据我们所知,这是第一次努力利用AD患者的大型静息态功能磁共振成像生物样本库来识别精确的功能网络特异性亚型。我们的结果提供了一致的证据,即4个AD亚型来自于两个独立数据集的异常功能连接数据。更重要的是,这四种亚型不仅在功能表型上存在差异,而且在认知能力和空间萎缩模式上也存在差异。这些发现为AD患者功能连接的异质性提供了支持性证据。
有一个普遍的共识是,AD的神经生物学是异质性的,并且基于大规模脑萎缩的可用性,病理生理学、神经病理学、认知或生物学数据集支持疾病的异质性。由于缺乏广泛的多中心研究,直到之前的多中心可重复性研究进行之前,衍生的功能网络的改变仍然没有得到很好的研究。基于一项大型分析,Jin等人通过聚类AFN中改变的功能连接,提供了AD中广泛存在的连接障碍的全面图片。在这里,我们通过研究AD内部的疾病异质性,进一步扩展了这项工作。我们的发现显示至少四个不同的,可重复的改变模式的功能连接,包括一个弥散的和轻度的功能连接中断(亚型1),另一个DMN功能连接减少和前额叶连接增加占主导地位(亚型2),第三个ACC功能连接减少前额叶连接增加主导(亚型3),和最后基底神经节的功能连接减少和增加前额叶连接主导(亚型4)。由于RFN的平均强度、脑萎缩模式和纵向认知变化的趋势特别具有亚型特异性,我们的研究结果表明,不同的功能亚型可能与不同的治疗监测框架相关。
大脑网络科学为阿尔茨海默病中大脑如何工作和功能障碍提供了新的见解。DMN在AD中优先被破坏,它不仅与各种认知功能和情景记忆有关,还与淀粉样蛋白沉积有关。我们的研究表明,这些主要的与DMN相关的改变似乎反映了AD个体的一个亚组(约31%),而其他亚组则表现出不同类型的改变。前扣带回在AD早期表现为退化,它解释了情绪处理和认知控制调节的各种功能改变的下降(亚型3)。亚型4表现出与基底神经节相关的特异性改变,这对正常的大脑功能至关重要,包括运动、认知和情绪处理。更重要的是,一些研究一致发现,随着AD和年龄的增长,额叶内的功能连接会发生越来越多的改变。虽然这种增加的改变被假设为是一种补充机制,但这一现象的潜在机制尚不清楚。我们的研究结果显示,前额叶连接与认知之间呈负相关,表明前额叶活动的升高可能伴随着严重的功能中断。
通过功能连接确定的亚型也反映了相当大的神经生物学和临床异质性。亚型1的个体有弥漫性和轻度的功能连接中断、结构性萎缩和整体认知能力下降,这表明该亚型有最轻微的病理变化,与被称为轻度萎缩性亚型发生的情况相似。亚型2具有最广泛的结构变薄和最差的认知能力,因此它与AD的“典型”亚型相似,后者基于神经纤维缠结。亚型3的前扣带回和腹侧扣带皮层萎缩更严重,但旁中心小叶和楔前叶体积更大,单词学习能力(AVLT),MMSE评分下降最慢,海马体体积相对较大。在tau-PET研究中,亚型3具有被认为是后皮质萎缩(PCA)。这种异常的功能损伤部分解释了PCA中认知特征的损伤,例如,低视觉空间能力和高词汇学习能力。亚型4双侧尾状核与枕叶、顶叶与小脑的连接严重功能障碍;右侧视觉皮层体积减少,AVLT和ADNI-VS水平降低,与皮质基底综合征的某些特征相对应。我们的研究结果显示,脑网络的异质性在AD中表现为一个连续体,而异常的临床变异可能代表了AD连续体中的极端情况。最后,虽然我们的亚型没有与以前的亚型研究显示出一对一的对应关系,但有趣的是,我们的功能亚型也有一个二维框架:亚型1和亚型2似乎与严重程度轴一致,而亚型3和亚型4似乎与典型性轴一致。
在MCI中发现亚型分裂提供了关于痴呆前阶段条件的额外信息。在这两个数据集中,近45%的MCI被试根据AD参数被划分为最轻度的损伤亚型。这一发现是合理的,因为轻度MCI患者通常有轻微的功能改变和认知障碍。此外,它还证明了我们的模型不仅捕获了关于AD严重程度的信息。重要的是,MCI被试表现出与AD患者相似的功能连接和认知差异模式,这表明在AD早期存在异常的网络异质性。没有发现明显的认知分化,这表明尽管在MCI阶段存在宏观水平的同质性,但仍存在潜在的功能异质性。
需要强调的是,我们的发现是高度可靠的和可重复性的。该异常网络来源于一项可靠的多中心大型分析研究,与DMN、突显网络、执行网络和几个皮层下区域重叠。这些亚型的RFN来自于AFN,通过使用NMF研究被试之间的功能连接的连贯模式。在两个完全独立的数据集中发现了4个高度一致的RFN和3个高度相关的功能改变模式,这表明这些模式反映了AD亚组之间的生物学差异。还需要注意的是,两个数据集之间的亚型1的不相关损伤可能归因于轻微的和非特异性的损伤。此外,RFN和亚型在应用于不同的分割模式时是稳定的,无论有无头部运动控制,有无站点协调都是稳定的。
这项研究有几个局限性。首先,目前的方法不能完全预防疾病严重程度造成的混杂效应,未来需要用纵向数据来验证这些混杂信息。第二,MCADI中的个体缺乏病理资料。因此,我们只在ADNI中选择了Aβ阳性个体来减少这一问题的影响,我们的高可重复性结果可能表明非AD因素的影响很小。第三,纵向数据的样本量仍然相对较小。未来的研究将有大样本量,将包括更多的神经生物学数据(即Aβ和/或tau蛋白成像数据)也需要验证功能网络差异和AD特异性疾病过程之间的关系。第四,ComBat在fMRI数据上进行了验证,但没有普遍应用,这表明我们不能完全预测协调过程中功能连接的变化。此外,扫描仪之间的变异尚不清楚;这种变化也可能导致两个数据集之间亚型1的不相关变化模式,这应该使用更多的数据集进行验证。最后,需要研究功能亚型与其他模态亚型(即神经原纤维缠结和结构和PET)之间的关系,以系统地揭示AD的异质性。
总的来说,本研究利用世界上最大的两个AD静息态功能磁共振成像生物样本库,全面描述了AD相关的脑功能亚型。在AD和MCI个体的这些功能亚型中都发现了特定的功能连接、认知功能和脑结构特征。这些全面的发现突出了识别可重复和可泛化的脑功能性亚型的潜力,这有助于识别预后标志物,为协调分类和维度视角提供重要的见解,从而推进未来精确临床试验的进展,从而能够针对特定的AD亚型。
参考文献:Four distinct subtypes of Alzheimer’s disease based on resting-state connectivity biomarkers