抗癌药物之多肽药物偶联物技术(PDC)介绍
长期以来,心血管疾病是全球中年人死亡的主要原因。这种情况最近在高收入国家发生了变化,现在癌症导致的死亡人数是心血管疾病的两倍。2018 年,癌症导致全球 960 万人死亡,1810 万新病例被诊断出来。女性最常发生的癌症是乳腺癌,而男性最常见的是前列腺癌。
在过去的 60 年里,化疗仍然是癌症治疗的标志。在这种方法中,系统性地使用高细胞毒性药物。然而,这些化疗药物也会影响高增殖率的健康细胞,如肠上皮细胞。这种外周毒性是化疗经常发生副作用的原因。不良反应的发生在很大程度上取决于患者和应用的化疗药物。这不仅适用于化学治疗剂,而且适用于全身给药而不具有任何选择性的任何治疗剂分子。
减少副作用的一种可能性是放弃全身给药的药物,只对受影响的组织局部应用伤害肿瘤的治疗。这种愿景催化了放疗的产生,但即便辐射可以针对局部的癌细胞,但使用的剂量可以造成照射区域内的所有细胞受到影响。尽管如此,放射治疗仍然是一种重要的治愈性治疗方式,超过 50% 的患者受益于这种治疗。尽管放射疗法经常与手术和化学疗法结合使用以增加抗肿瘤效果,但长期癌症幸存者发生第二次恶性肿瘤的风险更高,因为放射线也会损害健康组织的遗传物质。出于这种考虑,递送的药物剂量必须尽可能地低,以防止过量剂量对健康组织造成伤害。然而又必须首先满足有效消除癌细胞的前提。这看上去有些像一个投鼠忌器的难解矛盾。
在过去的几十年里,人们一直心心念念着癌症的靶向治疗,并且开发了多种方法来提高肿瘤细胞的辐射敏感性。毫无疑问,所有这些方法都需要施用药物,并且选择性地寻找癌细胞。可以通过瞄准癌症的生化特征,促进选择性治疗药物的递送。例如癌细胞经常过度表达细胞表面蛋白,这些蛋白结合不同的配体,允许靶向肿瘤细胞。
肿瘤细胞的凋亡诱导剂,一旦与靶向肿瘤细胞的配体分子通过合理的手段结合在一起,理论上就有可能实现癌症的靶向治疗。尽管这个概念似乎很简单,但实现起来却相当复杂,如今仍然具有极强的挑战性。原则上,可以实现选择性给药的所有偶联物均由三个模块组成(图 1)。第一个成分是载体 (carrier),它负责肿瘤靶向。除了适体(aptamer)之外,小分子和生物制剂(例如多肽、蛋白质和抗体)也可以充当载体角色。第二个成分是药物本身 (载荷, payload),它可以诱导多种生物学功能,但在癌症治疗的背景下,主要使用细胞毒性分子或放射性核素 (radionuclide)。第三个模块 (手臂,linker) 链接前两者。视载荷特性可使用可裂解或不可裂解的手臂,以实现受控药物释放。
图1. 受体靶向药物偶联物的结构示意图。药物偶联物由三个模块组成:有效载荷、手臂和载体。
载体(Carrier)
载体,也称为肿瘤归巢剂(tumor-homing agent),这个名称形象地比喻了将载荷引入肿瘤细胞的化合物。小分子、适体和多糖都可以充当这种引路者的角色。单克隆抗体 (mAb) 已发展成为增长最快的药物类别,在过去几年中有 30 多种 mAb 获得批准,100 多种 mAb 处于临床开发阶段。很多抗体药物偶联物 (ADC) 也已获得FDA和EMA 的监管批准。它们都与细胞表面受体如 CD22、CD30、CD33 或人类表皮生长因子受体 2 (HER2) 结合,这些受体与 ADC 一起内化。在溶酶体中ADC 降解后,附着的细胞毒性有效载荷被释放并产生药效。尽管这些偶联物上市并证明了这种方法的可行性,但抗体存在严重的局限性。大多数 mAb它们体量太大而无法有效扩散到肿瘤细胞之中。除此之外,单克隆抗体可能产生免疫原性。此外,mAb 成本非常高昂。
大多数单克隆抗体这些缺点可以通过使用更小的多肽等生物分子弥补。事实上,多肽作为多肽-药物偶联物 (Peptide Drug Conjugate, PDC) 的载体分子具有几个优点。合成方式简明直接且有很高的扩大能力。多肽的化学修饰可以提高它的亲和力。此外,多肽可被蛋白水解酶快速降解,并通过肝脏和肾脏从血液循环中快速清除。多肽通常被认为是安全的,因为它们具有低免疫原性并产生无毒代谢物。此外,相对于抗体来说,低分子量的多肽可以实现对组织的有效渗透,从而产生更好的抗肿瘤效果。
PDC 中使用的肽可分为两类:细胞穿透肽 (cell-penetrating peptides,CPPs) 和细胞靶向肽 (cell-targeting peptides,CTPs)。CPPs 跨细胞膜的摄取机制尚未完全清楚。由于细胞特异性低,CPPs 的广泛应用受到限制。相比之下,CTP 是更为理想的载体分子,它们具有与 mAb 相同的能力。它们以高亲和力结合肿瘤细胞表面过度表达的受体,但却不受单克隆抗体缺点的不利影响。
肿瘤治疗中的多肽受体靶标
开发高效抗癌药物过程中面临的重大挑战之一,在于如何选择性地将药物输送到肿瘤部位,而不影响健康组织。细胞表面受体在靶向癌症治疗方法中备受关注,因为它们提供了允许选择性肿瘤靶向的所需特性(表 1)。
表1. 常见肿瘤细胞靶向受体
手臂(Linker)
很多手臂技术被尝试应用于PDC,具体选择取决于PDC的 作用机制。手臂必须在循环中表现出稳定性,以防止药物过早地以及非特异性释放。载荷提前释放是 PDC 关注的一个重点,因为提前释放细胞毒素而产生的体内积累会导致危险,甚至产生致命的副作用。同样重要的是要考虑手臂在体内代谢过程中的命运,以及由此产生的产物的毒性。
与 ADC 一样,用于 PDC 的手臂分为可切割的或不可切割的。可切割手臂的降解可以是酶介导或者化学介导的。而不可切割的手臂不会被环境刺激降解,例如 pH 值、谷胱甘肽 (GSH) 或肿瘤微环境中发现的酶的变化。可裂解手臂包括酸裂解、二硫键可还原裂解。
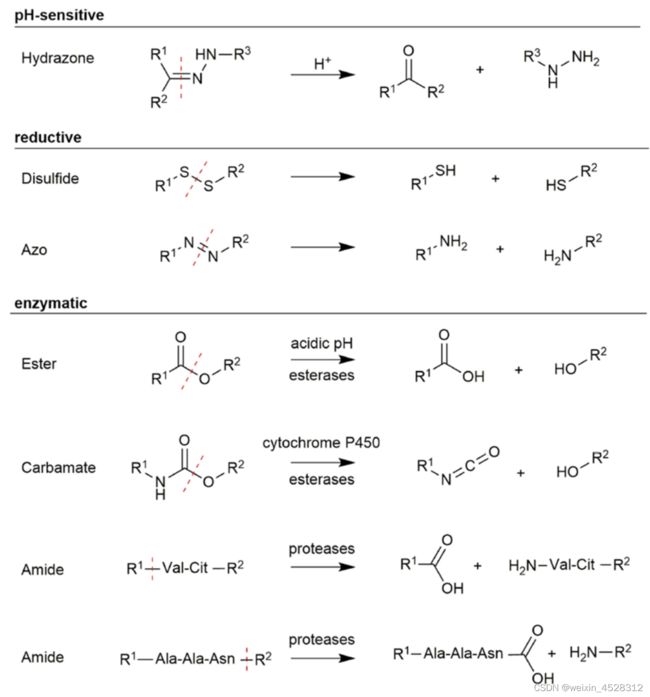
图2显示了PDC常用的手臂裂解方式,包括腙的酸解(产生醛/酮与肼,安全性上似乎要打一个大大的问号)、二硫键还原为硫醇、偶氮还原为胺、酯的酶解(酯酶作用产生羧酸与醇)、氨基甲酸酯酶解(CYP450与酯酶)为异氰酸酯和醇,前者会水解为胺与二氧化碳、酰胺酶解(蛋白酶)为羧酸与胺。
图2. PDC的手臂结构与裂解方式。
药物载荷(Payload)
研发人员开发了一系列细胞毒性药物,希望在治疗癌症的过程中实现它们的疗效。但令人壮志难酬的是,这些细胞毒性药物大多都不具备靶向肿瘤细胞的选择性,对健康细胞造成伤害并导致严重的副作用,因而药代学特性难以令人满意。靶向治疗提供了一种重新利用药物(drug repurposing)的方法。多肽载体的浮出水面也让研究者看见了靶向治疗的曙光。当细胞毒素以恰好的方式结合多肽载体时,因为它的精准递送,可以显著降低细胞毒素的剂量。选择的细胞毒性有效载荷通常具有低 IC50,通常在纳摩尔范围内。 PDC 中使用的有效载荷示例包括阿霉素(Doxorubicin,亦称多柔比星)、紫杉醇(taxol)、柔红霉素(Daunorubicin,亦称道诺霉素)、吉西他滨(Gemcitabine) 和 美登素(mertansine,亦称美登新)4(图 3)。
图3. 几种PDC中使用的细胞毒素分子结构。(图片来源:Chem. Soc. Rev.)
细胞毒性有效载荷也可以包括放射性核素,比如FDA 批准的 177Lu-dotatate (图 4)。177Lu-dotatate 用于治疗胃肠胰神经内分泌肿瘤(GEP-NETs),是第一个 FDA批准的 PDC。在这个PDC中扮演归巢肽角色的多肽是生长抑素(somatostain),它通过酰胺与DOTA(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid,1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)手臂链接,另一端, DOTA手臂与细胞毒性放射治疗剂 177Lu 偶联。177Lu-dotatate IV 给药,每 8 周一次,通常共4个周期治疗。
图4:PDC药物177Lu-dotatate化学结构与组成部分示意图
其实,PDC 不仅限于用作治疗剂,而是广泛用作显像剂,例如FDA 批准含有放射性核素的 PDC:111In-DTPA-Octreotide (OctreoscanTM), 它用于治疗神经内分泌肿瘤。然而研究表明,OctreoscanTM对肿瘤消退的影响比较有限,因此,它退而求其次地主要用于了诊断目的。相比之下,177Lu-dotatate具有更大的治疗潜力。
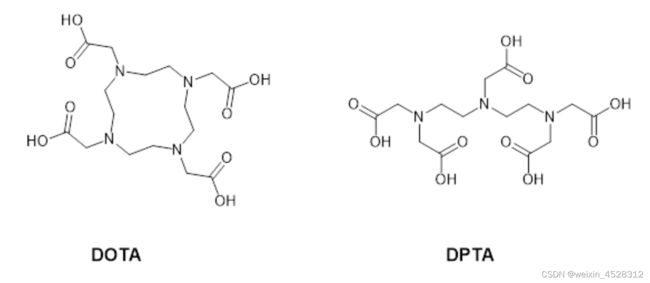
放射性核素可以通过各种扫描技术,以精确定位的方式对肿瘤进行成像。5 归巢多肽结合物的使用可以实现选择性地结合受体而几乎不产生异位靶向。为了将显像剂嵌合到多肽分子中,研究人员经常经常使用双功能螯合剂,其中DOTA 和DTPA (二亚乙基三胺五乙酸)最受青睐(图5)。
PDC 显然是一种多功能策略,不仅可用于运输载荷药物,也可以递送显像剂以识别肿瘤位置或确定肿瘤进展。
图5. 双螯合剂DOTA与DPTA化学结构。
小结和展望
尽管目前FDA只批准了两款PDC药物(不包括诊断试剂):177Lu-dotatate (lutathera®) 和melflufen flufenamide (Pepaxto®)(后者已被从美国市场撤回)。 但有很多PDC目前处于临床或前临床阶段。
根据 InsightAce Analytic 的最新研究,预计 2022-2030 年期间,全球肽-药物偶联物 (PDC) 市场的复合年增长率将达到 13.7%。按地区划分,北美以最大的份额主导着全球肽-药物偶联物 (PDC) 市场。PDC药物肿瘤穿透性强,生产成本低,免疫原性低。与其他偶联药物相比,PDC药物具有更广泛的产业基础和临床价值。随着相关技术问题的解决和配套技术的突破,PDC药物也将成为未来十年的研发和投资热点。更多创新生物制药公司将加入这场竞赛,使PDC药物的快速发展,造福更多的患者。
参考文献:
[1] Vhora, I. et al. Receptor-targeted drug delivery: current perspective and challenges. Ther.
Deliv. 2014, 5, 1007–1024.
[2] Carrasco-Triguero, M. et al. Immunogenicity assays for antibody-drug conjugates: case study with adotrastuzumab emtansine. Bioanalysis. 2013, 5, 1007–1023.
[3] Vhora, I. et al. Receptor-targeted drug delivery: current perspective and challenges. Ther.
Deliv. 2014, 5, 1007–1024.
[4] E. I. et al. G. Mez+o and A. G. Tzakos, On the design principles of peptide–drug conjugates for targeted drug delivery to the malignant tumor site. Beilstein J. Org. Chem. 2018, 14, 930–954.
[5]Hoppenz, et al., Peptide-Drug Conjugates and Their Targets in Advanced Cancer Therapies. Front. Chem. 2020, 8, 571.
[6] Olivier, T. Et al. The approval and withdrawal of melphalan flufenamide (melflufen): Implications for the state of the FDA. Translational Oncology. 2022, 18, 101374.