- TPAMI 2024 | SSR-2D: 从2D图像进行语义3D场景重建
小白学视觉
论文解读IEEETPAMI深度学习顶刊论文论文解读TPAMI
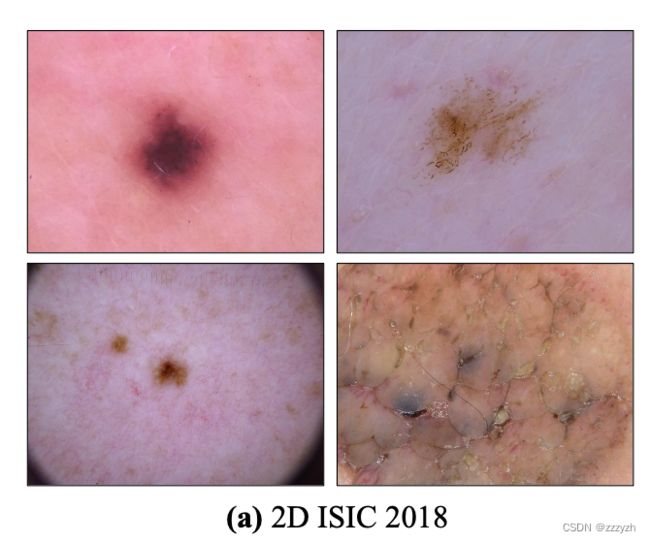
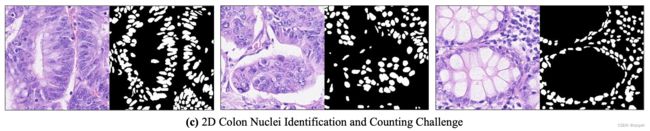
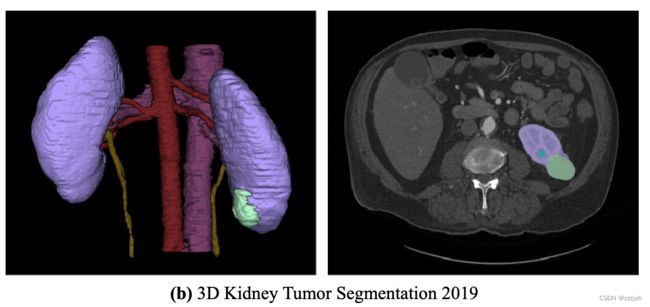
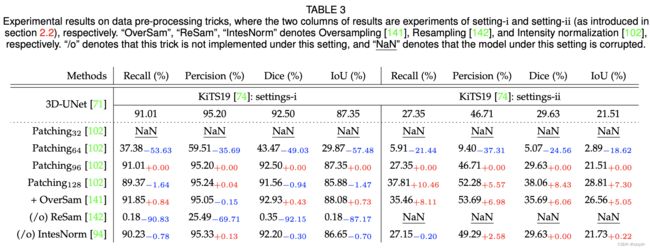
论文信息题目:SSR-2D:Semantic3DSceneReconstructionFrom2DImagesSSR-2D:从2D图像进行语义3D场景重建作者:JunwenHuang,AlexeyArtemov,YujinChen,ShuaifengZhi,KaiXu,andMatthiasNießner论文创新点首次提出了一种基于深度学习的方法,能够在不使用任何3D标注的情况下,从不完整的RGB
- 读算法简史:从美索不达米亚到人工智能时代15读后总结与感想兼导读
躺柒
人工智能算法导读总结AI
1.基本信息算法简史:从美索不达米亚到人工智能时代克里斯·布利克利著中信出版集团股份有限公司,2024年9月出版1.1.读薄率书籍总字数18.6万字,笔记总字数51653字。读薄率51653÷186000≈27.77%1.2.读厚方向当我点击时,算法在想什么?算法霸权极简算法史:从数学到机器的故事算法的陷阱:超级平台、算法垄断与场景欺骗天才与算法:人脑与AI的数学思维算法图解1.3.笔记--章节对
- 从养殖场到科技前沿:YOLOv11+OpenCV精准计数鸡蛋与鸡
星际编程喵
Python探索之旅YOLOopencv人工智能python目标检测计算机视觉
前言谁能想到,鸡蛋和鸡的计数居然能变成一项高科技活儿?想象一下,早上去市场,卖家把鸡蛋摔得稀巴烂,结果鸡蛋滚得到处都是——难道你就得一个个捡回来数?还得小心别弄错?可是,你又不是超人!别担心,科技来帮忙!今天的主角是YOLOv11和OpenCV,它们是计算机视觉领域的两位大佬,专门为你解决这一难题。无论是鸡蛋还是鸡,它们都能精准识别,数得清清楚楚。不信?那我们就一起去看看怎么用这对“黄金搭档”解决
- spiking neural network概念学习
Zaгathustra
科研工作深度学习神经网络机器学习
我们认为,SNNs最大的优势在于其能够充分利用基于时空事件的信息。今天,我们有相当成熟的神经形态传感器,来记录环境实时的动态改变。这些动态感官数据可以与SNNs的时间处理能力相结合,以实现超低能耗的计算。在此类传感器中使用SNNs主要受限于缺乏适当的训练算法,从而可以有效地利用尖峰神经元的时间信息。实际上就精度而言,在大多数学习任务中SNNs的效果仍落后于第二代的深度学习。很明显,尖峰神经元可以实
- 深度学习(1)-简单神经网络示例
yyc_audio
深度学习人工智能
我们来看一个神经网络的具体实例:使用Python的Keras库来学习手写数字分类。在这个例子中,我们要解决的问题是,将手写数字的灰度图像(28像素×28像素)划分到10个类别中(从0到9)。我们将使用MNIST数据集,图2-1给出了MNIST数据集的一些样本。在机器学习中,分类问题中的某个类别叫作类(class),数据点叫作样本(sample),与某个样本对应的类叫作标签(label)。你不需要现
- Python爬虫——网站基本信息
IT·小灰灰
python爬虫开发语言网络
在智能时代,数据是新的石油。Python爬虫技术赋予了我们成为数据猎人的能力,让我们能够在网络的广袤土地上狩猎,为机器学习和人工智能的发展提供燃料目录一、介绍——Python二、介绍——Python爬虫1.请求库2.解析库3.数据存储4.多线程/多进程5.异步编程6.代理和反爬虫7.爬虫框架8.爬虫的法律和道德问题9.异常处理10.日志记录三、爬虫示例代码一、介绍——PythonPython是一种
- Python 自动排班表格(代码分享)
趣享先生
Python案例分享专栏python开发语言
✅作者简介:2022年博客新星第八。热爱国学的Java后端开发者,修心和技术同步精进。个人主页:JavaFans的博客个人信条:不迁怒,不贰过。小知识,大智慧。当前专栏:Java案例分享专栏✨特色专栏:国学周更-心性养成之路本文内容:Python自动排班表格(代码分享) 前些天发现了一个巨牛的人工智能学习网站,通俗易懂,风趣幽默,忍不住分享一下给大家。点击跳转到网站。文章目录前言问题描述解决步骤1
- 理论一、大模型—概念
伯牙碎琴
大模型自然语言处理ai
一、总述大模型通常指的是参数规模庞大、训练难度较高的人工智能模型。随着深度学习技术的发展,研究人员和企业越来越倾向于构建更大的模型,以提高模型的性能和泛化能力。这些大模型往往需要大量的数据和计算资源来训练,并且在实际应用中通常表现出色。大模型全称是大型语言模型(LLM,LargeLanguageModel),这个“大”主要指模型结构容量大,结构中的参数多,用于预训练大模型的数据量大。一个大模型可以
- 自动驾驶系列—颠覆未来驾驶:深入解析自动驾驶线控转向系统技术
学步_技术
自动驾驶自动驾驶人工智能机器学习线控系统
欢迎来到我的技术小筑,一个专为技术探索者打造的交流空间。在这里,我们不仅分享代码的智慧,还探讨技术的深度与广度。无论您是资深开发者还是技术新手,这里都有一片属于您的天空。让我们在知识的海洋中一起航行,共同成长,探索技术的无限可能。探索专栏:学步_技术的首页——持续学习,不断进步,让学习成为我们共同的习惯,让总结成为我们前进的动力。技术导航:人工智能:深入探讨人工智能领域核心技术。自动驾驶:分享自动
- 《一文吃透!NLTK与SpaCy,自然语言处理的神兵利器》
人工智能深度学习
在人工智能的璀璨星空中,自然语言处理(NLP)无疑是最为耀眼的领域之一。它让机器能够理解、处理和生成人类语言,极大地推动了智能交互的发展。而在Python的NLP工具库中,NLTK和SpaCy就像两把锋利的宝剑,各自散发着独特的光芒。今天,就让我们深入探究这两款工具的使用技巧与优势,为你的NLP之旅增添强大助力。一、NLTK:自然语言处理的瑞士军刀NLTK(NaturalLanguageToolk
- Flux架构:构建可预测的Web应用状态管理体系
阿珊和她的猫
架构前端
前端开发工程师、技术日更博主、已过CET6阿珊和她的猫_CSDN博客专家、23年度博客之星前端领域TOP1牛客高级专题作者、打造专栏《前端面试必备》、《2024面试高频手撕题》蓝桥云课签约作者、上架课程《Vue.js和Egg.js开发企业级健康管理项目》、《带你从入门到实战全面掌握uni-app》前些天发现了一个巨牛的人工智能学习网站,通俗易懂,风趣幽默,忍不住分享一下给大家。点击跳转到网站。文章
- ”人货场”模型搞懂没?数据分析大部分场景都能用!
接地气的陈老师
人工智能数据分析大数据机器学习推荐系统
做数据分析的同学,很多都听过:人、货、场的分析模型。然而,这东西又是个只闻其名,不见真身的东西。到底该怎么结合实际分析?今天我们系统讲解下。问题场景:某生鲜电商,用户复购率较低,60%的用户在30天内无二次购买行为,运营领导非常着急,要求通过数据分析提升复购率,请问你作为数据分析师该怎么做?建立人工智能精准推荐算法(40%概率用协同过滤,60%用关联分析)把过往6个月月初复购率做成折线图,然后写下
- Forrester发布2024年五大网络安全新威胁
岛屿旅人
网络安全web安全网络安全网络安全
文章目录前言一、大选年的叙事(舆论)操控攻击二、深度伪造引发身份安全危机三、生成式人工智能数据泄露四、人工智能软件供应链攻击五、太空成为安全战略高点数据泄露平均成本高达218万美元前言人工智能正重塑网络安全格局,武器化大语言模型正成为首选攻击工具,安全团队在应对武器化人工智能攻击方面将面临日益严峻的挑战。Forrester近日发布《2024年网络安全威胁预测报告》指出,人工智能正重塑网络安全格局,
- 人工智能的本质解构:从二进制桎梏到造物主悖论
Somnolence.·.·.·.
人工智能人工智能ai
一、数学牢笼中的困兽:人工智能的0-1本质人工智能的底层逻辑是数学暴力的具象化演绎。晶体管开关的物理震荡被抽象为布尔代数的0-1序列,冯·诺依曼架构将思维简化为存储器与运算器的机械对话。即使深度神经网络看似模拟人脑突触,其本质仍是矩阵乘法的迭代游戏——波士顿动力机器人的空翻动作不过是微分方程求解的物理引擎呈现,AlphaGo的围棋神话只是蒙特卡洛树搜索的概率统计。这种基于有限离散数学的架构,注定人
- YOLOv11 火焰识别:智能时代的火灾预警新利器
星际编程喵
Python探索之旅YOLOpython目标检测机器学习人工智能开发语言
前言随着人工智能(AI)在各个领域如火如荼发展,图像识别技术也跟着飞速进步。从最初的传统算法到如今的深度学习模型,图像识别在准确性和效率上提升令人惊叹。而在这场技术革命中,YOLO(YouOnlyLookOnce)系列模型无疑扮演举足轻重的角色。今天,我们将目光聚焦在最新的版本——YOLOv11。别误会,YOLOv11可不是什么随便升级。它远不止数字上多了个“1”那么简单。YOLOv11集成许多先
- OpenCV及基本用法
m0_74823683
opencv人工智能计算机视觉
一.OpenCV介绍1.OpenCV的全称是OpenSourceComputerVisionLibrary,是一个开放源代码的计算机视觉库。OpenCV是最初由英特尔公司发起并开发,以BSD许可证授权发行,可以在商业和研究领域中免费使用,现在美国WillowGarage为OpenCV提供主要的支持。OpenCV可用于开发实时的图像处理、计算机视觉以及模式识别程序,目前在工业界以及科研领域广泛采用。
- 从AI发展史看DeepSeek的崛起:技术革新与生态重构的范式突破
AI软件改变生活
AI资料人工智能deepseek
Deepseek-R1最新可用网址整理推荐、Deepseek干货资料分享https://blog.csdn.net/ifree_code/article/details/145626999[>>>>>>>>>DeepSeek最新资料包汇总<<<<<<<<]DeepSeek最新资料包汇总https://www.kdocs.cn/l/cq8nbKQzguhC?R=L1MvNDE=人工智能(AI)的发展
- 【AI中的数学-人工智能的数学基石】AI的心脏:探索人工智能的算法与核心技术
云博士的AI课堂
AI中的数学人工智能算法数学AI数学大模型
第一章人工智能的数学基石第二节AI的心脏:探索人工智能的算法与核心技术人工智能(AI)的迅猛发展离不开其背后的复杂算法与核心技术。这些算法不仅决定了AI系统的性能和能力,也构成了AI应用的基础。从基础的机器学习算法到先进的深度学习模型,AI的算法生态系统丰富多样,涵盖了广泛的数学原理和计算方法。本节将深入探讨驱动AI进步的关键算法与技术,揭示其工作机制及在实际应用中的重要性。一、机器学习:智能的基
- 计算机视觉:COCO数据集
00&00
计算机视觉深度学习人工智能计算机视觉人工智能
COCO(CommonObjectsinContext)是一个广泛使用的计算机视觉数据集,主要用于图像识别、物体检测、分割和关键点检测等任务。以下是对COCO数据集的详细介绍,包括其特点、组成部分以及在计算机视觉中的应用。一、COCO数据集的特点1.规模庞大COCO数据集包含超过30万张图像,其中超过20万张图像有注释。这些图像来自不同的场景和对象,使得数据集具有广泛的代表性。2.丰富的标注信息物
- 农业机器人综述:技术现状、应用场景及未来展望
橙蜂智能
机器人
农业机器人综述:技术现状、应用场景及未来展望引言一、农业机器人的技术现状1.感知模块2.导航与定位模块3.控制与执行模块4.通信与数据传输模块5.决策与人工智能模块6.电源管理与能源模块二、农业机器人的应用场景1.播种与施肥2.植保与除草3.采摘与收获4.土壤和作物监测5.温室管理与环境控制6.多机器人协作三、农业机器人面临的挑战1.成本较高2.环境适应性差3.技术成熟度有待提高4.数据安全和隐私
- 文本生成型人工智能:逻辑算法与文字组合的重构艺术
Somnolence.·.·.·.
人工智能人工智能算法重构人机交互aichatgpt
引言在数字化浪潮的推动下,文本生成型人工智能(如GPT系列、Claude、Deepseek等)正逐步从技术工具演化为人类社会的"数字镜像"。其本质并非简单的文字堆砌,而是基于算法逻辑对海量语言数据的学习与重组。这一过程既模仿了人类的思维模式,又受制于技术基础设施的物理边界。以下从三个维度解析其运行逻辑与技术哲学。一、数据训练:从概率统计到仿生逻辑的跨越文本生成型AI的核心在于通过神经网络模型对语言
- DeepSeek正重构具身大模型和人形机器人赛道!
Robot251
重构机器人人工智能科技自动驾驶
中国人工智能公司DeepSeek(深度求索)以“低成本、高效率、强开放”的研发范式横空出世,火遍并震撼全球科技圈;DeepSeek展现出来的核心竞争力,除了低成本及推理能力,更重要的是开源模型能力追赶上了最新的闭源模型;而对具身智能领域影响最大的当属于其开源大模型DeepSeek-R1。2024年1月20日,公司发布全球首个完全通过强化学习训练的专注于推理任务的高性能语言模型DeepSeek-R1
- 预测股票走势的ai模型
roxxo
AI模型人工智能深度学习金融
AI股票走势预测模型用深度学习+时间序列分析来构建一个股票预测AI,基于历史数据预测未来走势。1.关键功能✅AI选股(基于财务数据+技术指标)✅股票走势预测(LSTM/Transformer)✅智能筛选高增长潜力股✅可视化分析2.关键技术数据来源:YahooFinance/AlphaVantage财务分析:PE、EPS、ROE、PB、成交量机器学习选股:随机森林/XGBoost深度学习预测:LST
- SoC 架构设计全面详解:从基础到实战
嵌入式Jerry
面试架构系统架构AI编程ai学习
一、SoC是什么?为什么重要?SoC(SystemonChip,片上系统)是一种将计算核心、存储系统、通信接口以及各种外设集成到一个单一芯片上的高度集成解决方案。它在智能手机、汽车电子、人工智能、工业控制等领域扮演着至关重要的角色。为什么SoC如此重要?高集成度:将多个功能模块集成到单个芯片上,减少了PCB板空间,提高了可靠性。高性能低功耗:相比传统多个芯片组合的方式,SoC通过优化设计大幅降低功
- 清华大学:DeepSeek 如何赋能职场应用(35 页 PDF)
伟贤AI之路
AI应用pdf
原来已经分享过清华大学的DeepSeek:从入门到精通(100页PDF)现在又来第二弹:《DeepSeek如何赋能职场应用?从提示语技巧到多场景应用》PDF里介绍了DeepSeek这一人工智能工具及其在职场中的应用,从基础模型到深度思考模型,再到联网搜索模型,展示了其在不同情境下的强大功能。通过提示语技巧和多场景应用,DeepSeek能够实现人机高效协同,提高工作效率和创作质量。文章不仅讲述了De
- DeepSeek推荐未来好就业的十大专业
东锋1.3
人工智能deepseek推荐就业
一、人工智能与数据科学专业聚焦人工智能、大数据技术、计算机科学与技术、机器学习、数据科学与大数据技术等专业,构成了这一前沿领域的核心。这些专业旨在培养学生掌握从数据收集、处理到模型构建、算法优化的全流程能力。就业前景洞察人工智能已广泛渗透到医疗、金融、制造、交通等众多领域。在医疗领域,AI辅助诊断系统帮助医生更精准地识别疾病;金融行业里,智能风控模型有效防范风险。未来,算法工程师负责开发和优化各种
- 云计算、大数据、人工智能、物联网、虚拟现实技术、区块链技术
2301_79098963
程序员云计算大数据人工智能
物联网一、物联网的基本概念二、物联网的特征(一)物体感知(二)信息传输(三)智能处理三、物联网关键技术(一)射频识别技术(二)产品电子编码(三)短距离通信技术(四)互联网(五)感知控制技术(六)无线网络技术(七)中间件技术(八)智能处理技术四、物联网的应用领域虚拟现实技术一、VR的基本概念二、VR的特征(一)沉浸性(二)人交互性(三)多感知性(四)想象性(五)自主性三、VR的技术应用(一)在影视娱
- 2025年大模型与Transformer架构:技术前沿与未来趋势报告
和老莫一起学AI
transformer架构深度学习人工智能产品经理学习大模型
_“欧米伽未来研究所”关注科技未来发展趋势,研究人类向欧米伽点演化过程中面临的重大机遇与挑战。将不定期推荐和发布世界范围重要科技研究进展和未来趋势研究。在人工智能的宏大版图中,Transformer架构无疑是一颗璀璨的明星。它的出现,彻底改变了自然语言处理、计算机视觉等诸多领域的发展轨迹。《2025年大模型与Transformer架构:技术前沿与未来趋势报告》深入剖析了Transformer架构的
- AI 大模型创业:如何利用市场优势?
SuperAGI2025
计算机软件编程原理与应用实践javapythonjavascriptkotlingolang架构人工智能
AI大模型创业:如何利用市场优势?1.背景介绍随着人工智能技术的不断发展,大模型(LargeModels)在商业化应用中日益受到关注。大模型是指在特定领域中应用广泛、参数量巨大的神经网络模型,如BERT、GPT-3、DALL-E等。这些大模型通过在大规模数据集上进行预训练,具备强大的泛化能力和适应性,能够广泛应用于自然语言处理(NLP)、计算机视觉(CV)、生成对抗网络(GAN)等多个领域。然而,
- 人工智能推理模型(S1-32B)超越DeepSeek?
deepdata_cn
垂域模型人工智能人工智能大语言模型
S1模型是由斯坦福大学和华盛顿大学的研究团队在李飞飞教授的领衔下开发的人工智能推理模型。从2000年李飞飞进入加州理工学院攻读研究生起,就一直从事人工智能研究,在计算机视觉领域创立了拥有1500万张图片的ImageNet数据库,为人工智能计算机视觉研究奠定了基础,也积累了深厚的人工智能技术理论和实践经验。论文地址:https://arxiv.org/pdf/2501.19393一、发展过程模型采用
- 微信开发者验证接口开发
362217990
微信 开发者 token 验证
微信开发者接口验证。
Token,自己随便定义,与微信填写一致就可以了。
根据微信接入指南描述 http://mp.weixin.qq.com/wiki/17/2d4265491f12608cd170a95559800f2d.html
第一步:填写服务器配置
第二步:验证服务器地址的有效性
第三步:依据接口文档实现业务逻辑
这里主要讲第二步验证服务器有效性。
建一个
- 一个小编程题-类似约瑟夫环问题
BrokenDreams
编程
今天群友出了一题:
一个数列,把第一个元素删除,然后把第二个元素放到数列的最后,依次操作下去,直到把数列中所有的数都删除,要求依次打印出这个过程中删除的数。
&
- linux复习笔记之bash shell (5) 关于减号-的作用
eksliang
linux关于减号“-”的含义linux关于减号“-”的用途linux关于“-”的含义linux关于减号的含义
转载请出自出处:
http://eksliang.iteye.com/blog/2105677
管道命令在bash的连续处理程序中是相当重要的,尤其在使用到前一个命令的studout(标准输出)作为这次的stdin(标准输入)时,就显得太重要了,某些命令需要用到文件名,例如上篇文档的的切割命令(split)、还有
- Unix(3)
18289753290
unix ksh
1)若该变量需要在其他子进程执行,则可用"$变量名称"或${变量}累加内容
什么是子进程?在我目前这个shell情况下,去打开一个新的shell,新的那个shell就是子进程。一般状态下,父进程的自定义变量是无法在子进程内使用的,但通过export将变量变成环境变量后就能够在子进程里面应用了。
2)条件判断: &&代表and ||代表or&nbs
- 关于ListView中性能优化中图片加载问题
酷的飞上天空
ListView
ListView的性能优化网上很多信息,但是涉及到异步加载图片问题就会出现问题。
具体参看上篇文章http://314858770.iteye.com/admin/blogs/1217594
如果每次都重新inflate一个新的View出来肯定会造成性能损失严重,可能会出现listview滚动是很卡的情况,还会出现内存溢出。
现在想出一个方法就是每次都添加一个标识,然后设置图
- 德国总理默多克:给国人的一堂“震撼教育”课
永夜-极光
教育
http://bbs.voc.com.cn/topic-2443617-1-1.html德国总理默多克:给国人的一堂“震撼教育”课
安吉拉—默克尔,一位经历过社会主义的东德人,她利用自己的博客,发表一番来华前的谈话,该说的话,都在上面说了,全世界想看想传播——去看看默克尔总理的博客吧!
德国总理默克尔以她的低调、朴素、谦和、平易近人等品格给国人留下了深刻印象。她以实际行动为中国人上了一堂
- 关于Java继承的一个小问题。。。
随便小屋
java
今天看Java 编程思想的时候遇见一个问题,运行的结果和自己想想的完全不一样。先把代码贴出来!
//CanFight接口
interface Canfight {
void fight();
}
//ActionCharacter类
class ActionCharacter {
public void fight() {
System.out.pr
- 23种基本的设计模式
aijuans
设计模式
Abstract Factory:提供一个创建一系列相关或相互依赖对象的接口,而无需指定它们具体的类。 Adapter:将一个类的接口转换成客户希望的另外一个接口。A d a p t e r模式使得原本由于接口不兼容而不能一起工作的那些类可以一起工作。 Bridge:将抽象部分与它的实现部分分离,使它们都可以独立地变化。 Builder:将一个复杂对象的构建与它的表示分离,使得同
- 《周鸿祎自述:我的互联网方法论》读书笔记
aoyouzi
读书笔记
从用户的角度来看,能解决问题的产品才是好产品,能方便/快速地解决问题的产品,就是一流产品.
商业模式不是赚钱模式
一款产品免费获得海量用户后,它的边际成本趋于0,然后再通过广告或者增值服务的方式赚钱,实际上就是创造了新的价值链.
商业模式的基础是用户,木有用户,任何商业模式都是浮云.商业模式的核心是产品,本质是通过产品为用户创造价值.
商业模式还包括寻找需求
- JavaScript动态改变样式访问技术
百合不是茶
JavaScriptstyle属性ClassName属性
一:style属性
格式:
HTML元素.style.样式属性="值";
创建菜单:在html标签中创建 或者 在head标签中用数组创建
<html>
<head>
<title>style改变样式</title>
</head>
&l
- jQuery的deferred对象详解
bijian1013
jquerydeferred对象
jQuery的开发速度很快,几乎每半年一个大版本,每两个月一个小版本。
每个版本都会引入一些新功能,从jQuery 1.5.0版本开始引入的一个新功能----deferred对象。
&nb
- 淘宝开放平台TOP
Bill_chen
C++c物流C#
淘宝网开放平台首页:http://open.taobao.com/
淘宝开放平台是淘宝TOP团队的产品,TOP即TaoBao Open Platform,
是淘宝合作伙伴开发、发布、交易其服务的平台。
支撑TOP的三条主线为:
1.开放数据和业务流程
* 以API数据形式开放商品、交易、物流等业务;
&
- 【大型网站架构一】大型网站架构概述
bit1129
网站架构
大型互联网特点
面对海量用户、海量数据
大型互联网架构的关键指标
高并发
高性能
高可用
高可扩展性
线性伸缩性
安全性
大型互联网技术要点
前端优化
CDN缓存
反向代理
KV缓存
消息系统
分布式存储
NoSQL数据库
搜索
监控
安全
想到的问题:
1.对于订单系统这种事务型系统,如
- eclipse插件hibernate tools安装
白糖_
Hibernate
eclipse helios(3.6)版
1.启动eclipse 2.选择 Help > Install New Software...> 3.添加如下地址:
http://download.jboss.org/jbosstools/updates/stable/helios/ 4.选择性安装:hibernate tools在All Jboss tool
- Jquery easyui Form表单提交注意事项
bozch
jquery easyui
jquery easyui对表单的提交进行了封装,提交的方式采用的是ajax的方式,在开发的时候应该注意的事项如下:
1、在定义form标签的时候,要将method属性设置成post或者get,特别是进行大字段的文本信息提交的时候,要将method设置成post方式提交,否则页面会抛出跨域访问等异常。所以这个要
- Trie tree(字典树)的Java实现及其应用-统计以某字符串为前缀的单词的数量
bylijinnan
java实现
import java.util.LinkedList;
public class CaseInsensitiveTrie {
/**
字典树的Java实现。实现了插入、查询以及深度优先遍历。
Trie tree's java implementation.(Insert,Search,DFS)
Problem Description
Igna
- html css 鼠标形状样式汇总
chenbowen00
htmlcss
css鼠标手型cursor中hand与pointer
Example:CSS鼠标手型效果 <a href="#" style="cursor:hand">CSS鼠标手型效果</a><br/>
Example:CSS鼠标手型效果 <a href="#" style=&qu
- [IT与投资]IT投资的几个原则
comsci
it
无论是想在电商,软件,硬件还是互联网领域投资,都需要大量资金,虽然各个国家政府在媒体上都给予大家承诺,既要让市场的流动性宽松,又要保持经济的高速增长....但是,事实上,整个市场和社会对于真正的资金投入是非常渴望的,也就是说,表面上看起来,市场很活跃,但是投入的资金并不是很充足的......
- oracle with语句详解
daizj
oraclewithwith as
oracle with语句详解 转
在oracle中,select 查询语句,可以使用with,就是一个子查询,oracle 会把子查询的结果放到临时表中,可以反复使用
例子:注意,这是sql语句,不是pl/sql语句, 可以直接放到jdbc执行的
----------------------------------------------------------------
- hbase的简单操作
deng520159
数据库hbase
近期公司用hbase来存储日志,然后再来分析 ,把hbase开发经常要用的命令找了出来.
用ssh登陆安装hbase那台linux后
用hbase shell进行hbase命令控制台!
表的管理
1)查看有哪些表
hbase(main)> list
2)创建表
# 语法:create <table>, {NAME => <family&g
- C语言scanf继续学习、算术运算符学习和逻辑运算符
dcj3sjt126com
c
/*
2013年3月11日20:37:32
地点:北京潘家园
功能:完成用户格式化输入多个值
目的:学习scanf函数的使用
*/
# include <stdio.h>
int main(void)
{
int i, j, k;
printf("please input three number:\n"); //提示用
- 2015越来越好
dcj3sjt126com
歌曲
越来越好
房子大了电话小了 感觉越来越好
假期多了收入高了 工作越来越好
商品精了价格活了 心情越来越好
天更蓝了水更清了 环境越来越好
活得有奔头人会步步高
想做到你要努力去做到
幸福的笑容天天挂眉梢 越来越好
婆媳和了家庭暖了 生活越来越好
孩子高了懂事多了 学习越来越好
朋友多了心相通了 大家越来越好
道路宽了心气顺了 日子越来越好
活的有精神人就不显
- java.sql.SQLException: Value '0000-00-00' can not be represented as java.sql.Tim
feiteyizu
mysql
数据表中有记录的time字段(属性为timestamp)其值为:“0000-00-00 00:00:00”
程序使用select 语句从中取数据时出现以下异常:
java.sql.SQLException:Value '0000-00-00' can not be represented as java.sql.Date
java.sql.SQLException: Valu
- Ehcache(07)——Ehcache对并发的支持
234390216
并发ehcache锁ReadLockWriteLock
Ehcache对并发的支持
在高并发的情况下,使用Ehcache缓存时,由于并发的读与写,我们读的数据有可能是错误的,我们写的数据也有可能意外的被覆盖。所幸的是Ehcache为我们提供了针对于缓存元素Key的Read(读)、Write(写)锁。当一个线程获取了某一Key的Read锁之后,其它线程获取针对于同
- mysql中blob,text字段的合成索引
jackyrong
mysql
在mysql中,原来有一个叫合成索引的,可以提高blob,text字段的效率性能,
但只能用在精确查询,核心是增加一个列,然后可以用md5进行散列,用散列值查找
则速度快
比如:
create table abc(id varchar(10),context blog,hash_value varchar(40));
insert into abc(1,rep
- 逻辑运算与移位运算
latty
位运算逻辑运算
源码:正数的补码与原码相同例+7 源码:00000111 补码 :00000111 (用8位二进制表示一个数)
负数的补码:
符号位为1,其余位为该数绝对值的原码按位取反;然后整个数加1。 -7 源码: 10000111 ,其绝对值为00000111 取反加一:11111001 为-7补码
已知一个数的补码,求原码的操作分两种情况:
- 利用XSD 验证XML文件
newerdragon
javaxmlxsd
XSD文件 (XML Schema 语言也称作 XML Schema 定义(XML Schema Definition,XSD)。 具体使用方法和定义请参看:
http://www.w3school.com.cn/schema/index.asp
java自jdk1.5以上新增了SchemaFactory类 可以实现对XSD验证的支持,使用起来也很方便。
以下代码可用在J
- 搭建 CentOS 6 服务器(12) - Samba
rensanning
centos
(1)安装
# yum -y install samba
Installed:
samba.i686 0:3.6.9-169.el6_5
# pdbedit -a rensn
new password:123456
retype new password:123456
……
(2)Home文件夹
# mkdir /etc
- Learn Nodejs 01
toknowme
nodejs
(1)下载nodejs
https://nodejs.org/download/ 选择相应的版本进行下载 (2)安装nodejs 安装的方式比较多,请baidu下
我这边下载的是“node-v0.12.7-linux-x64.tar.gz”这个版本 (1)上传服务器 (2)解压 tar -zxvf node-v0.12.
- jquery控制自动刷新的代码举例
xp9802
jquery
1、html内容部分 复制代码代码示例: <div id='log_reload'>
<select name="id_s" size="1">
<option value='2'>-2s-</option>
<option value='3'>-3s-</option