MRI原理与CEST相关简介
一、MRI相关
1、MRI
2、磁共振成像的物理学原理
3、磁共振成像仪相关
4、磁共振成像脉冲序列
1、MRI
核磁共振成像MRI(Magnetic Reasonance Imaging)是利用利用磁共振的物理原理,来对人体内部结构成像的医学影像检查技术
核磁共振对人体内水分含量比较多的软性组织成像质量更好,更加精确清晰。对以往不容易检查的大脑和内部血管,可以更方便的进行成像
MAGNETOM Skyra 3T超导型磁共振成像系统
具有较高的物质组织对比对和组织分辨力,对软组织分辨率极佳,能清晰地显示软组织、软骨结构、解剖结构和医学上的病变形态,显示清楚、逼真。多方位成像,能对被检查部位进行横断面、冠状面、矢状面以及任何斜面成像
以射频脉冲作为成像的能量源,不使用电离辐射,对人体安全、无创
核磁共振成像
核磁共振可检查无症状性的脑梗塞、脑萎缩、脑动脉瘤、脑血管狭窄、畸形和病变等早期中风风险
对于肺部、肝脏、肾脏、胰腺、前列腺等脏器的检查,核磁共振不优于CT检查。如对于胃肠消化的检查,胃镜肠镜等内窥镜检查是最直接有效的
磁共振小肠成像(磁共振小肠造影)
2、磁共振成像的物理学原理
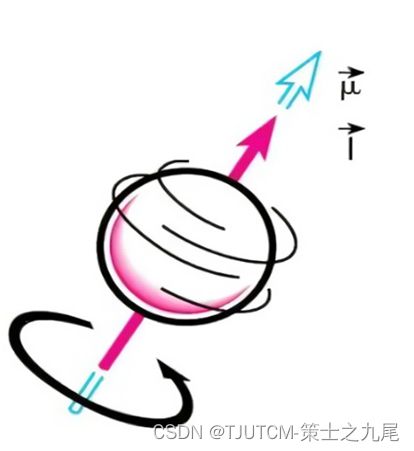
原子核具有一定的大小和质量,将其视作一个球体。所有的磁性原子核都以一定的频率绕自己的轴进行高速旋转,把磁性原子核的这一特性称为自旋(spin)
由于原子核表面带有正电荷,磁性原子核的自旋就形成自旋环路,从而产生具有一定大小和方向的磁化矢量
把这种由带有正电荷的磁性原子核自旋产生的磁场称为核磁,把磁共振成像称为核磁共振成像NMRI(neclear magnetic resonance imaging)
但并非所有原子核都能自旋产生核磁。若原子核内中子和质子的数目均为偶数,则这种原子核不能自旋产生核磁(非磁性原子核)
人体组织中常见的磁性原子核
选择1H用于常规磁共振成像的理由:
①是人体中含量最多的原子核,可以产生较强的磁共振信号
②磁化率在人体磁性原子核中最高,可以产生更强的磁共振信号
③存在于人体的各种组织中,具有生物代表性
并非所有的氢质子都能产生MRI信号。常规MRI的信号主要来源于水分子中的氢质子(简称水质子),部分组织的信号可来源于脂肪中的氢质子(简称脂质子)
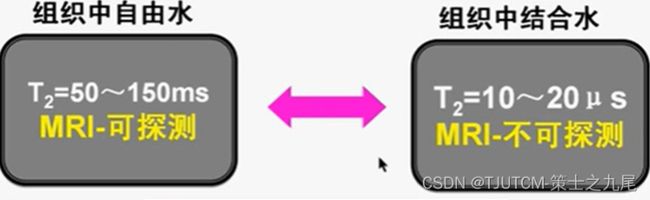
人体组织中的结合水是指蛋白质大分子周围水化层中的水分子。这些水分子黏附于蛋白质大分子,其自由运动将受到限制。而自由水则是指未与蛋白质结合在一起,活动充分自由的水分子。人体组织中的结合水和自由水可以互换,处于动态平衡状态
(蛋白质的水化层,引自PNAS, 2002)
由于化学位移效应,不同分子中的氢质子进动频率存在差别,蛋白质大分子中氢质子的进动频率大多偏离MRI的中心频率(自由水的进动频率),一般情况下不能被射频脉冲激发(结合水中的氢进动频率范围很宽,多不能被激励),不能产生信号
由于自由运动受到限制,蛋白质和结合水的T2值都很短(一般小于1ms),而常规MRI采集回波信号至少需要数毫秒。往往还没来得及采集回波信号,蛋白质和结合水的信号已经全部衰减。因此即便蛋白质和结合水中的氢质子被射频脉冲激发,也不能产生MRI信号
结合水中的多数氢质子不能被激励
被激励的结合水T2太短,信号不能被采集
平行同向排列为较低能量状态,称之为低能态;平行反向排列为高能态。两个自旋态之间的能量差ΔE可根据塞曼方程计算,两个自旋态的数量可以参考玻尔兹曼分布估算
在接近绝对零度的超低温状态下,可以预测绝大多数自旋会处于低能态。因为热运动会趋于平衡高低能态,随着温度升高,越来越多的自旋会处于高能态
进入主磁场后处于低能级的氢质子仅比处于高能级的氢质子多出数个ppm,而核磁共振成像利用的就是这略微多出的合成磁矩,称之为净磁化强度
而对于在体组织来说,其温度相对稳定,因此低能级比高能级多出的氢质子的量主要受主磁场强度的影响。随着主磁场强度的升高,多出的氢质子的量将几乎成比例增多,磁共振成像时可以利用的有效成像氢质子就增多,磁共振信号将增高
高能态
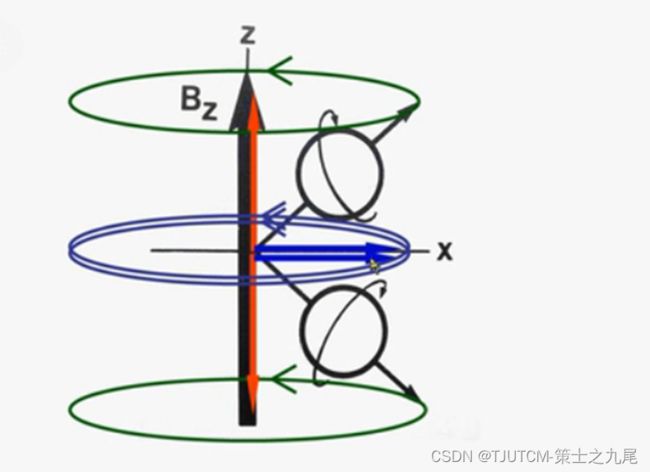
在进入主磁场后,无论是处于高能级还是处于低能级的质子,其磁化矢量并非完全和主磁场B0方向平行,而是存在一个角度。质子不仅会保持本身的自旋,还会以B0为轴旋转。
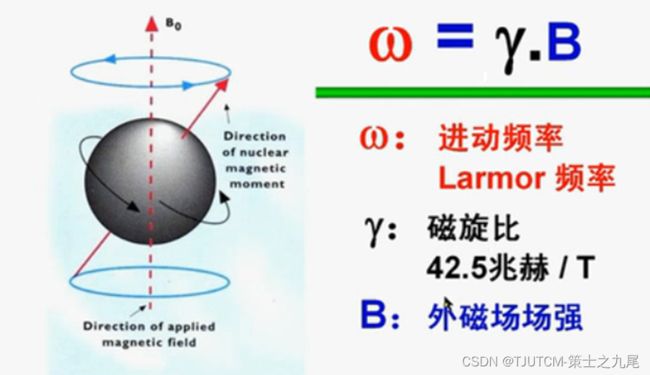
这种像陀螺一样的运动被称为进动(precession),又称拉莫尔(Lamour)进动
进动是磁性原子核自旋产生的小磁场与主磁场相互作用的结果,进动频率明显低于自旋频率,但对磁共振成像来说进动频率比自旋频率重要得多。
无论是处于低能级还是处于高能级的氢质子都存在进动。由于进动的存在,质子自旋产生小磁场又可以分解为纵向磁化分矢量和横向磁化分矢量
质子的进动频率与主磁场场强成正比
质子的纵向磁化分矢量不变,处于高能级者与主磁场方向相反,处于低能级者与主磁场方向相同。
由于处于低能级的质子略多于处于高能级者,最后会产生一个与主磁场同向的宏观纵向磁化矢量
由于质子在进动,其横向磁化分矢量则以主磁场方向为轴(Z轴)在XY平面作旋转运动,因此其方向处于不断的动态变化中
尽管每个氢质子的小核磁都有横向磁化分矢量,但各个氢质子的横向磁化分矢量相位不同而相互抵消,没有宏观横向磁化矢量产生
进动使每个氢质子均产生纵向和横向磁化分矢量
人体组织进入主磁场后被磁化产生宏观的纵向磁化矢量,某一组织(或体素)产生的宏观纵向矢量的大小与其含有的质子数成正相关
但进入主磁场后组织产生的宏观纵向磁化矢量对相对强度很大的主磁场来说非常微小。其重叠在与其方向一致的强大主磁场中,MR接受线圈就不可能检测到宏观纵向磁化矢量,也就不能区分不同组织之间因质子含量差别而产生的宏观纵向磁化矢量的差别
磁共振信号的探测和发电机类似。进入主磁场后,人体组织中产生的宏观磁化矢量保持稳定,其方向不发生变化,将不会切割线圈而产生信号,因此接收线圈探测不到组织中宏观纵向磁化矢量
而如果组织中有一个旋转的宏观横向磁化矢量,它将切割接收线圈而产生电信号,因此接受线圈能够探测到的是旋转的宏观横向磁化矢量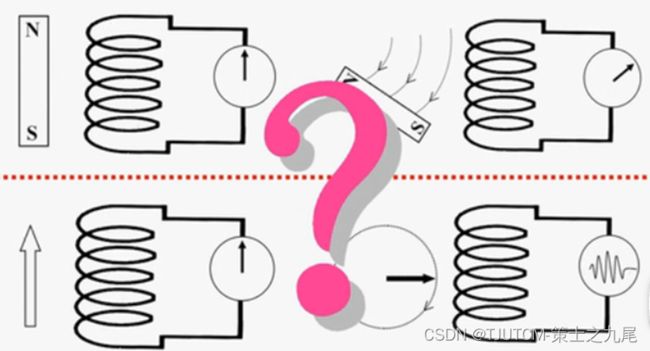
人体进入主磁场后,组织中处于低能级的质子略多于处于高能级的质子
如果给处于主磁场中的人体组织一个射频脉冲,这个射频脉冲的频率与质子的进动频率相同,射频脉冲的能量将传递给处于低能级的质子,处于低能级的质子获得能量后将跃迁到高能级。把这种现象称为磁共振现象
这时宏观纵向磁化矢量将因部分被抵消而减小
从微观角度来说,磁共振现象是低能级质子获得能量跃迁到高能级
进动的倾斜角度被称为翻转角,横向旋转磁场的频率一般在兆赫,属于射频的频率范围,而且通常只开启几毫秒,所以称为射频脉冲
从宏观角度来说,磁共振现象是使宏观磁环矢量发生偏转,偏转的角度与射频脉冲的能量有关,能量越大偏转角度越大
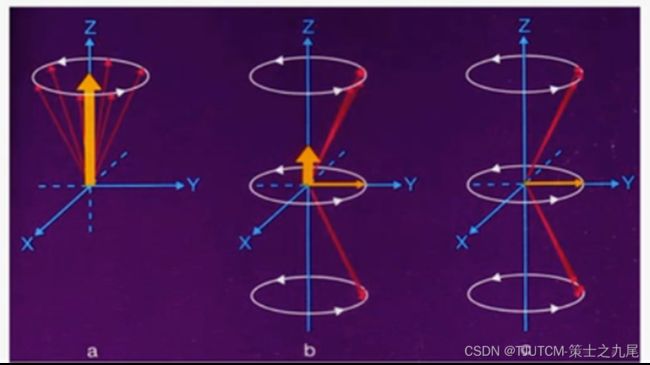
通过调整射频脉冲的幅度或持续时间,可以将原有的宏观纵向磁化矢量翻转90°、180°、270°或其他任意角度
在各种角度的射频脉冲中,90°射频脉冲产生的横向宏观磁化矢量最大
90°脉冲使处于低能态多出高能态的那部分质子的一半获得能量进入高能级状态,两个方向的纵向磁化分矢量相互抵消。宏观纵向磁化矢量为零
90°脉冲前质子的横向磁化分矢量相位不同,90°脉冲使质子的横向磁化分矢量处于同一相位,因而产生了一个最大的旋转宏观横向磁化矢量
组织质子密度越高,其宏观纵向磁化矢量越大,90°脉冲激发后产生的宏观横向磁化矢量越大,切割接收线圈产生的电信号越强,MR信号就越高
MR图像可以区分质子密度高低不同的组织,但仅仅区分不同组织的质子含量差别对于临床诊断是远远不够的
一般并不总在射频脉冲激发后马上采集MR信号,而是在射频脉冲关闭后等待一定时间并对信号进行干预和采集
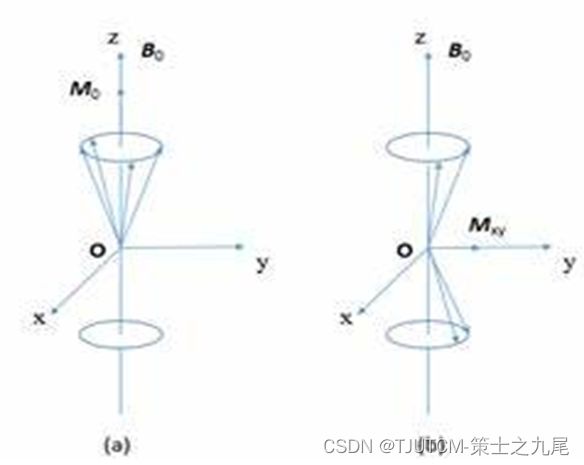
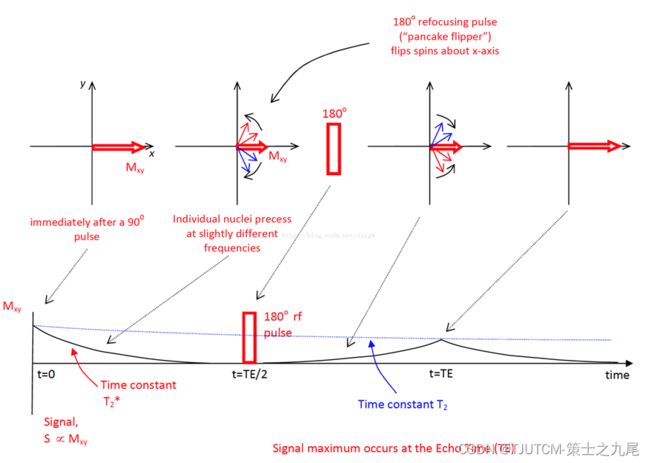
90°激励脉冲的宏观及微观效应
90°射频脉冲激发后的瞬间,组织中没有宏观纵向磁化矢量,而产生了最大的旋转宏观横向磁化矢量;
90°脉冲关闭,注意到组织中的宏观横向磁化矢量从最大逐渐减小直至完全衰减,而宏观纵向磁化矢量从零逐渐恢复直至最大即平衡状态
这一过程称为核磁弛豫(横向弛豫、纵向弛豫)
90°脉冲关闭后,组织中的宏观横向磁化矢量逐渐减小,最后衰减到零
90°脉冲使组织中原来相位不一致的质子群处于同相位进动,质子小磁场的横向磁化矢量相互叠加,从而产生旋转的宏观横向磁化矢量
90°脉冲关闭后,因同相位进动的质子群逐渐失去相位一致,其横向磁化分矢量的叠加作用逐渐减弱,因此宏观横向磁化矢量逐渐减小直至完全衰减
把宏观横向磁化矢量的指数式快速衰减称为自由感应衰减FID(free induction decay),也称T2*弛豫
T2*衰减的原因是磁场的不均匀导致不同位置处的原子核旋转频率不一样:在磁场强度较低的地方旋转得慢,在磁场强度较高的地方旋转得快。因此经过一定时间后,不同位置处的原子核旋转相位不一样(dephase失相位),它们的磁化向量的方向分布更分散,这些向量之和的幅值就小了
90°脉冲停止后宏观磁化矢量的变化(螺旋式倾倒的复原)
利用180°聚焦脉冲可以剔除主磁场不均匀造成的宏观横向磁化矢量衰减。组织由于质子群周围磁场微环境随机波动造成的宏观横向磁化矢量的衰减才是真正的横向弛豫(自旋-自旋弛豫spin-spin relaxation),即T2弛豫
90°射频脉冲的施加使某组织宏观横向磁化矢量达到最大值。以此时刻为起点,以T2弛豫造成的横向磁化矢量衰减到最大值的37%为终点,起点与终点之间的时间间隔即为该组织的T2值
T2弛豫:质子群逐渐失相位,T2值:Mxy从最大衰减到37(1/e)%所需的时间,用于描述组织T2弛豫的快慢
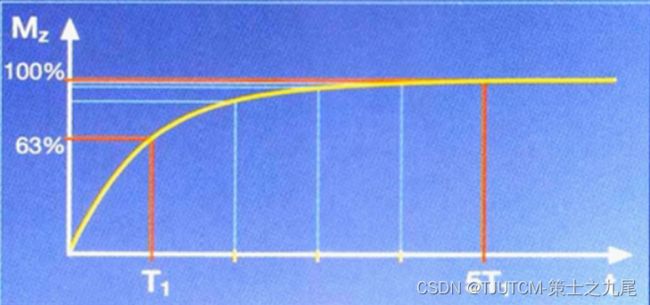
当射频脉冲关闭后,在主磁场的作用下,组织中的宏观纵向磁化矢量将逐渐恢复到激发前的状态(即平衡状态)。把这一过程称为纵向弛豫(自旋-晶格弛豫spin-lattice relaxation),即T1弛豫
以90°脉冲关闭后某组织的宏观纵向磁化矢量为零为起点,以宏观纵向磁化矢量恢复到最大值的63%为终点,其时间间隔即该组织的T1值
T1弛豫:高能态质子群释放能量回到低能,T1值:Mz从零恢复到最大者63(1-1/e)%所需的时间,描述组织T1弛豫的快慢
T1弛豫需要把质子群内部的能量传递到质子外的其他分子,所需要的时间较长
T2弛豫的能量传递发生于质子群内部,即质子与质子之间,所需要的时间较短
所有组织的T1值都比其T2值要长很多,一般组织的T1值为数百到数千毫秒,而T2值仅为数十毫秒到一百多毫秒,少数达数百毫秒
一般情况下,随主磁场强度的增高,组织的T1值延长,T2值改变不明显
T1弛豫
不同的采集方式采集到不同类型的磁共振信号
SE序列简图
FID信号波形
自旋回波的产生
与施加180°脉冲前的即刻相比,各质子的相位先后顺序颠倒,但相位的差值保持不变。180°聚焦脉冲后,各质子将以原来的频率继续进动,即质子1依然进动最快,而质子4依然进动最慢。随着时间推移,质子群的相位逐渐重聚,将形成一个逐渐增大的宏观横向磁化矢量,经过一个于Ti相同的时间即两倍Ti时刻,进动最快的质子1正好赶上进动最慢的质子4,由于主磁场恒定不均匀造成的相位离散彻底抵消,质子群相位得到最大程度重聚,将形成最大的宏观横向磁化矢量
从此时刻开始,由于主磁场不均匀造成的质子群进动频率差别依然存在,自由感应衰减再次发生,组织中的宏观横向磁化矢量又逐渐衰减。因此180°脉冲后组织中的宏观横向磁化矢量经历了逐渐增大,到了最大值后又逐渐衰减的过程,利用接收线圈记录这一变化过程将得到一个回波,所产生的回波被称为自旋回波SE(spin echo)
自旋回波法
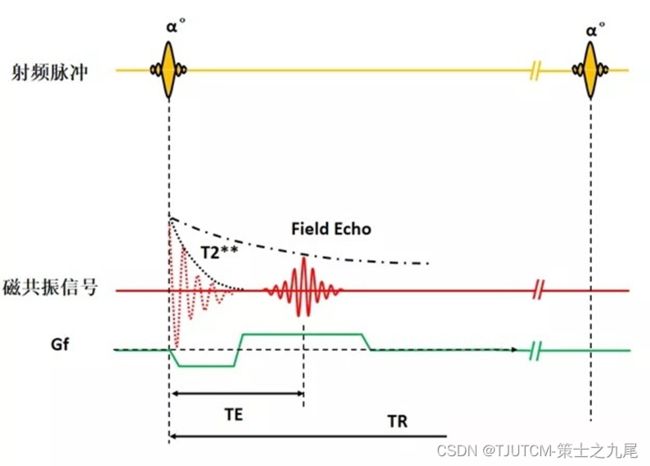
梯度回波GRE(gradient recalled echo)也是一种MRI的回波信号,利用读出梯度场的切换产生的回波
在射频脉冲激发后,在读出方向即频率编码方向上先施加一个梯度场,这个梯度场与主磁场叠加后将造成频率编码方向上的磁场强度差异,从而加快了质子群的失相位。质子群的失相位的速度比自由感应衰减更快,组织的宏观横向磁化矢量很快衰减到零,把这一梯度场称为离相位梯度场
梯度回波
在磁共振成像过程中,组织的多方面特性(如质子密度、T1值、T2值)均可能对其磁共振信号的强弱有影响。如果这些影响因素不加区分地混杂在一起,会带来问题:
①通过观察图像无法辨别组织信号强度高低到底反映的是组织的什么特性
②这些影响组织信号强度的因素混杂在一起将可能降低不同组织之间的对比,磁共振图像的组织分辨力降低
机器学习之局部加权线性回归、逻辑回归算法
T1加权成像T1WI(T1-weighted imaging)是指图像中组织信号强度的高低。主要反映的是组织的纵向弛豫差别
T2加权成像T2WI(T2-weighed imaging)重点突出的是不同组织之间的横向弛豫差别
质子密度成像PDWI(proton density weighted imaging)主要反映单位体积的不同组织之间的质子含量差别
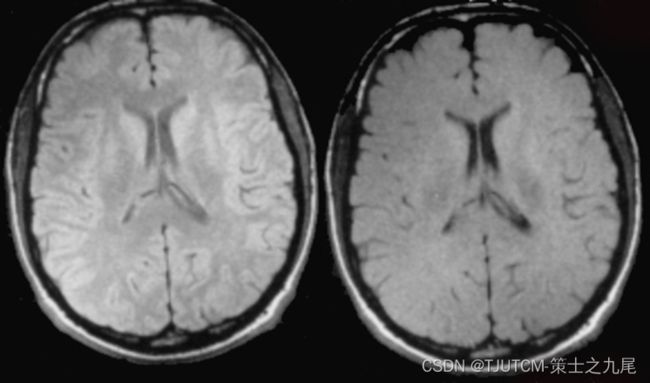
左图是T1加权成像,右图是T2加权成像
质子密度加权成像容易实现。以甲乙两种组织为例,甲组织质子含量高于乙质子,进入主磁场后,质子含量高的甲组织产生的宏观纵向磁化矢量大于乙组织;射频脉冲如90°脉冲激发后甲组织产生的旋转宏观横向磁化矢量就大于乙组织,这时马上检测MR信号,甲组织产生的MR信号将高于乙组织,即质子密度越高,MR信号强度越大,这就是质子密度加权成像
人体中含有大量的水,当对人体组织进行成像时,常选取长TR(2000ms)和短TE(30~40ms)的序列进行质子密度加权成像。因为长TR和短TE能减少T1和T2对成像信号的影响,从而突出图像上组织质子密度相关的信号
组织质子密度相差不大,则其对比度不强(10%-15%)。但有较高的信噪比,用于观察细小结构的组织
质子密度加权成像
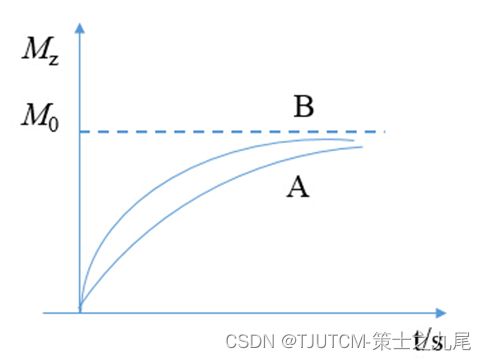
两种不同T1组织的恢复曲线
不同TR对组织对比影响
对比度的产生
脑脊液CSF是白色的,而灰质比白质更亮一些
脑脊液CSF是黑色的,T1像的灰质相对白质来说暗一些,白质较亮
对K空间的数据进行傅里叶转换,就能对原始数字数据中的空间定位编码信息进行解码,分解出不同频率、相位和幅度的MR信息。不同的频率和相位代表不同的空间位置,而幅度则代表MR信号强度。把不同频率、相位及信号强度的MR数字信号分配到相应的像素中,就得到了MR图像数据,即重建出MR图像了。可以看出傅里叶变换就是把K空间的原始数据点阵转变成磁共振图像点阵的过程
傅里叶变换
3、磁共振成像仪
磁共振成像仪通常由主磁体、梯度系统、射频系统、计算机系统和其他辅助设备共五部分构成。
主磁体是产生磁场的装置。主磁体分为永磁体和电磁体;电磁体又分为常导(已不常用)和超导
MRI按主磁场强度分类:(场强的重要性:MRI信噪比与场强成正比)
按场强分类:低场:小于0.5,中场:0.5T~1.0T,高场:1.0T~2.0T(1.0T、1.5T、2.0T),超高强场:大于2.0T(3.0T、4.7T、7T)
临床上使用最多的是3.0T的磁共振设备
高场强的优点:提高SNR、加快速度、MRS、脂肪抑制、BOLD效应
缺点:价格增高、噪音增加、SAR值升高(与场强平方成正比)、伪影增加
高度均匀的磁场:空间定位需要、提高信噪比、减少伪影、大视野扫描、频谱分析需要、脂肪抑制需要
磁共振设备利用外加的磁场和射频干涉低能态的核子,使其自旋转向高能态,原子核在该过程中从电磁场吸收能量。在去掉射频脉冲之后,原子核把吸收的一部分能量以电磁波的形式释放出来,这就是核磁共振信号
由于该原理,原子核共振释放的能量与外加磁场强度有着直接的联系,更高的外加磁场能得到更强的信号、更好的信噪比以及更高的对比度。
高场强MRI仪的主要优势表现为:
①提高质子的磁化率,增加图像的信噪比
②在保证信噪比的前提下,可缩短MRI成像时间
③增加化学位移效应使磁共振波谱MRS(magnetic resonance spectroscopy)对代谢产物的分辨率得到提高
④增加化学位移效应使脂肪饱和技术更加容易实现
⑤增加血氧饱和依赖(BOLD)效应,使脑功能成像的信号变化更为明显
MRI仪场强增高也存在一些问题:
①设备生产成本增加,价格提高
②噪声增加,虽然采用静声技术降低噪声,但是进一步增加了成本
③射频特殊吸收率SAR(specific absorption ratio)与主磁场场强的平方成正比,高场强下 射频脉冲的能量在人体内累计明显增大,SAR值问题在高场磁共振成像仪上表现得比较突出,在3.0T的超高场强机上尤为严重
④各种伪影增加,包括运动伪影、化学位移伪影及磁化率伪影等一般随场强的增高更为明显
梯度系统由梯度线圈、梯度放大器、数模转换器等组成
主要作用有:
①进行MRI信号的空间定位编码
②产生MR回波,磁共振梯度回波信号是由梯度场产生的
③施加扩散敏感梯度场,用于水分子扩散加权成像
④进行流动补偿
⑤进行流动液体的流速相位编码等
梯度线圈的主要性能指标包括梯度场强、梯度切换率和梯度线性
磁共振系统的坐标系及梯度线圈的分布
梯度场强是指单位长度内磁场强度的差别,通常用每米长度内磁场强度差别的豪特斯拉量(mT/m)来表示
有效梯度场两端的磁场强度差值除以梯度施加方向上有效梯度场的范围(长度)即表示梯度场强,即梯度场强(mT/m)=梯度场两端的磁场强度差值(mT)÷梯度场的有效长度
切换率(slew rate)是指单位时间及单位长度内的梯度磁场强度变化量,常用每毫秒每米长度内磁场强度变化的豪特斯拉量(mT/(m·ms))或每秒每米长度内磁场强度变化的特斯拉量(T/(m·s))来表示
切换率越高表明梯度磁场变化越快,也即梯度线圈通电后梯度磁场达到最大强度需要时间(爬升时间)越短
![]()
切换率=梯度场强度/爬升时间。实际上梯度切换率就是图中梯形左腰的斜率,斜率越大,即切换率越高,梯度场爬升越快,所需的爬升时间越短
射频系统由射频发生器、放大器、射频通道、射频线圈等构成,用于激发人体长生共振、接受MR信号
射频线圈的分类(按作用):激励并接收:体线圈、头颅正交线圈,仅接受(用体线圈激励):表面线圈、相控阵表面线圈(提高信噪比)
体线圈与相控阵线圈所采集图像的对比
线圈特征:
线圈越小,视野越小,信噪比越高
线圈距离组织越近,信噪比越高
单位体积内线圈单位元数越多,信噪比越高
选择原则:
适形:靠近成像组织
适大:略大于目标成像范围,不宜过大
大小适合的适形线圈可获得高信噪比
磁共振的主要线圈系统
以2020年重庆大学附属肿瘤医院引进的西门子MAGNETOM Prisma 3.0T磁共振成像仪为例
最新引进的MAGNETOM Prisma超高梯度可实现2mm高清弥散成像,有最低的震动和噪声水平
最大的临床常用功能就是本身信噪比比较低的弥散成像,梯度场强越高,使临床中最为常用的功能序列弥散成像图像质量获得了大幅度的提升,有助于临床中发现微小病灶,实现早期精准诊断
更低的信噪比,更高的梯度场强
4、磁共振成像脉冲序列
影响组织磁共振信号强度的因素是多种多样的,如组织的质子密度、T1值、T2值、化学位移、液体流动、水分子扩散运动等都将影响其信号强度,如果这些影响因素掺杂在一起,通过图像的信号强度分析将很难确定到底是何种因素造成的信号强度改变,也就是说通过信号的强度的分析很难反映组织特征,这显然对诊断非常不利。我们也可调整成像参数,来确定何种因素对于组织的信号强度及图像的对比起决定性作用
我们可以调整的成像参数主要是射频脉冲、梯度场及信号采集时刻。射频脉冲的调整主要包括带宽(频率范围)、幅度(强度)、何时施加及持续时间等;梯度场的调整包括梯度场施加方向、梯度场场强、何时施加及持续时间等。把射频脉冲、梯度场和信号采集时刻等相关各参数及其在时序上的排列称为MRI的脉冲序列(pulse sequence)
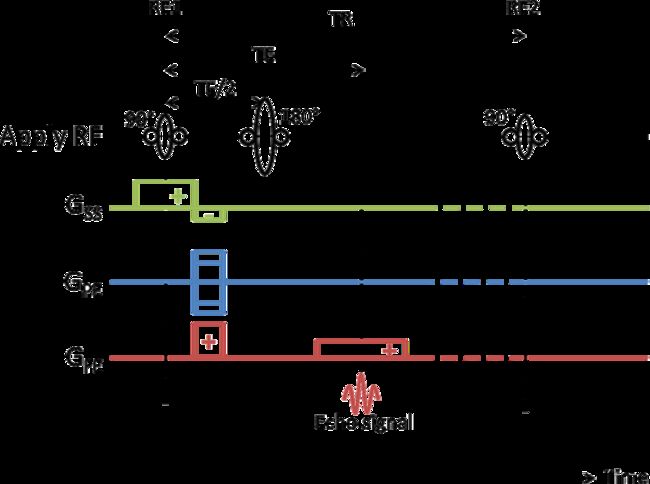
一般的脉冲序列由五个部分构成,即射频脉冲、层面选择梯度场、相位编码梯度场、频率编码梯度场(读出梯度场)及MR信号。在MRI射频脉冲结构示意图中,这五部分一般以从上往下的顺序排列,每一部分在时序上的先后和作用时间一般是从左到右排列的
第一行是射频脉冲,SE序列的射频脉冲光由多次重复的90°脉冲和后随的190°脉冲构成,第二行是层面选择梯度场,在90°脉冲和180°脉冲时施加,第三行是相位编码梯度场,在90°脉冲后180°脉冲前施加,第四行是频率编码梯度场,也称读出梯度场,必须在回波产生的过程中施加,第五行是MR信号
MRI脉冲序列实际上是射频脉冲和梯度场的变化在时序的排列,因此每个脉冲序列都将会有时间相关的概念,主要包括重复时间、回波时间、有效回波时间、回波链长度、回波间隙、反转时间、激励次数、采集时间等
重复时间TR(repetition time)是指脉冲序列相邻的两次执行的时间间隔。在SE序列中TR即指相邻两个90°脉冲中点间的时间间隔;在梯度回波TR是指相邻两个小角度脉冲中点之间的时间间隔;在反转恢复序列和快速反转恢复序列中,TR是指相邻两个180°反转预脉冲中点间的时间间隔;在单次激发序列(包括单次激发快速自旋回波和单词激发EPI)中,由于只有一个90°脉冲激发,TR等于无穷大
MRI脉冲序列实际上是射频脉冲和梯度场的变化在时序的排列,因此每个脉冲序列都将会有时间相关的概念,主要包括重复时间、回波时间、有效回波时间、回波链长度、回波间隙、反转时间、激励次数、采集时间等
重复时间TR(repetition time)是指脉冲序列相邻的两次执行的时间间隔。在SE序列中TR即指相邻两个90°脉冲中点间的时间间隔;在梯度回波TR是指相邻两个小角度脉冲中点之间的时间间隔;在反转恢复序列和快速反转恢复序列中,TR是指相邻两个180°反转预脉冲中点间的时间间隔;在单次激发序列(包括单次激发快速自旋回波和单词激发EPI)中,由于只有一个90°脉冲激发,TR等于无穷大
SE序列(Spin Echo Sequence)
回波时间TE(echo time)是指产生宏观横向磁化矢量的脉冲中点到回波中点的时间间隔。在SE序列中TE指90°脉冲中点到自旋回波中点的时间间隔。在梯度回波中指小角度脉冲中点到梯度回波中点的时间间隔
有效回波时间TE(effective)在快速自旋回波FSE(fast spin echo)序列或平面回波图像EPI(echo planar imaging)序列中,一次射频脉冲激发后有多个回波产生,分别填充在K空间的不同位置,而每个回波的TE是不同的。在这些序列中,把射频脉冲中点到填充K空间中央的那个回波中点的时间间隔称为有效TE
梯度回波序列中的TE,此时参数TE主要决定图像的对比度:TE越长,图像的T2(或T2*)权重越大;TE越短,图像的T2(或T2*)权重越弱。TE越长,得到的磁共振信号就越弱(因为采集时间延后,信号衰减更大了)。TE在磁共振序列中,主要决定图像的T2对比度。如果TE远远大于某种组织的T2时间,则在采集信号的时候,该组织的信号已经完全衰减了,采集不到
回波链长度ETL(echo train length)的概念出现在FSE序列或EPI序列中。ETL是指一次90°脉冲激发后所产生和采集的回波数目。回波链的存在将成比例减少TR的重复次数。在其他成像参数保持不变的情况下,与相应的单个回波的序列相比,具有回波链的快速成像序列的采集时间缩短为原来的1/ETL,因此ETL也称为快速成像序列的时间因子
回波间隙ES(echo spacing)是指回波链中相邻两个回波中点之间的时间间隙。ES越小,整个回波链采集所需时间越少,可间接加快采集速度
快速自旋回波序列中的回波链
反转时间TI(inversion time)仅出现在具有180°反转预脉冲的脉冲序列中。这类序列具有反转恢复序列、快速反转恢复序列、反转恢复EPI序列等。一般把180°反转预脉冲中点到90°脉冲中点的时间间隔称为TI
激励次数NEX(number of citation)也称信号平均次数NSA(number of signal averaged)是指脉冲序列中每一个相位编码步级的重复次数。NEX增加有利于减少伪影并增加图像信噪比,但同时也增加了信号采集时间。一般的序列需要两次以上的NEX,而快速MRI脉冲序列特别是屏气序列的NEX往往是1,甚至小于1(部分K空间技术)
采集时间TA(acquisition time)也称扫描时间,是指整个脉冲序列完成信号采集所需要的时间。在不同序列中TA的差别很大,一幅图像的TA可以在数十毫秒(如单次激发EPI序列),也可以是数十分钟(如SE T2WI序列)
二维MRI的采集时间可以按下式计算:TA=TR×n×NEX;式中TA表示采集时间;TR为重复时间;n为NEX=1时TR需要重复的次数;NEX为激励次数,NEX越大,TR需要重复的总次数越多。对于没有回波链的序列如SE序列或GRE序列,n就是相位编码的步级数,对于具有回波链的序列如FSE或EPI等序列,n等于相位编码步级数除以ETL
三维MRI由于是容积采集,需要增加层面方向的相位编码,容积内需要分为几层则需要进行同样步级的相位编码,因此其采集时间可以按下式计算:TA=TR×n×NEX×S;式中S为容积范围的分层数,其他同二维采集。S越大,TR需要重复的总次数越多
实际上影响TA的因素主要是TR的长短和TR需要重复的总次数
任何脉冲序列在应用中都会设计到空间分辨力的问题,实际上空间分辨力就是指图像像素所代表的实际大小,体素越小空间分辨力越高。空间分辨力受层厚、层间距、扫描矩阵、视野等因素影响
MRI的层厚(slice thickness)是由层面选择梯度场强和射频脉冲的带宽来决定的,在二维图像中,层厚即被激发层面的厚度。厚度越薄,图像在层面选择方向的空间分辨力越高,但由于体素体积变小,图像的信噪比降低。因此在选择层厚的时候既要考虑到空间分辨力,也要考虑到图像信噪比
层间距(slice gap)是指相邻两个层面之间的距离。MRI的层间距与CT的层间距(slice interval)概念不同
CT的层间距是指相邻的两个层面厚度中心的间距,如层厚和层间距均为1cm,实际上一层接着一层,两层之间没有间隔
而MRI时,如果层厚为1cm,层间距为0.5cm,则两层之间有厚度0.5cm的组织没有成像。MR的层面成像是通过选择性的射频脉冲来实现的。由于受梯度场线性、射频脉冲的频率特性等影响,实际上扫描层面附近的质子也会受到激励,这样就会造成层面之间的信号相互影响。我们把这种效应称为层间干扰(cross talk)或层间污染(cross contamination)。为了减少层间污染,二维MRI时往往需要一定的层间距
层间干扰对图像对比的影响
矩阵(matrix)是指MR图像层面内行和列的数目,也就是频率编码和相位编码方向上的像素数目。频率编码方向上的像素多少不直接影响图像采集时间;而相位编码方向的像素数目决定于相位编码的步级数,因而数目越大,图像采集时间越长。MR图像的像素与成像体素是一一对应的。在其他成像参数不变的前提下,矩阵越大,成像体素越少,图像层面内的空间分辨力越高
视野FOV(field of view)是指MRI的实际范围,即图像区域在频率编码方向和相位编码方向的实际尺寸,如30cm×30cm,因而是个面积概念。在矩阵不变的情况下,FOV越大,成像体素越大,图像层面内的空间分辨力降低
二、CEST相关
1、CEST
2、磁化转移效应MTC
3、CEST原理
1、CEST
由于灵敏度的固有限制,与光学和放射方法相比,MRI具需要高浓度的造影剂,大多数用于增强松弛的(超)顺磁性金属在没有螯合或涂层时都是有毒的
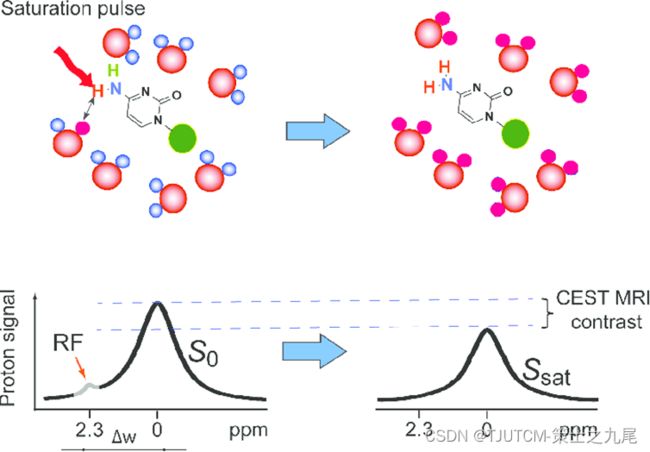
2000 年,Ward和Balaban建议使用可交换质子作为MRI对比剂,这将可能的MR剂范围扩大到包括抗磁性化合物。他们展示了通过使用感兴趣的质子的选择性射频率(RF)饱和来打开和关闭这种对比的可能性,并将这种方法命名为“化学交换饱和转移(CEST)
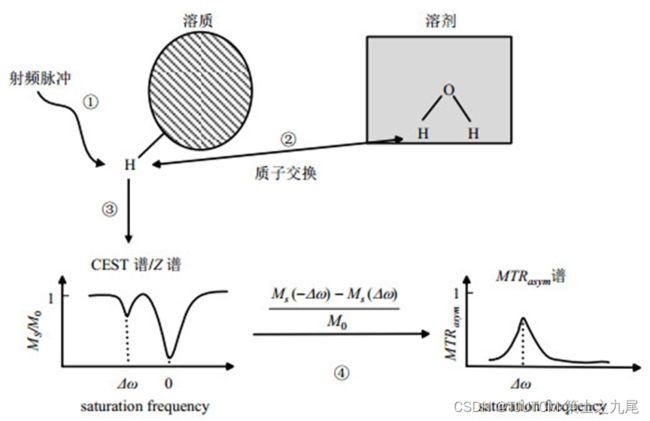
CEST成像技术的原理
CEST-MRI是基于饱和质子与周围流动水中质子交换的体内分子成像技术,结合分子成像和高质量解剖成像,在组织酸碱度成像及多种代谢物成像方面具有独特优势
近10年来CEST-MRI技术发展迅速,除pH成像外,还能检测蛋白质、糖原、葡萄糖等代谢物,用于细胞标记、报告基因等研究。有关心肌CEST研究刚刚起步,在早期诊断缺血性心脏病等诸多心脏疾病、评估心肌纤维化(myocardial fibrosis,MF)等方面显现出优势
药物分子上的可交换质子可以将 RF 饱和转移到周围水的质子(顶行),导致 MRI 信号减少。连续施加射频脉冲会导致更多水质子饱和,从而产生可检测的 MRI 对比,称为化学交换饱和转移 (CEST) 对比
2、磁化转移效应MTC
磁化传递技术或者磁化传递效应是磁共振中一种特殊的技术。该技术可以选择性的抑制组织信号(主要是含蛋白组织),从而达到提高对象对比的目的
这种技术同时也是后面比较高级的化学交换饱和转移CEST(Chemical Exchange Saturation Transfer)及酰胺质子转移成像APT(Amide Proton Transfer)等技术的基础
发射一个偏振频率的脉冲,激发结合水
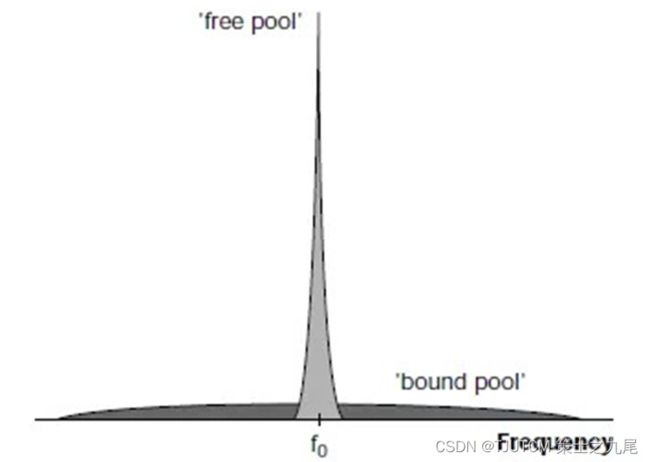
人体组织内水分子存在着几种不同状态:结合水、结构水、自由水。其中,自由运动的水分子被称为自由水,或者又叫自由水池(feel pool);与生物大分子蛋白相结合,运动不自由,被束缚的水分子又被称为结合水,或者又叫做束缚水池(bond pool);结构水又被称为化合水,人体中含量很少
自由水的进动频率范围很窄,其T2值相对较长;而结合水的进动频率范围非常宽,其T2值非常短。正常MR成像中,由于结合水的T2值太短,基本上我们根本采集不到结合水的信号,所以MR成像的时候,结合水基本上不会对信号有所贡献,我们也无法探测到结合水的信号
以自由水的进动频率为中心(设中心为0),结合水由于进动频率范围很宽,基本上是自由水进动频率范围的-2000Hz~+2000Hz
要使质子产生共振,发射的射频脉冲频率要等于质子的进动频率。而结合水的频率范围非常宽,所以我们可以发射一个偏离中心频率很多的频率脉冲,该脉冲会激发结合水而不会影响自由水
我们可以发射一个偏离水中心频率很多的偏振频率off-resonance去激发结合水
提前激发组织可以对某些组织进行饱和作用。但是本来结合水的T2值就非常短,来不及采集信号就衰减了,所以饱和结合水意义不是太大
发射一个偏振频率的脉冲,激发结合水
结合水和自由水交换,导致信号下降
导致磁化传递效应产生的机制
3、CEST原理
CEST是由磁化传递(magnetic transfer,MT)衍生而来的一类新的MRI对比剂技术
CEST是利用特定偏共振饱和脉冲,对外源性或内源性特定物质的氢质子进行充分预饱和。后者可与周围水中的氢质子进行化学交换,导致水分子信号降低;通过测定水分子信号的变化,间接获得人体内的相关信息
化学交换速率与酸碱度直接相关,通过测量内源性或外源性溶质质子的CEST 信号,可对活体组织进行pH成像,从而得到化学交换所处的组织环境信息
CEST成像技术的原理
CEST模型经典的解释为两池模型(自由水池和可交换质子池)。选择性饱和某特定频率处的微量大分子可交换质子池,与自由水中的氢质子进行空间位置的交换,将饱和状态传递到水的氢质子,自由水中氢质子的信号减低,通过对氢质子在自由水中的信号差异进行成像,产生MRI对比度
但是由于机体内组织成分复杂,并且随着CEST扫描技术及分析算法的发展,目前可以用多池拟合模型来更好地解释CEST效应,分别为直接水饱和效应(direct saturation of water,DSW)、酰胺质子转移(amide proton transfer,APT)、核奥氏效应(nuclear Overhauser effect,NOE)、磁化转移效应(magnetization transfer,MT)。依靠标化后的水信号强度(Isat/I0)与饱和脉冲的偏共振频率的关系绘制Z谱图,能更形象地显示不同频率点的自由水信号改变。
结语
经过一年多的学习,我很遗憾地发现:国内MRI文献大多有着条理不清、逻辑混乱的特点,且MRI书籍多面向医学人员,为避免设计物理学原理公式,往往使用大段大段的文字,这种冗长的书籍读起来不仅不能帮助快速入门MRI,反而因为作者大量的个人理解偏差而将读者带入一种假性的认识中(如杨书《磁共振成像技术指南》,完全把傅里叶变换的相位、成像过程中的相位编码通通归为相位,把频率编码归为频率),这对后续的学习研究有百害而无一利。
当然,虽对于临床而言深入了解MRI原理似乎并无多大用处,但对TR、TE、T1加权、T2加权这类常见的名词还是需要牢牢掌握的。
至于文章标签,我是实在找不到相关的。对K空间的数据进行傅里叶转换那块也算是涉及到了一点傅里叶分析的皮毛吧,这里就勉强加上了