求臻医学:肿瘤免疫微环境+RNA:破解免疫治疗单一biomarker困境
臻话RNA | 第7期
近年来,肿瘤精准医疗飞速发展,尤其是ALK、ROS1、RET、NTRK、FGFR等以结构变异为主的靶向药物陆续上市,越来越多患者从中获益。随着RNA-NGS加入,DNA+RNA共检将结构变异的检测性能提升到新的高度。同时,RNA种类繁多、功能复杂,借助RNA-NGS这一强大而灵活的转录组学工具,深度解析免疫微环境,助力免疫治疗策略优化,已取得极大进展……本期,求小臻将带领大家一起了解基于RNA-NGS等方法的肿瘤免疫微环境研究,看其如何破解免疫治疗单一biomarker困境。
免疫治疗已经在多种癌症中显示出强大的治疗潜力和优异的临床效果,改善了患者的生存质量和预后,改变了目前癌症治疗的模式。同时,免疫治疗的机制和靶点也在不断被揭示和发现,为肿瘤免疫治疗的优化和个性化提供了新的思路和方向。其中,肿瘤免疫微环境(TIME)是肿瘤免疫治疗最根本、最重要的影响因素,在临床科研和临床实践中得到越来越多的应用,基于更全面的TIME分析进行个性化治疗策略的制定,或可破解当下PD-L1、TMB、MSI等单个生物标志物在临床应用的中的困境。
1
肿瘤免疫微环境预测免疫疗效
基于免疫微环境特征对肿瘤进行免疫分型由来已久,随着研究的进展,分型方法不断丰富,适用范围也由最初的黑色素瘤逐步扩大到泛实体瘤(图1)。研究者们也不断引进新方法(如:RNAseq技术,单细胞测序技术以及多色免疫组化)进行免疫微环境解码,这些方法均纳入多个生物标志物进行多维度综合分析,较PD-L1表达、TMB等单一指标具有更高的免疫疗效预测能力。
图1. 免疫分型不同阶段[1-6]
免疫反应可以识别、响应并消灭癌细胞。然而,在癌症发展过程中,各种细胞和分子机制发展(尤其是在肿瘤部位),以适应免疫环境的变化,并最终克服免疫攻击,使癌细胞持续生长。这些机制统称为适应性免疫抵抗(adaptive immune resistance,AIR),是癌细胞经过长期适应的结果。陈列平教授团队基于肿瘤免疫微环境(TIME),提出了4种肿瘤亚型,即TIME分类模型(I型:PD-L1-/TILs-;II型:PD-L1+/ TILs+;III型:PD-L1-/TILs+;IV型:PD-L1+/TILs-,图1f),预测肿瘤对抗PD治疗的反应性或耐药性。这四种亚型可能与潜在的AIR机制相关,随着AIR机制新分子途径的发现以及对 TME 中免疫反应状态了解的加深,有望进行更精细的分型[6]。
一项纳入超万例肿瘤患者的研究,通过转录组学分析创建了包含29个功能基因表达特征(Fges)的分类器(图2a),将肿瘤微环境(TME)分为4种亚型:免疫富集-纤维化(IE/F),免疫富集-非纤维化(IE),纤维化(F),免疫耗竭(D),并且4种亚型在24种癌种中均保守存在。其中,IE/F亚型与血管生成和肿瘤相关成纤维细胞(CAFs)激活相关的Fges高表达;IE亚型特征是具有高水平的免疫浸润,表现出比IE/F亚型更强的免疫活性微环境,同时,该亚型突变负荷最高,CD8+T细胞/ Tregs和M1/M2巨噬细胞的比例最高;F和D亚型,具有最小比例或完全缺乏白细胞/淋巴细胞浸润。在IE/F和IE亚型中,接受抗CTLA-4治疗的黑色素瘤患者(N=58)有响应人群占比82%,而F亚型仅有10%。在接受抗PD-(L)1治疗的膀胱癌患者中,IE亚型ORR为38%,远高于F亚型(<10%)(图2b,c) [7]。
图2. a.基于转录组学的TME分型;b.四种 TME 亚型接受抗 PD-L1 治疗的膀胱癌患者中 CR、PR、SD 和 PD 的百分比;c. 四种TME 亚型接受抗 PD-L1 治疗的膀胱癌患者的 OS
Ayers等人经过严格的多步骤验证过程,筛选18个T细胞炎性基因,计算T细胞炎性基因表达谱评分(GEP score,也有报道称为TIS score),在头颈鳞癌、胃癌、黑色素瘤等多种实体瘤中预测了帕博利珠单抗治疗的反应,可对响应人群和无响应人群进行分层。相关内容在肿瘤免疫微环境+RNA: 免疫治疗寻根探源一期中也进行了详细介绍。
免疫微环境对晚期非小细胞肺癌免疫联合化疗治疗方案的选择具有重要指导价值。根据KEYNOTE-189发布的数据来看,不同PD-L1的表达水平,免疫联合化疗与安慰剂加化疗方案相比,生存曲线之间差异并不明显,因此不难看出,PD-L1表达水平对免疫联合用药疗效预测效果不佳(图3)。今年3月份张力教授团队发表于国际知名肿瘤学期刊《胸部肿瘤期刊》上的最新研究(ORIENT-11),在免疫联合化疗疗效预测方面取得了重要进展。
图3. KEYNOTE-189临床试验数据
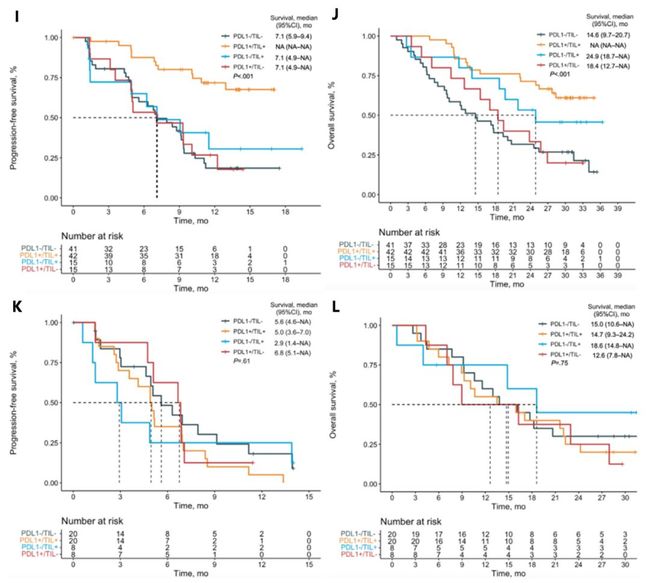
这是一项III期随机对照临床试验,基于RNA测序和免疫组化技术,使用ESTIMATE计算的免疫评分和PD-L1 mRNA这两个指标优化了TIME分类模型,并按照中位数来划分高低表达,优化后的分类表述仍与前文中的TIME分类相同。比较免疫联合化疗组与化疗组,仅II型(高免疫评分且高PD-L1 mRNA表达)PFS(HR = 0.12, 95% CI: 0.06–0.25,p < 0.001,图4B)和 OS(HR = 0.27, 95% CI:0.13–0.55,p < 0.001, 图4F)具有统计学意义的改善。
在联合治疗组中,II型生存时间要长很多,中位PFS跟OS均尚未达到,其他三个亚型PFS非常接近(I型: 7.1个月; III型: 7.1月; IV型: 7.1月,图4I,J),并且II型具有最高的ORR(I-IV型分别为56.1%,85.7%, 53.3%,60.0%);在化疗组中,不同亚型PFS和OS均没有显著差异(图4K,L)。
该项研究表明PD-L1表达联合TIME综合分型模型可有效预测晚期NSCLC患者免疫治疗联合化疗的疗效,对于那些缺乏PD-L1表达或免疫浸润的患者,单独化疗治疗将是更好的选择,以避免不必要的毒性和经济负担 [8]。
图4. 基于TIME分类模型的联合组与化疗组的生存比较分析 ( A-D ) 分别为TIME I型-IV型联合组与化疗组 PFS 比较;(E-H)分别为 TIME I型-IV型联合组与化疗组OS比较;( I,J ) 接受联合治疗TIME各亚型的患者的 PFS,OS;( K,L ) 接受化疗TIME各亚型的患者的 PFS,OS
2
肿瘤免疫微环境揭示
放化疗后PD-L1抑制剂的耐药机制
在同步放化疗后,采用PD-L1抑制剂度伐利尤单抗单抗进行巩固治疗的PACIFIC方案已成为不可切除 III 期非小细胞肺癌 (NSCLC) 患者的标准治疗方案。然而,约一半接受治疗的患者会在1年内出现疾病进展,目前耐药机制尚不明确。
WJOG11518L/SUBMARINE研究,通过免疫组织化学、转录组测序、治疗前肿瘤组织基因组测序以及循环免疫细胞流式细胞术等技术方法,对肿瘤微环境进行全面分析,探索与PACIFIC方案耐药相关的特定TME概况。研究结果显示,无论基因组特征如何,肿瘤中预先存在有效适应性免疫对治疗获益的极其重要。另外,研究还发现癌细胞表达CD73是对PACIFIC方案的一种抵抗机制。以关键临床因素为协变量的免疫组化数据的多变量分析表明,CD8+肿瘤浸润淋巴细胞(TILs)密度低和CD73+癌细胞高与度伐利尤单抗预后差独立相关(HR, 4.05 [95% CI, 1.17-14.04];CD73为4.79 [95% CI, 1.12-20.58],图5)[9]。
图5. 多变量分析
3
总结
尽管目前已鉴定出多个免疫治疗预测因子,但临床数据表明,任何单一预测生物标志物均存在局限性,不能高效识别获益人群。原因在于不同的瘤种免疫微环境差异较大,导致了治疗应答的差异。通过对肿瘤微环境的分析和分类,深度挖掘肿瘤诱导的适应性免疫抵抗(AIR)机制,为药物研发及肿瘤治疗策略优化增加助力。利用联合检测或建立有效预测模型全面解码肿瘤患者的免疫状态,可能是未来免疫治疗的重要发展方向。
参考文献:
[1] Sznol M, Chen L. Antagonist antibodies to PD-1 and B7-H1 (PD-L1) in the treatment of advanced human cancer. Clin Cancer Res. 2013 Mar 1;19(5):1021-34. doi: 10.1158/1078-0432.CCR-12-2063.
[2] Teng MW, Ngiow SF, Ribas A, Smyth MJ. Classifying Cancers Based on T-cell Infiltration and PD-L1. Cancer Res. 2015 Jun 1;75(11):2139-45. doi: 10.1158/0008-5472
[3] Kim JM, Chen DS. Immune escape to PD-L1/PD-1 blockade: seven steps to success (or failure). Ann Oncol. 2016 Aug;27(8):1492-504. doi: 10.1093/annonc/mdw217
[4] Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature. 2017 Jan 18;541(7637):321-330. doi: 10.1038/nature21349.
[5] Galon J, Bruni D. Approaches to treat immune hot, altered and cold tumours with combination immunotherapies. Nat Rev Drug Discov. 2019 Mar;18(3):197-218. doi: 10.1038/s41573-018-0007-y
[6] Kim TK, Vandsemb EN, Herbst RS, Chen L. Adaptive immune resistance at the tumour site: mechanisms and therapeutic opportunities. Nat Rev Drug Discov. 2022 Jul;21(7):529-540. doi: 10.1038/s41573-022-00493-5
[7] Bagaev A,et al. Conserved pan-cancer microenvironment subtypes predict response to immunotherapy. Cancer Cell. 2021 Jun 14;39(6):845-865.e7. doi: 10.1016/j.ccell.2021.04.014.
[8] Sun D,et al. Classification of Tumor Immune Microenvironment According to Programmed Death-Ligand 1 Expression and Immune Infiltration Predicts Response to Immunotherapy Plus Chemotherapy in Advanced Patients With NSCLC. J Thorac Oncol. 2023 Jul;18(7):869-881. doi: 10.1016/j.jtho.2023.03.012.
[9] Haratani K, et al. Tumor microenvironment landscape of non-small cell lung cancer reveals resistance mechanisms for PD-L1 blockade following chemoradiotherapy: a multi-center prospective biomarker study (WJOG11518L/SUBMARINE). J Thorac Oncol. 2023 Jun 24:S1556-0864(23)00633-0. doi: 10.1016/j.jtho.2023.06.012.