Microbiome|长江惊现抗生素耐药性的超级人类致病菌!
发表期刊:Microbiome
发表时间:2022
影响因子:15.5
DOI: 10.1186/s40168-022-01294-z
研究背景
由于全世界各地广泛使用抗生素从而加速了抗生素耐药基因(ARGs)及其宿主的传播。携带单个/多个ARGs的耐药微生物(ARMs)可通过接触或进入食物链感染人类,并可能引发严重感染和高死亡率的公共卫生风险。过去,人们重点关注的是ARGs与人类肠道微生物之间的相关关系,而近年来,研究内容已经逐渐向人为生态系统或者复杂的自然生态系统,例如污水处理厂、水库、河流等。在一些研究中,根据各种环境因素和人类活动,已经确定了某些河流ARGs和宿主。尽管如此,目前对河流系统中ARGs与核心微生物群之间关系的理解还不够深入。
研究方法
本研究于2014年3月和10月在49个沿长江主流支流和主要支流水文监测站同步采集水体和沉积物样本,进行相关理化因子检测和宏基因组测序以及宏基因组组装基因组(MAGs)分析。
图1 研究区域
主要结果
1、长江中的ARGs组成以及宿主分析
长江中的ARGs包括31种主要types和2195个subtypes,其中最多样化的ARGs types是β-内酰胺抗性基因(图2)。水体和沉积物中的最常见的ARGs subtypes为uppP,drfE,macB抗性基因,平均丰度为18.9%,11.2%和9.8%。
图2 长江水体和沉积物样本中ARGs组成和相对丰度
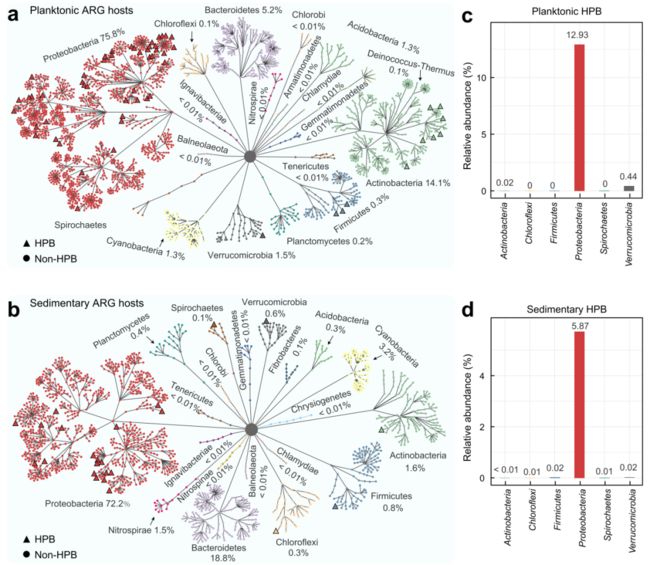
水体中ARG宿主多样性在水体(1408种)明显高于沉积物(796种),大多数浮游生物的ARG宿主多为变形菌门(75.8%)、放线菌门(14.1%)和拟杆菌门(5.2%)(图3a),而沉积物ARG宿主主要与变形菌门(72.2%)和拟杆菌门(18.8%)相关(图3b)。在长江的水体(56种)和沉积物(24种)中分别鉴定出了65个携带ARGs的HPB(人类致病菌)。
图3 长江水域(a)和沉积物(b)中ARG宿主的分类学分析
2、ARGs和ARG宿主的潜在水平基因转移
为了进一步评估ARGs的潜在迁移率,本研究分析了特异性MGEs和ARGs的共现情况。虽然检测到多种MGEs与ARGs共定位,但长江中携带MGEs的ACCs(ARG-carrying contigs)很少(1568),占所有检测到的ACCs的1.23%。
3、ARGs与细菌群落之间的关系
普氏分析结果表明,水体和沉积物中ARG丰度与微生物组成之间具有显著相关性。对单个HPB携带多个ARGs可能性进行分析,发现了21个HPB超级载体,这21个超级载体携带79种具有多个ARG subtypes的组合,主要包括2种ARG(56种组合)(图4c)。
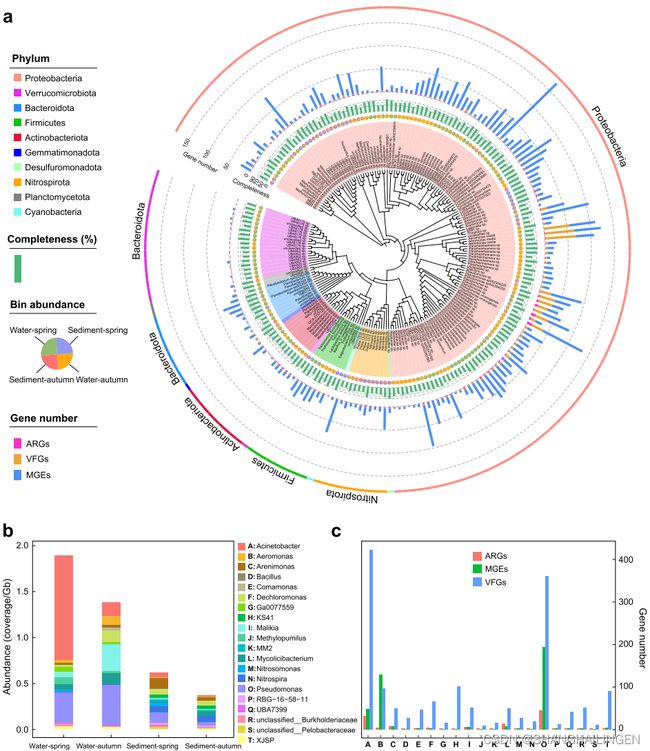
在长江中共鉴定出199个携带ARGs的宏基因组组装基因组(MAGs),这些基因组被划分为10个门,其中变形菌门、疣微菌门、拟杆菌门、放线菌门和硝化螺旋菌门是优势门(图5a)。一些细菌同时表现出可能的多重抗生素耐药性和致病性特征,共有61个MAGs含有至少两个ARGs(图4b)。77%的MAGs,主要注释为不动杆菌属、假单胞菌和Malikia,表现出了携带至少一种VFGs(毒力因子基因)的明显倾向,表明这些具有多重抗性的环境细菌可能在河流中具有相当大的致病性(图5c)。
图4 长江4个采样群在(a)门和(b)属水平上的HPB组成
4、ARGs和宿主的生物地理模式
长江流域水体和沉积物中ARG组成没有明显的距离衰减(图6a-b),尽管ARG宿主的群落相似性随地理距离而显著降低(图6c-d)。有趣的是,浮游生物和沉积物的HPB均表现出与ARG组成相似的温和距离衰减关系(图6e-f)。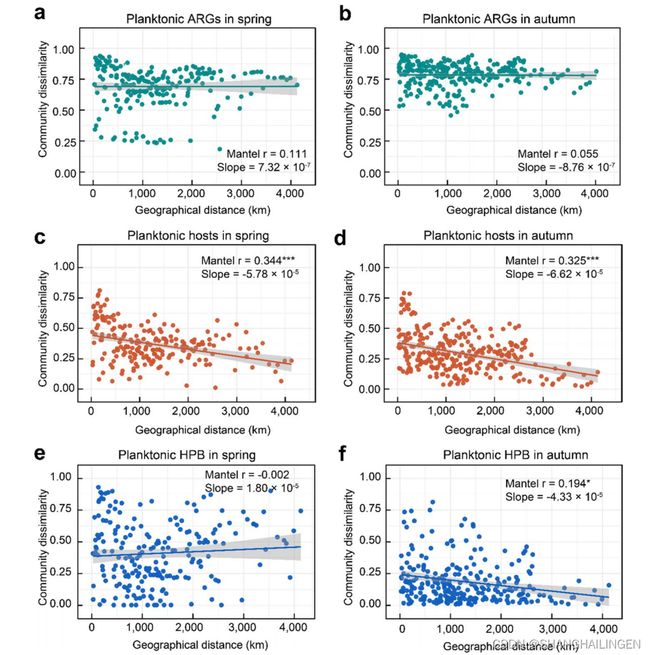
图6 ARGs和HPB群落相似性与地理距离之间的相关性分析
5、抗生素耐药性的驱动力
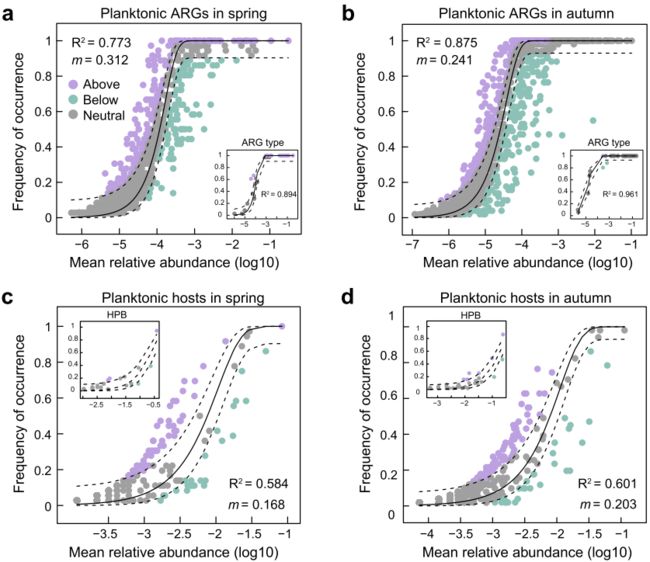
为了解释长江中ARG丰度特征,将ARG的发生频率转化为一个包含随机扩散和漂移过程影响的中性模型。中性模型较好地描述了浮游生物ARG subtypes(图7a-b)和沉积物ARG subtypes。与ARGs相比,水体和沉积物中ARG宿主对中性模型的拟合度略差(图6c、d)。根据中性模型估计的迁移率(m),由于HPB携带多个ARGs,微生物宿主的随机扩散可能低于ARGs。然而,HPB本身很难用中性模型来描述(图7c-d),因为HPB作为假定的功能类群的数量不全面和不确定,导致了预测HPB的迁移率(m)的差异。
通过PLS-PM分析,探讨了空间变量、人为变量、理化变量、抗生素、MGEs和ARG宿主/HPB对长江ARG的直接和间接影响。结果表明,以水温为代表的物化变量对水体和沉积物ARG组成的正总标准化效应最大,而空间变量与沉积ARG的相关性显著(图8)。
图7 中性模型分析
图8 PLS-PM分析以及各因素各因素对水体(c)和沉积物(d)中ARG组成的标准化总影响
研究结论
综上所述,本研究证实了陆生人类致病菌(HPB)是河流中主要的ARG宿主,而不是传统的超级携带者(例如,肠球菌属和其他粪便指示细菌)。全球大型河流中HPB作为天然超级载体的发现,不仅解释了ARGs与其宿主的空间差异性之间的不一致性,也凸显了未来全球河流生态系统ARGs相关风险管理中控制陆地HPB的重中之重。
参考文献
Supercarriers of antibiotic resistome in a world’s large river. Microbiome, 2022.