第一次细胞生物学实验
第一次细胞生物学实验
文章目录
- 前言
- 一、细胞的基本形态结构和显微测量
-
- 1.1. 实验目的
- 1.2. 实验原理
-
- 1.2.1. 标定
- 1.2.2. 实际测量
- 1.3. 实验材料
- 1.4. 实验步骤
- 1.5. 实验结果与讨论
-
- 1.5.1. 提供人和蛙的两种红细胞的照片并分别描述形态特征。
- 1.5.2. 记录两种细胞的大小并计算平均值,最后的大小表示成平均值±标准差。注意保留1位小数。
- 1.5.3. 请查阅文献或网上资料,比较不同物种的红细胞有何不同。
- 二、叶绿体的提取和观察
-
- 2.1. 实验目的
- 2.2. 实验原理
-
- 2.2.1. 差速离心提取
- 2.2.2. 观察
- 2.3. 实验仪器、材料和试剂
- 2.4. 实验步骤
-
- 2.4.1. 叶绿体分离及观察
- 2.4.2. 菠菜叶切片观察
- 2.4.3. 荧光显微镜观察
- 2.5. 实验结果及分析
-
- 2.5.1. 实验结果
- 2.5.2. 实验分析
- 总结
前言
在学习生物的过程中,熟练掌握各种生物实验方法是必须的,本系列文章,将主要记录做细胞生物学实验的笔记,便于以后的再度查看。
本章主要讲述两个实验:
- 细胞的基本形态结构和显微测量
- 叶绿体的提取与观察
一、细胞的基本形态结构和显微测量
1.1. 实验目的
-
准确描述显微测量计的基本原理
-
准确使用显微测量计测量细胞大小。
-
能准确描述并比较细胞大小。
1.2. 实验原理
在显微镜下用来测量细胞长度的工具叫显微测量计。由目镜测微尺和镜台测微尺组成,两尺要配合使用
目镜测微尺安装:
1.2.1. 标定
目镜测微尺的每小格的刻度= (镜台测微尺的格数×10 μm)÷目镜测微尺的格数
把镜台测微尺置于载物台上,刻度朝上。先用低倍镜观察,对准焦距,视野中看清镜台测微尺的刻度后,转动目镜,使目镜测微尺与镜台测微尺的刻度平行,移动推动器,使两尺重叠,再使两尺的“0”刻度完全重合,定位后,仔细寻找两尺第二个完全重合的刻度,计数两重合刻度之间目镜测微尺的格数和镜台测微尺的格数。
1.2.2. 实际测量
在测量细胞时,移去镜台测微尺,换上被测标本,用目镜测微尺即可测得观察标本的实际长度。
1.3. 实验材料
1、仪器、用具:
显微镜、目镜测微尺、镜台测微尺
2、材料:蛙血涂片、人血涂片
1.4. 实验步骤
前面已经进行了标定,接下来直接观察血涂片
-
放上血涂片,调整放大倍数,找到清晰的细胞。用目镜测微尺测量细胞所占目镜测微尺的小格数。
-
计算血细胞的实际长度:
血细胞实际长度=目镜测微尺每小格实际长度细胞所占目镜测微尺的小格数 -
每一种被测物体(细胞)需反复测量几个或几十个,采用其平均值
1.5. 实验结果与讨论
1.5.1. 提供人和蛙的两种红细胞的照片并分别描述形态特征。
示例图片(上蛙下人):
可以看出蛙血的细胞椭圆明显且比较大,而人血细胞比较小且为圆形
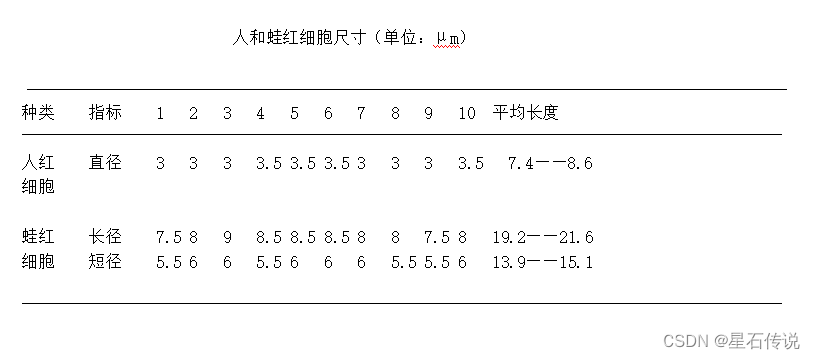
1.5.2. 记录两种细胞的大小并计算平均值,最后的大小表示成平均值±标准差。注意保留1位小数。
每格的大小: 2*10/8 = 2.5微米
#人血细胞
x <- c(3,3,3,3.5,3.5,3.5,3,3,3,3.5)
ren_mean <- mean(x) *2.5
x <- x*2.5
ren_sd <- sd(x)
round(ren_mean+ren_sd,1)
round(ren_mean-ren_sd,1)
#结果:
> round(ren_mean+ren_sd,1)
[1] 8.6
> round(ren_mean-ren_sd,1)
[1] 7.4
#蛙血细胞
y <- cbind(c(7.5,8,9,8.5,8.5,8.5,8,8,7.5,8),c(5.5,6,6,5.5,6,6,6,5.5,5.5,6))
y <- y*2.5
colnames(y) <- c("长度","宽度")
wai_mean <- apply(y,2,mean)
wai_sd <- apply(y, 2, sd)
round(wai_mean+wai_sd,1)
round(wai_mean-wai_sd,1)
#结果:
> y
长度 宽度
[1,] 18.75 13.75
[2,] 20.00 15.00
[3,] 22.50 15.00
[4,] 21.25 13.75
[5,] 21.25 15.00
[6,] 21.25 15.00
[7,] 20.00 15.00
[8,] 20.00 13.75
[9,] 18.75 13.75
[10,] 20.00 15.00
> wai_mean <- apply(y,2,mean)
> wai_mean
长度 宽度
20.375 14.500
> wai_sd <- apply(y, 2, sd)
> round(wai_mean+wai_sd,1)
长度 宽度
21.6 15.1
> round(wai_mean-wai_sd,1)
长度 宽度
19.2 13.9
1.5.3. 请查阅文献或网上资料,比较不同物种的红细胞有何不同。
不同物种的红细胞在结构和功能上有一些差异。以下是一些常见物种的红细胞比较:
-
人类红细胞:人类红细胞呈现出典型的双凹型,直径约为7-8微米。它们没有细胞核和细胞器,并且寿命相对较短,约为120天。人类红细胞的主要功能是运输氧气和二氧化碳。
-
狗和猫红细胞:狗和猫的红细胞也是双凹型的,直径相对较小,约为5-7微米。它们也没有细胞核和细胞器。狗和猫的红细胞寿命约为110天。
-
鸟类红细胞:鸟类的红细胞形状多样,可以是椭圆形、椭圆形或卵圆形。它们的直径通常小于人类和哺乳动物的红细胞,约为1.5-6微米。鸟类红细胞通常具有细胞核,但非常小。鸟类红细胞的寿命相对较短,约为30-45天。
-
鱼类红细胞:鱼类的红细胞通常是圆形或卵圆形,直径约为1-5微米。它们没有细胞核,但可能具有其他细胞器。鱼类红细胞的寿命相对较短,约为20-60天。
总的来说,不同物种的红细胞在形状、大小、细胞核和寿命等方面存在一些差异,这些差异反映了它们适应不同环境和功能的需求。
二、叶绿体的提取和观察
2.1. 实验目的
1、通过植物细胞叶绿体的分离,了解细胞器分离的一般原理和方法。
2、观察叶绿体的自发荧光,并熟悉荧光显微镜的使用方法。
2.2. 实验原理
2.2.1. 差速离心提取
采用逐渐增加离心速度或低速和高速交替进行离心,使沉降速度不同的颗粒在不同的分离速度及不同的离心时间下分批分离的方法。
叶绿体的分离应在等渗溶液(0.35 mol/l氯化钠或0.4 mol/l蔗糖溶液)中进行,以免渗透压的改变使叶绿体受到损伤。
将匀浆液在1 000 rpm的条件下离心2min,以去除其中的组织残渣和一些未被破碎的完整细胞。然后,在3 000 rpm的条件下离心5min,即可获得沉淀的叶绿体(混有部分细胞核)。
分离过程最好在0~5℃的条件下进行;如果在室温下,要迅速分离和观察。
2.2.2. 观察
有些生物体内的物质受激发光照射后可直接发出荧光,称为自发荧光,如叶绿素的火红色荧光。有的生物材料本身不发荧光,但它吸收荧光染料后同样也能发出荧光,这种荧光称为次生荧光,如叶绿体吸附吖啶橙后可发桔红色荧光。
荧光显微术是利用荧光显微镜对可发荧光的物质进行观察的一种技术。
利用荧光显微镜对可发荧光的物质进行检测时,将受到许多因素的影响,如温度、光、淬灭剂等。因此在荧光观察时应抓紧时间,有必要时立即拍照。
2.3. 实验仪器、材料和试剂
- 器材:研钵、离心机、TI-S研究级倒置荧光显微镜。
20或50 ml烧杯、1.5 ml离心管、纱布若干、 滴管、无荧光载玻片和盖片。 - 材料:新鲜菠菜。
- 试剂:
0.35 mol/l氯化钠溶液
2.4. 实验步骤
2.4.1. 叶绿体分离及观察
-
选取1-2片新鲜的嫩菠菜叶,洗净擦干后去除叶梗及粗脉,装入研钵中,再加10 ml 0.35 mol/l NaCl溶液,然后利用研钵将菠菜叶彻底研磨。
-
将组织研磨液用6层纱布过滤于烧杯中,取1 ml滤液于1.5 ml离心管中,1 000 rpm下离心2min。弃去沉淀
-
将上清液在3 000 rpm下离心5min。弃去上清液,沉淀即为叶绿体(混有部分细胞核)。
-
将沉淀用0.35 mol/l NaCl溶液悬浮。取叶绿体悬液一滴滴于载片上,加盖片后。先在普通光学显微镜下调整叶绿体密度。
2.4.2. 菠菜叶切片观察
用剃须刀将新鲜的嫩菠菜叶切削一斜面置于载片上,滴加1-2滴0.35mol/l NaCl溶液,加盖片后轻压,先用普通显微镜观察,确保单层细胞。
也可以用徒手撕表皮,确保单层细胞。观察方法同上
2.4.3. 荧光显微镜观察
① 在普通光镜下观察。
② 在荧光显微镜下观察。
实验中用到的TI-S研究级倒置荧光显微镜,该显微镜配备了三种荧光滤光块。分别为“UV-2A”、“FITC” 、“TRITC”。
根据叶绿体荧光波长,选择“UV-2A”进行观察
2.5. 实验结果及分析
2.5.1. 实验结果
提供观察结果如下4种,并如实并简练描述观察到的现象。
1)普通光镜观察:分离的菠菜叶绿体;

2)荧光观察:分离的菠菜叶绿体;
3)普通光镜观察:菠菜叶片表皮各种细胞中的叶绿体;同时需要观察观察的细胞类型;
4)荧光观察:菠菜叶片表皮各种细胞中的叶绿体。
2.5.2. 实验分析
1、叶绿体分离的实验原理是什么?在分离叶绿体时应注意些什么问题?
叶绿体分离的实验原理是利用离心和梯度离心技术将叶绿体从细胞中分离出来。这种方法基于叶绿体在密度梯度离心过程中的不同沉降速度
分离叶绿体时应注意:实验材料的新鲜度、温度控制、离心条件。
2、在荧光显微镜下观察叶绿体的自发荧光时,更换滤片系统,叶绿体的颜色是否有变化
在荧光显微镜下观察叶绿体的自发荧光时,更换滤片系统可以改变观察到的叶绿体的颜色。
(滤片系统通常包括激发滤光片和发射滤光片。激发滤光片选择性地透过特定波长的光来激发叶绿体的荧光,而发射滤光片则选择性地透过特定波长的荧光光来观察。更换滤片系统可以改变透过的波长范围,从而改变观察到的叶绿体的颜色)
3、游离叶绿体和整体细胞内的叶绿体,在荧光显微镜下,其颜色和强度有无差异?为什么?
游离叶绿体和整体细胞内的叶绿体在荧光显微镜下观察时,其颜色和强度可能会有差异。这是因为游离叶绿体通常处于更加纯净的环境中,没有其他细胞器的干扰,因此其荧光信号可能更强。此外,游离叶绿体可能具有不同的代谢状态,导致荧光颜色的差异。整体细胞内的叶绿体受到其他细胞器的包围和相互作用,可能会受到局部环境的影响,从而导致荧光颜色和强度的差异。
总结
本次的实验基本了解了一下如何观察细胞大小,并且如何对叶绿体进行提取并用荧光显微镜观察。
朝辞白帝彩云间,千里江陵一日还。
–2023-9-27 生物技术篇