端粒/端粒酶生信切入点,6+端粒酶+泛癌+甲基化+实验。
今天给同学们分享一篇端粒酶+泛癌+甲基化+实验的生信文章“Genomic, epigenomic, and transcriptomic signatures for telomerase complex components: a pan‐cancer analysis”,这篇文章于2022年10月31日发表在Mol Oncol期刊上,影响因子为6.6。

激活端粒酶是恶性转化所必需的。最近高通量技术的进展使得生成复杂数据集成为可能,从而提供了更全面探索端粒酶生物学的替代方法,这是由于需要繁琐的检测端粒酶活性的实验所带来的挑战。
1. 在33种癌症类型中,10个端粒酶组分的表达谱
除了核心端粒酶组分TERT和TERC之外,作者还包括以下端粒酶辅助因子进行分析:(a)与端粒酶核心TERT和TERC稳定结合的DKC1、NHP2、NOP10、TCAB1和GAR1 [8],以及(b)复合物中提供端粒酶活性所需ATP的三种ATP酶pontin、reptin和NVL [18, 35] (图1A)。作者首先计算了这10个基因在21种癌症类型的肿瘤和相邻正常组织(NTs)之间的表达水平差异,其中至少有3个NT样本可用。通过这样做,作者观察到肿瘤中TERT水平最为显著和广泛地增加,除了甲状腺乳头状癌(THCA)外,其他20/21种癌症类型都出现了这种情况(图1B)。TERC表达的上调在15/21种癌症类型中被发现,而在甲状腺乳头状癌(THCA)中则有明显的降低。八个端粒酶辅助因子的水平在大多数肿瘤中较高,但程度要小得多。在TERT上调显著的癌症类型中,其他端粒酶组分的水平通常也会增加(图1B)。
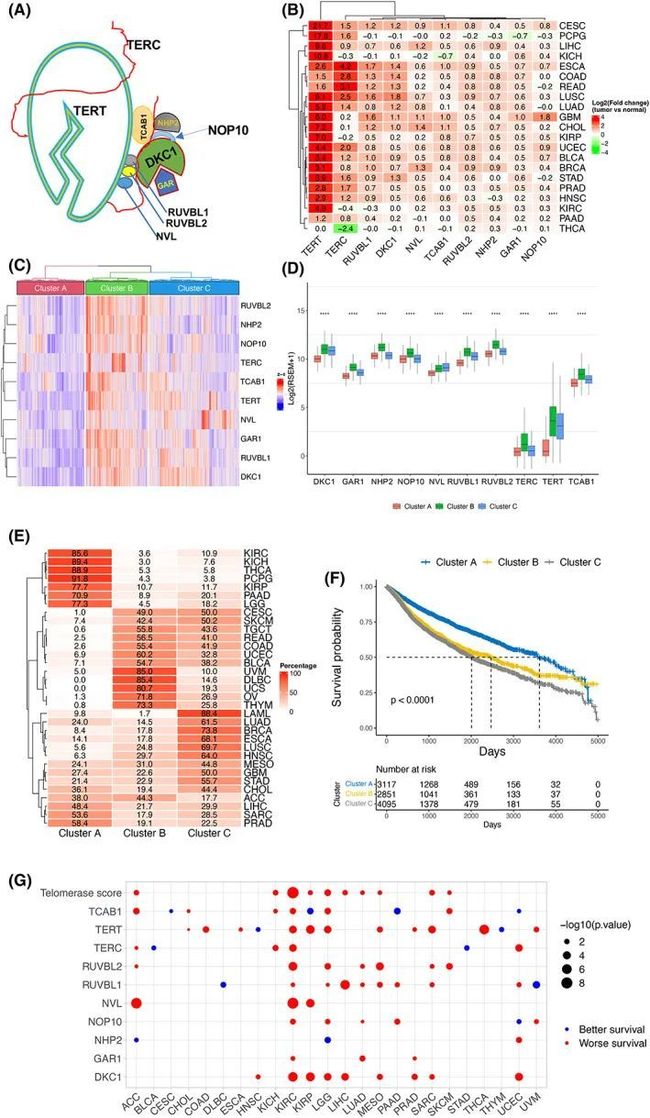
图1 基于端粒酶组分表达的全癌分层及与患者生存率的关联
2. 基于端粒酶组分表达的全癌分层及与患者生存率的关联。
大多数癌症类型中,10个端粒酶组分的水平上调,但观察到显著的异质性(图1B)。为了比较,作者利用“端粒酶评分”(TS)作为10个端粒酶组分在每个样本中的表达水平,来表示这10个基因的整体水平。根据对所有肿瘤标本进行的无监督层次聚类,作者很容易地确定了三个明显的聚类:聚类A和B(TS-CA和TS-CB),分别表示TS或所有10个端粒酶基因的最低和最高表达水平,而聚类C(TS-CC)则表示这些10个基因之间的表达水平不一致的中间亚型(图1C)。进一步的比较表明,除了NVL外,所有10个端粒酶组分在TS-CB中的表达最高,而在TS-CA亚型中最低(图1D)。值得注意的是,大多数KIRC、KICH、KIRP、THCA、PCPG、PADD和LGG,以及超过一半的PRAD和SARC属于TS-CA亚型,而TS-CB主要由DLBC、UVM、UCS、OV、THYM和UCEC组成(图1E)。大多数STAD、GBM、HNSC、LUSC、ESCA、BRCA、LUAD和LAML属于TS-CC亚型(图1E)。BLAC,COAD,READ,TGCT,SKCM和CESC在TS‐CB和TS‐CC亚型之间几乎均匀分布,而ACC样本的数量在TS‐CA和TS‐CB聚类中几乎相同(图1E)。揭示了相同癌症类型中10个端粒酶组分和TS的异质性。
作者进一步评估了这三个TS-簇是否能够预测患者的预后。首先,在不同癌症类型中比较了三个亚型的患者总生存期(OS)。如图1F所示,TS-CA亚型的患者具有最长的OS(P < 0.0001),与TS-CB和TS-CC亚型相比。TS-CB和TS-CC亚型对OS的影响相似。接下来,在每种肿瘤类型内进行了比较,并发现在33种癌症类型中,TS水平较高与较差的生存率之间存在显著关联(图1G)。最后,作者确定了10个个体因素对OS的影响,并观察到DKC1、NVL和GAR1的高表达与分别9种、3种和3种癌症类型显著相关(图1G)。其余七个因素的水平与OS的关联要么是正向的,要么是负向的,具体取决于肿瘤类型(图1G)。综上所述,较高的TS是预测较短OS最一致的变量。
3. TS与干细胞特性、增殖能力和上皮间质转化标志物在不同癌症类型中的相关性
接下来,作者试图确定高TS组中患者存活率较低的表型基础。使用EXTEND估计的端粒酶活性与癌症干细胞性和增殖显著相关,因为这两个特征通常代表肿瘤行为的侵袭性。因此,作者评估了它们与TS之间的关系。先前发表的癌症干细胞性指数被用来计算干细胞性得分,作者观察到总体上TS与干细胞性得分之间存在强烈的正相关(R = 0.66,P < 2.2 e‐16),而TS-CB亚型得分最高(图2A、B)。此外,除了PCPG和LGG(31/33)之外,所有癌症类型都显示出显著的相关性(图2C)。对于增殖,作者使用Ki67作为特定标记,并分析其与TS之间的关系。Ki67 mRNA的丰度与所有癌症类型的TS显著相关(R = 0.54,P < 2.2 e‐16)(图2D)。在每个癌症类型的大多数队列中,相关性仍然非常显著(R = 0.73,P = 3.4 e‐06)(图2E)。
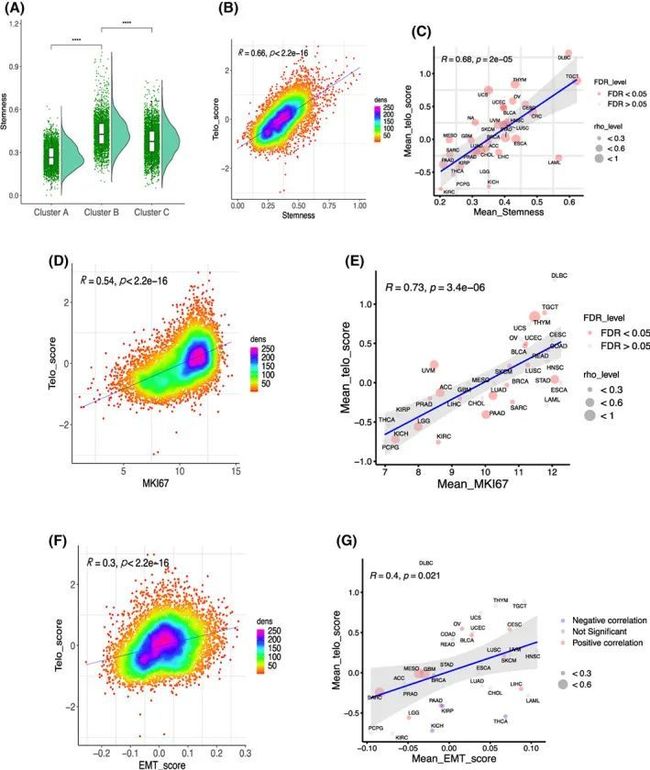
图2 TS-亚型与干细胞特性、增殖能力和上皮-间质转化(EMT)表型在不同癌症类型中的关联
由于癌症干细胞性常常与EMT相关,作者进一步评估了TS和EMT得分之间的关系。泛癌EMT得分是使用16个EMT基因签名计算的。泛癌中的TS和EMT得分呈显著正相关(图2F)。对于各个癌症类型的分析,TS与EMT得分在15种癌症类型中呈显著相关,而在14种癌症类型中不显著(图2G)。其中有四种癌症(KIRP、KICH、THCA和PRAD)呈反向相关(图2G)。
4. 基于TS的亚型之间存在不同的生物通路富集
为了描述三种TS亚型不同表型背后的生物和分子差异,作者进行了GSEA分析。通路与TS之间的强正相关性包括MYC和E2F靶点、G2M检查点和MTORC1信号通路(图3A、B)。所有这些富集的通路标志着癌细胞高增殖活性和干细胞特性,这与上面观察到的TS与Ki67数量/干细胞标志物的正相关性一致。有趣的是,氧化磷酸化和糖酵解通路与TS呈正相关(图3A、B)。此外,高TS组中富集了脂肪酸代谢和脂肪生成通路。此外,大多数癌症类型中,DNA修复和蛋白质展开反应与较高的TS呈显著正相关。另一方面,TS与炎症和免疫应答通路呈负相关,包括TNFα通过NF-κB、IL6-STAT3、IL2-STAT5、TGFβ和补体信号通路。令人意外的是,在23/33种癌症类型中观察到TS与EMT呈负相关(图中未完)。与泛癌分析中观察到的正相关相反,3A、B)呈现负相关(图2G)。
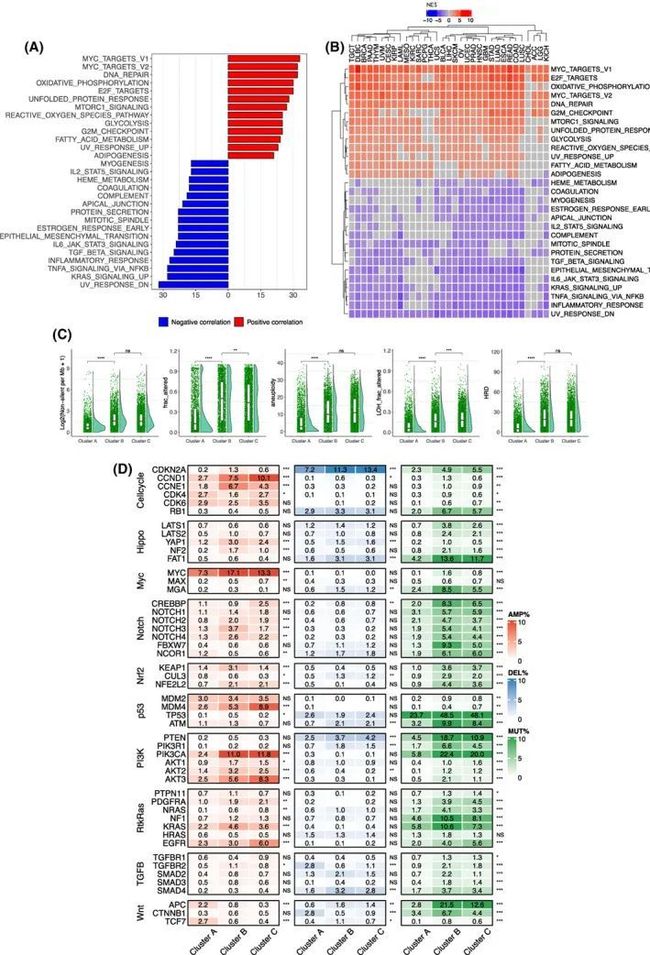
图3 三种端粒酶评分(TS)亚型之间的信号通路和基因组改变的差异
5. 特定于TS亚型的主要基因组改变驱动的活动
上述结果揭示了三种TS亚型之间的生物/分子差异,作者随后试图探索驱动基因组变化。首先,进行了全局比较:(a) TMB;(b) SCNA;(c) 偏倚性;(d) LOH;和 (e) HRD。如图3C所示,TS-CA亚型显示出最低水平的TMB、SCNA、偏倚性、LOH和HRD,而TS-CB和TS-CC的这些变化水平明显更高。这些异常在彼此之间在很大程度上相似或显著不同,但在TS-CB和TS-CC之间的差异要小得多。
作者进一步关注了与10个致癌途径相关的变化,这些途径在癌症类型中发生了失调。在三种TS亚型中,有9个途径存在显著差异,而只有TGFβ途径基本相似。在这九个途径中,包括细胞周期、Hippo、MYC、Notch、NRF2、TP53、PI3K、RTK-RAS和WNT,促进致癌活性并失活肿瘤抑制功能的基因组变化在TS-CB和TS-CC亚型中观察到的频率要比TS-CA亚型高得多(图3D)。例如,在PI3K途径成员中,致癌性PI3KCA的突变/扩增频率分别为TS-CA、TS-CB和TS-CC亚型的8.2%、33.4%和31.8%,而负调节PI3K的PTEN的功能丧失事件分别为7.0%、22.4%和15.1%(图3C)。细胞周期途径的变化与PI3K成员的变化非常相似。在MYC途径中,TS-CB中MYC扩增的频率比TS-CA高出两倍以上(图3C)。
6. TS亚型中免疫细胞的功能差异
由于作者的GSEA分析显示了TS与炎症和免疫反应途径之间的负相关关系,作者想探究肿瘤中浸润的免疫细胞在三种TS亚型之间是否存在功能差异。作者计算了肿瘤免疫功能障碍和排斥(TIDE)分数,这是一个多指标转录标志,能更好地预测不同癌症类型对免疫检查点阻断(ICB)的反应。TS-CB亚型的髓样抑制细胞(MDSC)和M2巨噬细胞(M2)分数最高,而癌相关成纤维细胞(CAF)分数最低(图4A)。此外,TS-CB的T细胞排斥分数最高。这些结果表明较高的TS促进了癌症免疫逃逸。为了直接评估TS对ICB的影响,作者分析了欧洲基因组表型档案库(# EGAS00001004290,EGAS00001004291,EGAS00001004292),其中包含接受抗体nivolumab治疗的ccRCC患者,该抗体能阻断免疫检查点蛋白PD-1。根据肿瘤中位数TS值,治疗过的患者被分为高TS组和低TS组,低TS组患者的总生存期(OS)和无进展生存期(PFS)显著延长(图4B)。在这些队列中,其余130名患者接受了MTOR抑制剂依维莫司的治疗,作者进行了与上述相同的分析。在依维莫司治疗的患者中,TS与OS和PFS均无关联(图4C)。
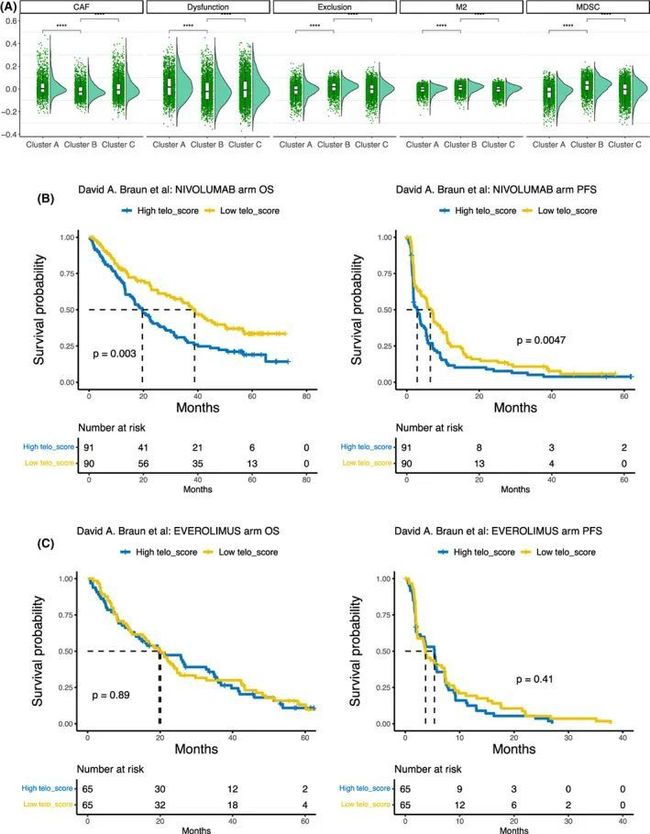
图4 端粒酶评分(TS)与癌症免疫逃逸之间的关联
7. 癌症类型中端粒酶组分的拷贝数改变(CNAs)和突变景观
作者随后试图研究调控10个端粒酶组分表达的潜在机制。由于先前的细胞遗传学研究和最近的TCGA数据分析显示,在各种癌症中经常出现TERT和TERC基因扩增,作者首先通过计算这些基因的扩增和纯合缺失来确定TCGA中9991个肿瘤样本中10个端粒酶组分的拷贝数。在10个端粒酶组分中,TERC的拷贝数增加最多,其扩增是主要的,而纯合缺失非常罕见(图5A,B)。几乎一半的卵巢癌和肺鳞癌,以及超过四分之一的宫颈癌和头颈部鳞状细胞癌肿瘤携带TERC扩增(图5A,B)。第二常见的基因是TERT,其次是NVL,RUVBL1和DKC1。与TERC类似,TERT扩增是主要的改变,但在3.3%的肾上腺皮质癌和≥2%的胆管癌,急性髓性白血病,弥漫大B细胞淋巴瘤和肉瘤肿瘤中观察到其纯合缺失(图5A,B)。对于NVL2,RUVBL1和DKC1,扩增频率>5%分别出现在八种,七种和五种癌症类型中。NHP2扩增主要发现在肾透明细胞癌(23.1%),肾上腺皮质癌(7.9%)和卵巢癌(5.4%)中。有趣的是,TCAB1的纯合缺失在11.7%的前列腺癌(PRAD),6.9%的肝细胞癌(LIHC)和6.6%的肉瘤(SARC)肿瘤中发生(图5B)。对于所有10个端粒酶组分,基因扩增导致了它们表达水平的最高水平。
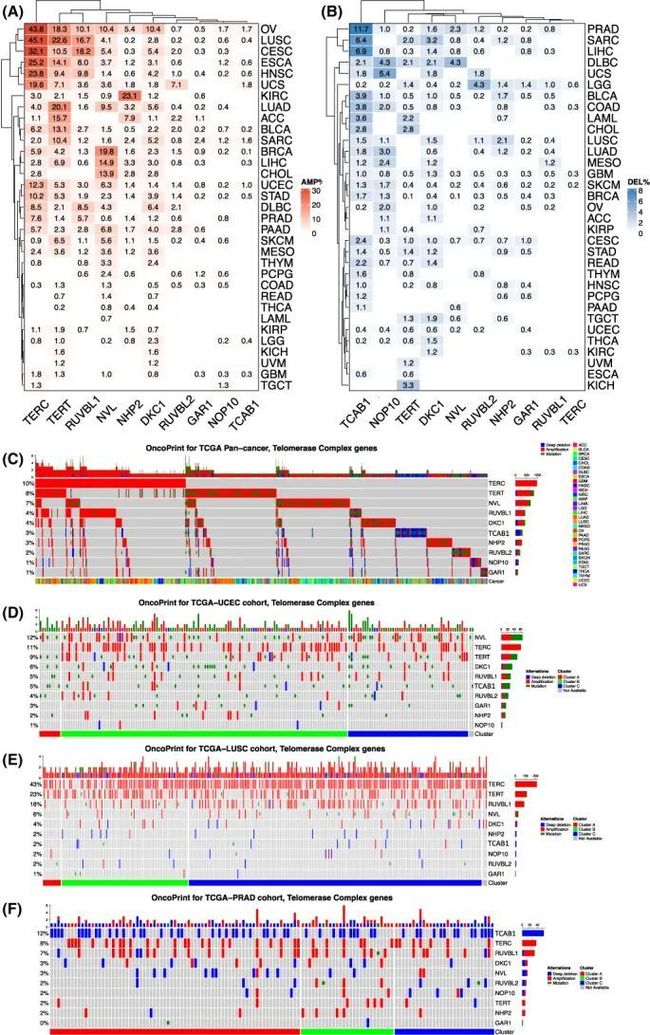
图5 癌症类型中10个端粒酶组分的基因组改变
作者进一步分析了基于33种癌症类型中10个端粒酶组分的体细胞突变,基于非同义突变状态。总突变频率为4.5%(464/10245个肿瘤),主要发生在TERT、NVL、RUVBL2、TCAB1、DKC1和RUVBL1(图5C)。突变似乎是随机的,至少对于TERT和DKC1来说,没有发生在已知影响其功能的位点上的突变(图5D)。然而,在六个肿瘤中观察到了TCAB1氨基酸522处的移码突变。此外,这些基因的突变谱还表现出以下特点:(a)突变事件在10个基因中一般是互斥的,(b)突变和扩增经常同时发生。另一方面,GAR1、NHP2和NOP10基因的突变很少,没有记录到TERC的突变。
图5D-F进一步展示了UCEC、PRAD和LUSC中10个端粒酶组分的特征性CNA和突变签名。在UCEC中,端粒酶组分的CNAs和突变都很常见,而在LUSC和PRAD中,CNAs占主导地位;然而,LUSC和PRAD分别表现出广泛的扩增和缺失。
8. 携带TCAB1基因纯合缺失的肿瘤细胞中的端粒酶活性
由于之前已经证明TCBA1对端粒酶的运输、组装和功能是必需的,作者对在癌症中频繁发生的TCAB1纯合缺失感到惊讶。在CCLE数据集中,40%的血液癌细胞系携带纯合TCAB1缺失,并且这些细胞系中TCAB1的表达显著降低(图6A)。使用EXTEND估计这些细胞中的端粒酶活性时,作者观察到具有和没有TCAB1缺失的细胞系之间没有差异(图6A)。作者进一步通过将原发性全癌样本分为杂合、纯合缺失和无缺失(其他)的TCAB1基因来评估端粒酶活性,结果显示在大多数癌症类型(21/33)中,这三组之间的酶活性相当。在12种具有显著差异的癌症类型中,杂合TCAB1缺失的组中最常观察到最高的EXTEND分数(图6B顶部),尽管TCAB1的纯合和杂合缺失导致基因表达显著降低(图6B底部)。作者随后直接测定了六种来源于血液恶性肿瘤的细胞系的端粒酶活性(三种髓系和三种淋巴系)。HL60、KG1和LP1细胞携带纯合TCAB1缺失,而其余三种细胞系没有丧失TCAB1。如图6C所示,TCAB1缺失细胞表达的TCAB1蛋白水平显著较低,但它们的端粒酶活性并没有降低,甚至比没有TCAB1拷贝缺失的细胞更高。值得注意的是,HL60细胞表达的TCAB1几乎可以忽略不计,但在所有六种细胞系中具有最高水平的端粒酶活性(图6C)。在这些细胞系中,TCAB1蛋白水平与端粒酶活性之间没有相关性(图6C,右图)。
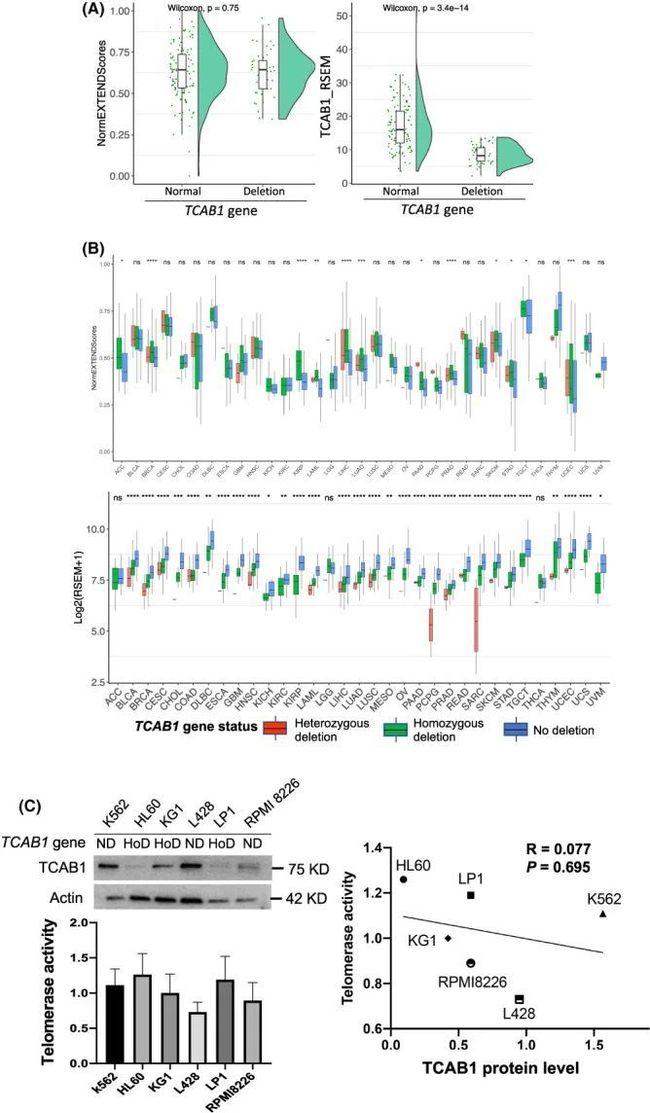
图6 在癌细胞和原发肿瘤中,TCAB1纯合子缺失对端粒酶活性没有影响
9. DNA甲基化和m6A对端粒酶组分的调控
作者进一步寻求确定DNA甲基化和m6A对端粒酶组分的调控作用。在大多数癌症类型中,TERT表达与其位点甲基化呈正相关,这与之前的报道一致。NVL和RUVBL2表现出类似的相关性。对于TCAB1,在几乎所有癌症类型中,除了TGCT、DLBC和THYM外,观察到了相反的相关性。在大多数癌症类型中,DKC1、RUVBL1、NHP2和TERC的表达也与DNA甲基化呈反相关(图7A)。
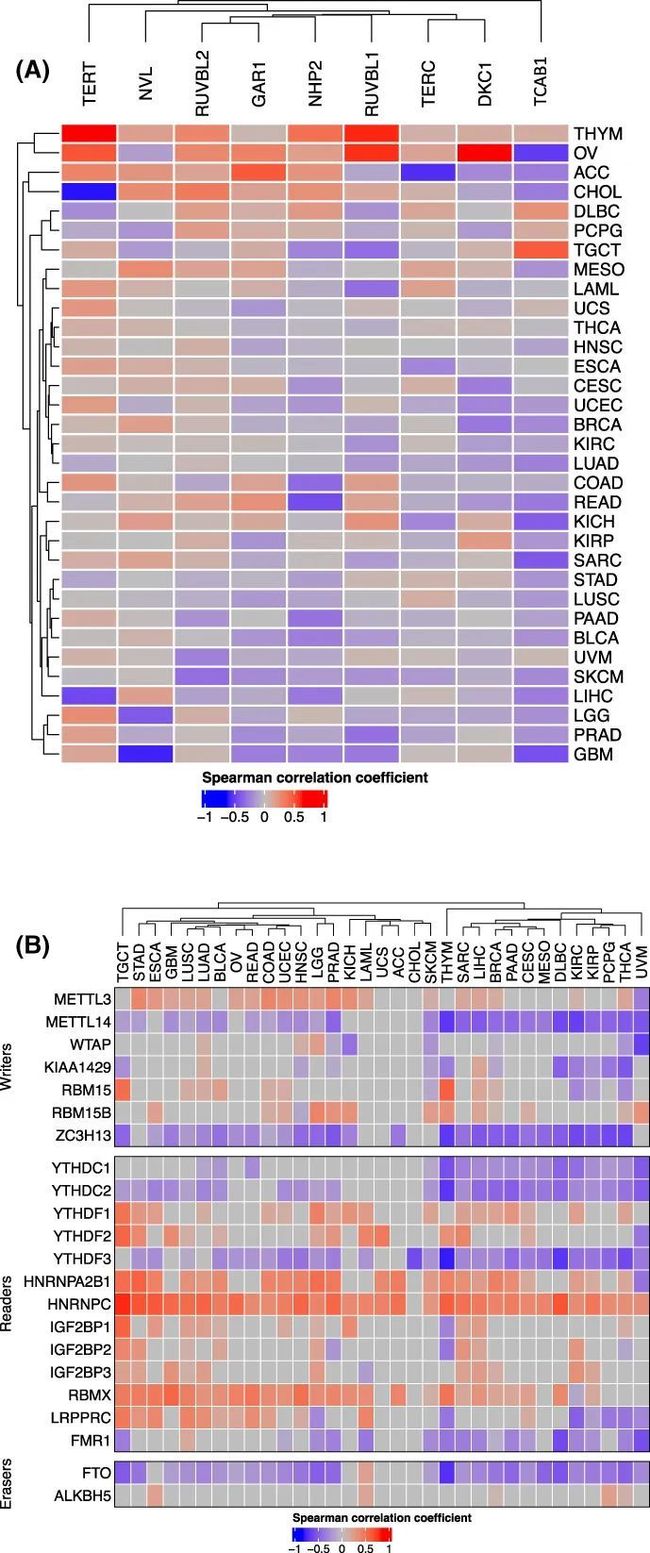
图7 与m6A调节因子和DNA甲基化在泛癌中的端粒酶组分表达相关联
对m6A调节因子和TS进行的分析显示,在大多数癌症类型中,TS与METTL3呈正相关,与METTL14呈负相关,尽管两者都是向mRNA添加甲基基团的m6A甲基转移酶(图7B)。另一方面,FTO作为m6A去甲基酶,在大多数癌症类型中与TS呈负相关。此外,m6A招募的结合蛋白YTHDC1、YTHDC2、YTHDF3和FMR1与TS呈负相关,而HNRNPC、HNRNPA2B1、YTHDF1和RBMX与TS呈正相关,在大多数癌症类型中(图7B)。
10. 针对端粒酶组分的药物
长期以来,端粒酶一直被认为是治疗癌症的靶点;然而,在过去几十年中,体内高效的端粒酶抑制剂的开发只取得了有限的成功。作者使用了CMap数据集,该数据集包含了来自多种细胞类型中测试的5000多种小分子化合物的基因表达谱库,用于作者的分析。作者发现,在33种癌症类型中,有23种药物与TSs呈负相关。其中大多数药物是针对致癌信号通路的抑制剂。此外,肾上腺素受体拮抗剂、钙通道阻滞剂、线粒体氧化磷酸化解偶联剂、磷脂酶和核糖体蛋白抑制剂在大多数癌症类型中与TSs呈负相关。溴域抑制剂,特别是BRD4抑制剂,显示出最广泛的活性,这与之前的研究一致,该研究显示BRD4抑制对端粒酶活性具有强大的抑制作用(图8)。

图8 用于TS抑制的癌症治疗药物
11. 具有替代端粒长度调节(ALT)激活或无端粒维持的肿瘤中的TS
端粒酶介导的端粒延伸是癌症中主要的机制,而ALT途径则在少数人类恶性肿瘤中被激活。最近,作者还观察到了没有端粒维持的侵袭性肿瘤。为了进行比较,作者根据ATRX或DAXX基因突变、TERT阳性肿瘤和双阴性(TERT-/ALT-)肿瘤对ALT肿瘤进行了分类。在TCGA的11352个肿瘤中,作者观察到TERT+、ALT+和TERT-/ALT-肿瘤分别为8424(74.2%)、949(8.4%)和1979(17.4%)。图9A显示了33种癌症类型中三种不同肿瘤的分布情况。TERT-/ALT-肿瘤中的TS最低,TERT+肿瘤中最高,并且TERT-/ALT-肿瘤与TERT+肿瘤或ALT+肿瘤之间存在统计学差异(图9B)。TERT+肿瘤中的TS高于ALT+肿瘤,但差异在统计学上不显著(图9B)。桑基图进一步显示了这些肿瘤与TS亚型之间的关系:TS-CB和CC亚型主要来源于TERT+肿瘤,而TS-CA则来自TERT+和TERT-/ALT-肿瘤,而ALT+肿瘤在三个TS亚型之间分布均匀(图9C)。
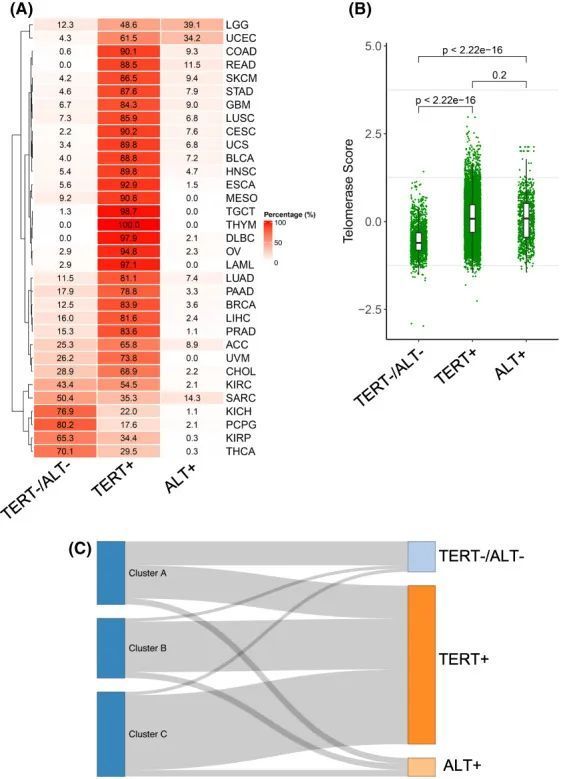
图9 Telomerase评分(TS)与TERT+、替代端粒长度延长(ALT+)和TERT−/ALT−肿瘤在33种癌症类型中的关联
总结
总之,在本研究中,作者直接分析了10个端粒酶组分在人类癌症中的表达情况,并根据其表达异质性确定了三个不同的亚型。端粒酶组分的差异表达归因于它们的拷贝数变异和表观遗传异常。其中一个关键发现是,在TCAB1缺失的癌细胞中存在高端粒酶活性,这与之前的报道不一致。重要的是,这三个不同的亚型与癌干细胞特性、上皮间质转化、增殖、代谢重编程、基因组不稳定性、免疫逃逸以及由各种致癌信号通路驱动的患者生存状况存在差异。显然,在癌变过程中,端粒维持被整合到整个致癌程序中,针对上游事件可能有助于有效阻断与端粒相关的异常现象。