黑色素瘤的最新研究进展(2021年5月)
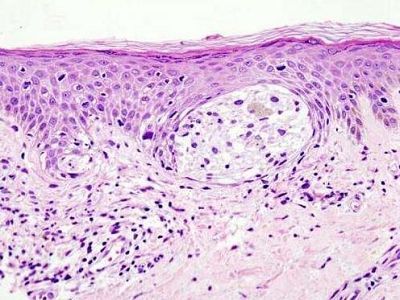
黑色素从黑色素细胞转运到角质形成细胞现场
恶性黑色素瘤过去一直以手术切除和药物化疗为主要治疗手段,预后不佳。随着高通量基因测序技术的发展和对肿瘤 分子机制认识的加深,人们发现肿瘤异质性和肿瘤微环境多样性影响了肿瘤的形成、耐药和治疗选择,导致了黑色素瘤患者对同种 治疗方法的反应和获益不同。靶向治疗和免疫治疗的出现与进展,黑色素瘤患者的生存率显著上升,推动了黑色素瘤治疗的个体 化与精准化,促使精准医疗成为研究的热点与趋势。本文旨在总结建立在精准分型和分子水平上的晚期黑色素瘤个体化综合治疗 的研究进展,阐述精准医疗时代背景下黑色素瘤患者的生存现状,以及发展多种靶向治疗、免疫治疗或联合疗法的前景与必要性。
最新进展:
精准肿瘤学药物!PKC抑制剂darovasertib治疗转移性葡萄膜黑色素瘤(MUM):1年生存率高达57%!
IDEAYA Biosciences是一家精准肿瘤学公司,致力于合成致死(synthetic lethality)靶向药物的研究和开发。近日,该公司公布了正在进行的1/2期临床试验(NCT03947385)的数据。该试验正在评估darovasertib(IDE196)单药疗法以及联合binimetinib治疗实体瘤,包括转移性葡萄膜黑色素瘤(MUM)和皮肤黑色素瘤。
结果显示,darovasertib单药治疗MUM展现出强劲疗效,一年生存率达到了57%(历史数据为37%)、中位总生存期(OS)达到了13.2个月(历史数据约7个月)。此外,darovasertib与binimetinib联合治疗观察到2例部分缓解(ORR=22%),而历史数据为0-5%。
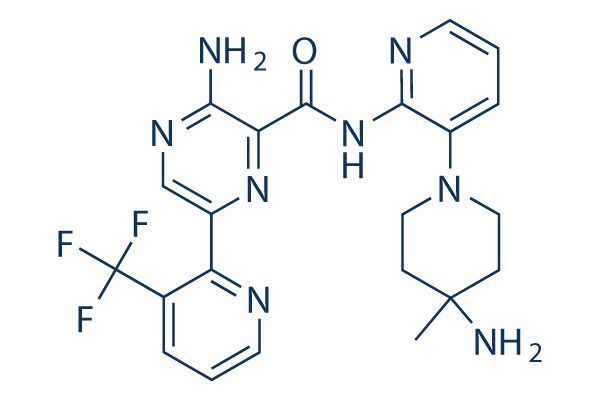
darovasertib化学结构式(图片来源:selleckchem.com)
darovasertib是一种处于临床阶段的、强效、选择性PKC小分子抑制剂。PKC是一种蛋白激酶,作用于Gtpase GNAQ和GNA11的下游。IDEAYA公司从诺华(Novartis)获得了darovasertib的全球独家许可。之前,诺华开展了治疗MUM的1期临床试验。
40年来首个重大突破!新型TCR疗法tebentafusp治疗葡萄膜黑色素瘤(UM)3期临床显著延长生存期!
Immunocore是一家处于后期临床阶段的生物技术公司,开创了一类新型T细胞受体(TCR)双特异性免疫疗法的开发,用于治疗包括癌症、感染性疾病和自身免疫性疾病在内的多种疾病。近日,该公司在2021年美国癌症研究协会(AACR)年会上公布了在研TCR疗法tebentafusp(IMCgp100)一线治疗转移性葡萄膜黑色素瘤(mUM)3期IMCgp100-202临床试验(NCT03070392)的结果。数据显示,研究达到了主要疗效终点:与研究者选定的治疗方案(82%为默沙东抗PD-1疗法Keytruda[可瑞达])相比,tebentafusp治疗表现出强劲疗法:显著延长了总生存期(OS)、将死亡风险降低了49%。
值得一提的是,这是针对任何TCR疗法获得阳性结果的首个3期临床试验,也是任何双特异性疗法在实体瘤中的首个阳性3期临床试验。mUM患者预后很差,几十年来情况没有明显改变。
基于IMCgp100-202研究的强劲疗效结果,Immunocore公司将与美国FDA合作,在2021年第三季度完成tebentafusp生物制品许可申请(BLA)的提交。如果获得批准,tebentafusp将成为40年来治疗mUM方面第一个显著改善总生存期(OS)的新疗法。
PNAS:揭示抑制肿瘤来源的NLRP3降低黑色素瘤进展机制!这种抑制可增强免疫检查点疗法的抗肿瘤疗效
从临床角度来看,免疫检查点疗法(ICT)已经显著改善了黑色素瘤患者的治疗结果,大量研究已表明,免疫检查点PD-1/PD-L1和CTLA4的表达往往是免疫治疗疗效的预测指标。然而,对ICT无反应或复发的患者数量持续上升,临床数据显示,免疫检查点的表达并不总是与治疗反应相关。部分患者对单一疗法的有限反应表明,黑色素瘤细胞的内在途径,如免疫检查点配体的表达,并不是驱动肿瘤进展的唯一机制。鉴定其他肿瘤特异性策略为干扰致癌过程和改善这类人群的生存提供了机会。比如,黑色素瘤相关的炎症促进肿瘤进展,特别是与IL-1β活性相关。一种减少IL-1β活性的方法是通过抑制NLRP3实现的。
在一项新的研究中,美国研究人员发现,破坏NLRP3信号转导与ICT的组合使用可增加抗肿瘤活性。这些结果支持肿瘤中的NLRP3激活代表了一种有利于肿瘤免疫逃逸的内在途径的概念。因此,靶向NLRP3代表了一种治疗黑色素瘤的创新策略,特别是在对免疫疗法产生抵抗性的肿瘤的情况下。相关研究结果发表在2021年3月9日的PNAS期刊上,论文标题为“Targeting tumor-derived NLRP3 reduces melanoma progression by limiting MDSCs expansion”。
这些作者通过分析癌症基因组图谱(TCGA)和GTEx数据集,发现相比于正常皮肤,皮肤黑色素瘤中的NLRP3和IL-1β表达高度显著增加。对来自转移性黑色素瘤患者的人黑色素瘤皮肤活组织样品的分析表明在这些样品中,NLRP3表达增加,炎小体活跃形成,这表明NLRP3炎小体激活有助于黑素瘤中的IL-1β成熟。体外培养的人转移性黑色素瘤1205Lu细胞表现出时间依赖性的IL-1β释放,利用siRNA沉默NLRP3可降低它的释放。此外,他们接着利用一种小分子的口服NLRP3抑制剂(称为OLT1177)靶向NLRP3,结果发现OLT1177阻断NLRP3的ATPase酶活性,而这种酶活性是NLRP3炎性体形成所必需的。在1205Lu细胞中,OLT1177处理降低IL-1β的自发性释放和IL-1α诱导的IL-1β释放。相比于接受对照处理的1205Lu细胞,在接受OLT1177处理的1205Lu细胞中,NLRP3、炎性体衔接蛋白ASC、IL-1β前体(p37)蛋白水平未受影响,此外,这种处理也不影响细胞增殖。这些体外研究结果证实了人黑色素瘤细胞中NLRP3炎小体组成性激活及其在IL-1β的加工和分泌中的作用。
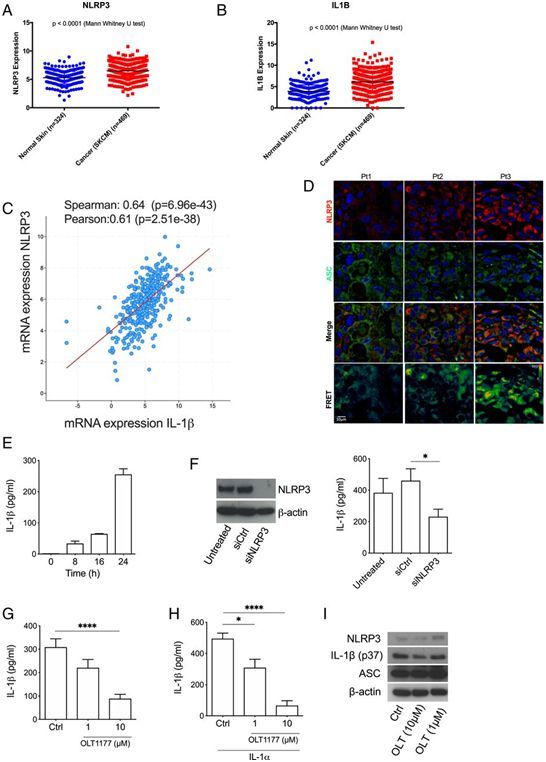
NLRP3炎性体介导人转移性黑色素瘤细胞中IL-1β的分泌。图片来自PNAS, 2021, doi:10.1073/pnas.2000915118。
J Invest Dermatol:双重药物疗法或有望彻底治愈致死性黑色素瘤
黑色素瘤是一种最严重的皮肤癌,其在澳大利亚每年会造成1700多人死亡。基于阻断淋巴细胞免疫检查点的靶向性疗法和免疫疗法的引入开辟了黑色素瘤治疗的新纪元,尽管如今科学家们取得了一定的进展,但并非所有患者都会对疗法产生反应,即使是在有反应的患者中,大部分患者也会出现对疗法的耐受性。如今研究人员识别出了对免疫疗法产生耐受性的多种原因,包括细胞抗原呈递的缺陷和肿瘤总较低水平的T细胞浸润;同样,对靶向性疗法耐受性的发生则包括了一系列原因,比如MAPK通路的再度激活和可更替受体激酶通路的激活;染色质的功能失调是黑色素瘤中发生的一种常见事件,而如今研究人员已经识别出了多种表观遗传学改变或许是黑色素瘤产生耐受性的新型分子机制。
图片来源:https://www.jidonline.org/article/S0022-202X(21)01121-0/fulltext
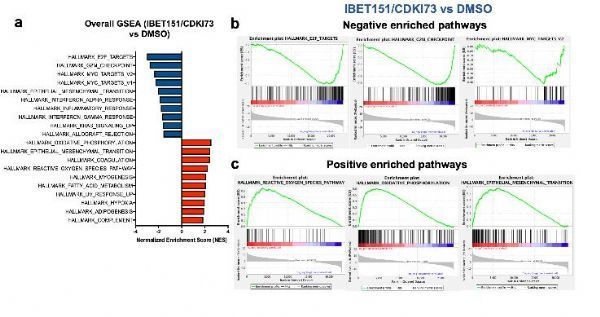
表观遗传学修饰子的功能失调是黑色素瘤中经常发生的事件,而且还是黑色素瘤生物学发生的多方面的基础,包括对靶向性疗法和免疫疗法耐受性的产生等。日前,一篇发表在国际杂志Journal of Investigative Dermatology上题为“A combination of epigenetic BET and CDK9 inhibitors for treatment of human melanoma”的研究报告中,来自雪梨百年纪念学院等机构的科学家们就通过研究发现,一种双重药物策略或能为治疗黑色素瘤提供一种高效的治疗性手段。研究者表示,双重靶向作用BET和CDK9蛋白或能在体内和体外对黑色素瘤细胞产生一种协同作用效果;BET抑制剂(IBET151和CDK9抑制剂CDKI73能在体外协同杀灭黑色素瘤细胞,而这并不受BRAF或NRAS突变状态的影响。
与运输载体对照和单一药物相比,上述两种抑制剂药物的组合或能在体外3D球体结构和体内NSG小鼠模型中抑制人类黑色素瘤C002M细胞的生长;细胞的死亡与线粒体的去极化和caspase依赖的细胞凋亡有关,同时还与PARP1的裂解、抗凋亡蛋白BCL2、BCLXL和MCL1的功能下调有关。GSEA分析(基因富集分析,Gene Set Enrichment Analysis,是一种针对全基因组表达谱芯片数据的分析方法,将基因与预定义的基因集进行比较)结果揭示了与E2F、G2M检查点和c-MYC相关的标志基因集的功能下调,而且生存分析结果也揭示了较高G2M、E2F或c-MYC基因标志所产生的较差的预后,这就进一步揭示了黑色素瘤中能对BET和CDK9抑制剂产生反应的生物标志物。
图片来源:Abdullah Al Emran,et al. Journal of Investigative Dermatology(2021). DOI: 10.1016/j.jid.2020.12.038
澳大利亚雪梨百年研究所的科学家们报告了一项对抗黑色素瘤的新策略。黑色素瘤是一种最危险的皮肤癌,每年造成澳大利亚约1700人死亡。
研究人员使用药物抑制两种不同的蛋白质,发现它们可以通过诱导细胞凋亡(当细胞不再需要时发生的细胞自毁过程)有效地杀死黑色素瘤细胞。
这种新的治疗策略有可能使一群对靶向治疗或免疫治疗没有反应的黑色素瘤患者受益。
该研究的主要作者、百年研究所黑色素瘤肿瘤学和免疫学项目的研究人员Hsin-Yi Tseng博士说:"由于在黑色素瘤癌细胞中发现了高水平的抗凋亡蛋白或'保护'蛋白,因此诱导细胞凋亡是极其困难的。这些保护蛋白帮助黑素瘤细胞存活、生长,在某些情况下还有助于抵抗先进的药物治疗。"
在这项研究中,研究人员联合抑制了蛋白MCL1以及来自溴域和外末端(BET)家族的蛋白。这两种物质都被认为在保护和支持体内黑色素瘤癌细胞方面起着关键作用。
Tseng博士说:"我们的研究表明,联合使用BET和MCL1抑制剂对杀死黑色素瘤非常有效。BET和MCL1蛋白的保护能力在药物抑制剂的作用下下降,并导致癌细胞自毁。"
该研究的共同通讯作者Jessamy Tiffen博士也是百年研究所黑色素瘤肿瘤学和免疫学项目的成员。她说,该团队的研究意义重大,为黑色素瘤患者提供了一种潜在的新治疗策略。
"多达一半的黑色素瘤患者对免疫治疗没有反应,大多数患者倾向于对靶向治疗产生获得性耐药性。我们的研究检测了大量的人类黑素瘤细胞系以及小鼠模型。我们看到这两种情况下黑色素瘤的大量减少,这预示着这项研究将进入下一个发展阶段,"Tiffen博士说。
这项研究发表在《International Journal of Cancer》上。黑素瘤是澳大利亚年轻人最常见的癌症,这些人的年龄从15岁到39岁不等。
芬兰的一项新研究为黑素瘤细胞如何通过其分泌的胞外囊泡与其他细胞相互作用提供了新的思路。研究人员发现,黑素瘤细胞分泌的胞外囊泡利用所谓的hedgehog信号通路来强化其目标细胞的恶性特性。这一发现有助于开发更好的黑色素瘤治疗和诊断方法。这项研究发表在《Cellular and Molecular Life Sciences》杂志上,是由东芬兰大学和赫尔辛基大学的研究人员合作完成的。
许多调节我们身体机能的机制在整个进化过程中一直保持不变。这意味着相同的基因调控所有多细胞动物的发育和功能。这种基因的一个例子是所谓的hedgehog信号通路。与这一信号通路相关的基因家族因其在果蝇幼虫身上引起的突变而得名,该突变使果蝇幼虫看起来像刺猬一样尖利。在哺乳动物中发现的三种刺猬基因中,最常见的一种是Sonic hedgehog基因。在哺乳动物中,hedgehog基因家族成员是胎儿发育的基本调控者,但在发育的后期,甚至在成年动物中,它们也与干细胞分裂有关。最近的研究表明,它们的表达也与许多不同类型的癌症有关,包括皮肤癌。黑色素瘤是皮肤癌中最严重的一种,而且越来越常见。
细胞外囊泡在细胞之间传递信号,它们也可以携带包装好的药物
传统上认为,体内的信号传递是通过自由循环的信号进行的,如生长因子和激素。然而,根据最近的一种观点,人们认为有些信号是为运输而包装的,以保护它们不受破坏,并确保它们送达正确的地址。细胞外囊泡是由细胞膜构成的小泡状的包裹,是体内信号的天然载体。在胎儿时期,它们就已经通过母乳和以后的组织再生来调节身体的功能。癌细胞也利用细胞外囊泡传递信号并改变其环境,使之有利于生长。细胞外囊泡还可以作为多种药物的载体来对抗疾病和修复组织损伤--这就是为什么它们目前被如此积极地研究的原因。
在最新发表的研究中,研究人员发现了细胞外囊泡和hedgehog分子之间的新联系。他们发现,黑素瘤细胞分泌的囊泡通过hedgehog信号通路强化了它们所瞄准的细胞的恶性特性,比如分裂和扩散。研究人员使用培养的人类黑素瘤细胞和正常皮肤细胞,通过分析来自黑素瘤患者的组织样本来确认他们的细胞培养结果。
"很巧合的是,这些携带信号的囊泡起源于一种细胞,这种细胞也被称为hedgehog细胞,因为它们具有微小的、尖峰状的突起。然而,这些突起与果蝇幼虫没有任何关系;相反,它们通常存在于活跃于产生透明质酸的细胞中,透明质酸是细胞外基质中最常见的糖分子,"东芬兰大学的Docent Kirsi Rilla说。"透明质酸在囊泡介导的信号传递中也起着关键作用,因为透明质酸存在于细胞表面突出的囊泡表面,有助于它们与目标细胞结合。"
hedgehog信号通路有望成为黑色素瘤和其他癌症药物治疗的靶点。研究人员现在发现的调节机制可以用于开发更好的诊断和药物治疗黑色素瘤患者。
DOI:10.1016/j.ccell.2019.12.007
研究者表示,CDR1as能够减缓名为IGF2BP3的促癌蛋白的功能,同时其还对临床患者的治疗具有重要的意义;目前研究人员仍然迫切需要对大量癌症患者进行研究来识别癌症转移高风险患者,此外,对于晚期患者而言,拥有能够预测对疗法产生反应的生物标志物或许对于选择最合适、有效且个性化的治疗有很大的帮助;从这种意义上来讲,CDR1as的水平或许就能作为一种非常有价值的生物标志物,其或能广泛应用于黑色素瘤和其它类型肿瘤的治疗之中。
更复杂的是,黑色素瘤的循环肿瘤细胞会隐藏在血液中成千上万的其它细胞和物质中,在1毫升血液中,10亿个红细胞和100万个白细胞中通常只有不到10个癌细胞;这就好比大海捞针一般;深入理解这项任务的复杂性,研究人员或许就有望开发出一种多面性的手段来检测黑色素瘤循环肿瘤细胞;通过将三种实验结合起来,研究人员就能将检测率提高到72%,其测试结果显著高于任何一个测试。
最后,研究者表示,这种新方法能够有效可靠地对循环肿瘤细胞进行检测,但后期他们还需要进行调整选择出最佳的组合来捕捉最广泛的循环肿瘤细胞。
如今免疫疗法大大改变了恶性癌症患者的癌症治疗,但其仅仅能对一小部分患者发挥作用,研究人员发现,将NKTR-214与过继细胞疗法相结合或能有效治疗更多恶性实体瘤患者。后期研究人员还会继续深入研究来评估这种联合疗法的治疗效果。
6. Nat Cancer: 新技术预测黑色素瘤的扩散
在《Nature Cancer》杂志上发表的一篇论文中,布莱根妇女医院的研究人员与国际同行合作,提出了一种新的定量技术,该技术利用DNA测序技术对哪些原发性黑色素瘤可能复发和扩散做出了更为精确和准确的预测。
这项工作中使用的测试仅供研究使用,目前在临床上尚不可用。作者还指出,当前的研究是回顾性的,研究对象是已知结果的患者。还需要对尚未知道结果的患者进行前瞻性研究,以进一步验证测试结果。
doi:10.1038/s41586-019-1914-8
DOI: 10.1371/journal.pgen.1008501
近年来科学家们在黑色素瘤研究上取得了重大进展,然而,并不是所有患者都会对当前疗法产生反应,而且大部分皮肤癌患者都会随着时间延续对疗法产生耐受性,因此研究人员就急需开发出一种新型疗法来治疗皮肤癌。这项研究中,通过阐明DIRC3的工作机制,研究人员或许就能理解其如何在分子水平下阻断黑色素瘤的进展,这对于后期开发治疗黑色素瘤的新型靶向性疗法至关重要。
doi:10.1038/s41586-019-1847-2.
DeBerardinis说,“这篇论文为分析肿瘤的代谢提供了一个令人信服的案例。这是评估肿瘤代谢如何识别与癌症侵袭性相关的差异的一个很好的例子。接着,人们就可以鉴定出与转移有关的代谢活动,用药物抑制这种代谢活动,并减少小鼠中的癌细胞转移。这是了不起的。”
近日,一项刊登在国际杂志British Journal of Dermatology上的研究报告中,来自澳大利亚QIMR Berghofer医学研究所的科学家们通过研究发现,22种不同的基因或能帮助确定一个人在患黑色素瘤之前能够接受多少阳光的照射。对于较高遗传风险的人群而言,儿童时期的阳光照射是一个重要的致病因素,而遗传风险较低的人群只有在经历了一生的阳光照射后才会患上黑色素瘤。
这项研究中,研究人员深入分析了遗传和行为因素如何协同作用来影响人群患黑色素瘤的风险。Qskin数据库中包含了人群出生的地点、迁徙年龄、晒伤和在阳光下度过的累积时间及鳞状细胞癌、基底细胞癌和雀斑信息等,同时还包括参与者的DNA信息等。本文研究中,研究人员深入揭示了黑色素瘤的发生机制,相关研究结果或有望帮助研究人员识别出能因靶向性防晒而获益的人群,同时研究者还需要进行大量研究来阐明为何黑色素瘤是澳大利亚发病率最高的一种癌症。如今澳大利亚正准备迎来一个炎热而晴朗的夏季,避免有害的阳光照射对于人们而言正是时候。