“隐藏高手” 胰腺癌的新出路——微生物
谷禾健康
胰腺癌是致命的癌症之一,其特点是:
难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 "无声杀手"。
胰腺癌为什么难发现?这要从胰腺癌的位置说起。
胰腺位于人体后腹部深处,被胃、肝等层层围绕,且体积小,胰腺癌早期几乎没有不适。普通检查手段较难发现。
随着胰腺肿瘤的生长,出现的许多症状看起来与其他疾病的症状很像,比如:发冷和出汗、发热、腹胀、腹泻、恶心、疲劳、食欲不振、不明原因体重减轻、上背部或上腹部疼痛、手臂或腿部肿胀、黄疸迹象等。这就容易导致误诊。
胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
胰腺癌的诊断难,治愈也难,应对胰腺癌治疗这样的难题,科学界在不断努力中。
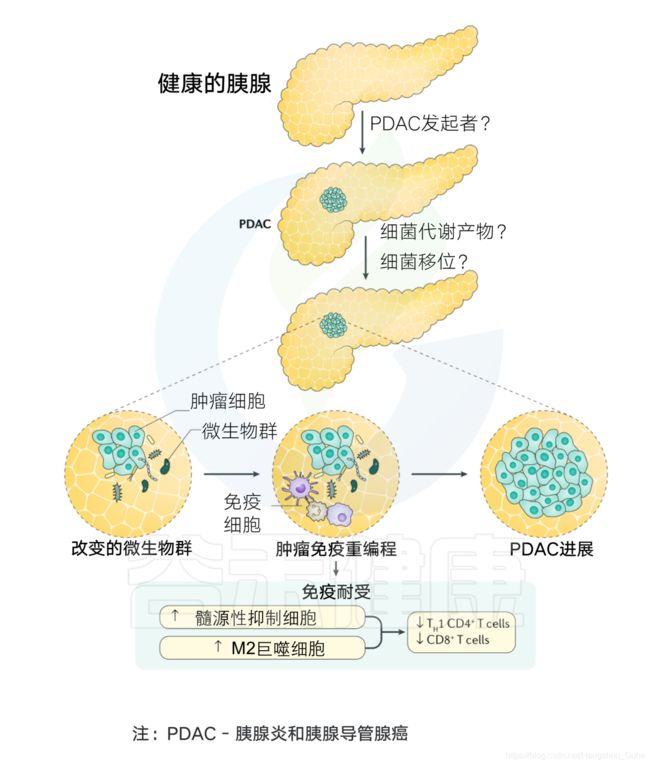
胰腺癌独特的免疫抑制微环境是免疫治疗面临的最大障碍,而微生物群的改变也被认为是塑造肿瘤局部微环境并影响免疫治疗的重要因素。
科学家发现微生物群在调节代谢和免疫反应中起着关键作用。通过维持相对健康的微生物群类型,提高胰腺癌化疗药物和免疫治疗的有效性,为胰腺癌患者带来新的希望。
接下来,本文详细列举口腔、肠道和胰腺微生物群在胰腺癌发展中的作用的关键信息,讨论不同类型的微生物群,它们在调节药物代谢、耐药性、免疫反应和胰腺癌治疗潜力中的潜在作用,以及相关预防措施。
图源:知易社
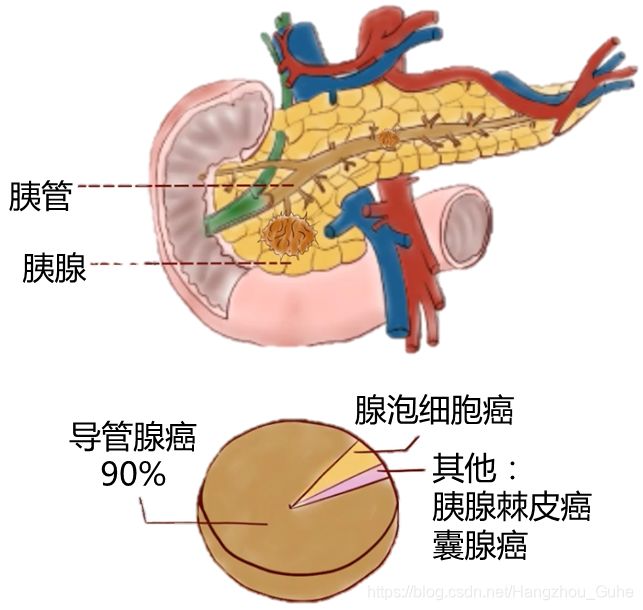
一般说的胰腺癌主要是指胰腺导管腺癌,简称PDAC,下同:
01 微生物群与胰腺导管腺癌的关系
从临床和解剖学的角度来看,胰腺与肠道微生物群没有直接的物理联系,因此胰腺被认为是无菌组织。但微生物可以通过消化道中的胆管迁移到胰腺。
Pandya Gouri,et al., Semin Cancer Biol, 2021
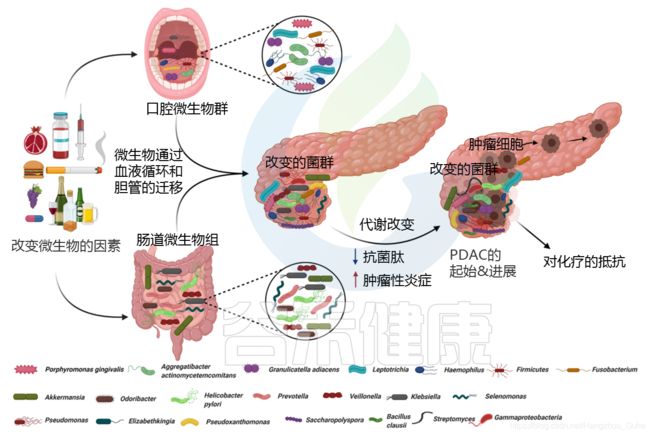
许多研究表明,口腔、胃肠道、粪便和器官特异性(胰腺)微生物群的组成与PDAC高度相关。
PDAC的口腔、唾液、舌苔微生物群
口腔和唾液微生物群组成的改变与PDAC的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
牙龈卟啉单胞菌(Porphyromonas gingivalis)、梭杆菌(Fusobacterium)、缓症链球菌(Streptococcus mitis )、长奈瑟氏球菌(Neisseria elongata ).
牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans 与胰腺癌高风险之间的相关性,表明口腔微生物群可能是导致PDAC肿瘤发生的危险因素。据推测,牙龈卟啉单胞菌可能分泌肽基精氨酸脱亚胺酶,通过引起KRAS和TP53基因突变来降解精氨酸代谢。
唾液微生物群
在胰腺癌患者的唾液样本中,与健康对照组相比,PDAC患者的长奈瑟氏球菌和缓症链球菌的水平明显降低,而Granulicatella adiacens的水平明显升高。
——作为预测胰腺癌的非侵入性生物标志物
在区分PDAC病患者和健康个体时,长奈瑟氏球菌和缓症链球菌的组合显示出96.4%的敏感性和82.1%的特异性。这项研究的结果表明,唾液微生物群可以作为预测胰腺癌的非侵入性生物标志物。
有研究对胰腺癌患者的唾液样本进行了微生物鉴定,发现纤毛菌Leptotrichia的丰度较高,而卟啉单胞菌和奈瑟氏球菌的比例相对较低。因此,唾液中纤毛菌Leptotrichia与卟啉单胞菌的显著高比率(L/P比率)可用作PDAC的预测标记。
口腔微生物组
PDAC和对照组在相关类群的平均相对比例上观察到差异。
PDAC患者 :高水平的厚壁菌门和相关类群,包括:乳杆菌科(Lactobacillales)、嗜热链球菌(Bacillli Streptococcus thermophilus)、链球菌科(Streptococcaceae)
对照组:具有相对较高水平的变形菌和相关分类群,包括:γ变形菌(Gammaproteobacteria)、巴氏杆菌科(Pasteurellaceae)、副流感嗜血杆菌(Haemophilus parainfluenzae);β变形菌(Betaproteobacteria),奈瑟氏球菌(Neisseria),黄奈瑟氏球菌(Neisseria flaviscen)
舌苔微生物群
胰头癌患者优势菌群如下:梭杆菌属Fusobacterium, 纤毛菌属Leptotrichia, 放线菌属Actinomyces, 罗氏杆菌属Rothia, 奇异菌属Atopobium, 棒状杆菌Corynebacterium, 莫拉氏菌属Moraxella, 消化链球菌属Peptostreptococcus, 产线菌属Filifactor, Oribacterium,坦纳菌属Tannerella
对照组优势菌群如下:嗜血杆菌Haemophilus, 卟啉单胞菌属Porphyromonas,Paraprevotella
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌和纤毛杆菌、梭杆菌的富集量有显著差异。
类似地,在胰头癌患者中观察到链球菌和罗氏菌属相对较高的富集,而在肝癌患者中SR1的相对丰度较高。因此,SR1和链球菌可用于区分肝癌和胰头癌。
*SR1:SR1 genera incertae sedis
对PDAC与微生物群的变化在多样性和组成方面的关联研究非常有限。需要在一个大队列中进一步的调查证实这些发现,从而得出确切的结论。
PDAC的胃肠道微生物群
——肠道微生物群可以直接影响胰腺微环境
给WT小鼠口服荧光标记的粪肠球菌Enterococcus faecalis,有趣的是,在这些小鼠的胰腺中观察到荧光,这表明细菌从肠道向胰腺迁移。
在另一项研究中,将抗生素混合物口服给药于PDAC、结肠癌和黑色素瘤的小鼠模型,观察到在所有受试模型中肠道微生物群的减少显著减弱了肿瘤的生长。
几个小组观察到,吸烟是胰腺癌的一个关键风险因素,可导致微生物群的显著变化,特别是在人类的肠道中。吸烟者肠道中厚壁菌门和放线菌门的减少,梭菌门、拟杆菌门、变形菌门的数量显著增加。
——胰腺癌患者和健康对照者粪便样本显著差异
微生物谱分析 (胰腺癌患者粪便样本,基于属水平的线性鉴别分析)
显著富集普雷沃菌属(Prevotella)、韦荣球菌属(Veillonella)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、哈氏菌属(Hallella)、月形单胞菌属(Selenomonas)、Cronobacter spp.
显著减少双歧杆菌属(Bifidobacterium)、芽孢杆菌属(Gemmiger)、梭状芽孢杆菌属(Clostridium IV)、Coprococcus、经黏液真杆菌属(Blautia)、Flavonifractor、丁酸球菌属(Butyricicoccus)、厌氧菌属(Anaerostipes)、Dorea spp.
这种粪便微生物群组成的显著差异表明,胰腺癌的胃肠道微生物是独一无二的。此外,本研究的数据表明,与脂多糖(LPS)生产、类异戊二烯和亮氨酸的生物合成相关的微生物有显著的富集/定殖,而已观察到产丁酸菌和益生菌的减少。
16S rRNA测序分析
分析PDAC患者和对照的粪便标本微生物群,观察到不同的优势菌:
PDAC患者:变形菌门(Proteobacteria),互养菌门(Synergistetes),广古菌门(Euryarchaeota),Akkermansia,韦荣氏菌科Veillonellaceae,Odoribacter
健康肠道:Clostridiacea,瘤胃球菌科,Ruminococcaceae,毛螺科Lachnospiraceae
除此之外,幽门螺杆菌感染和胰腺癌之间也呈正相关。在胃癌(69%)和胰腺癌(65%)患者的血液样本中,幽门螺杆菌感染率异常高。Meta分析和前瞻性队列研究表明,幽门螺杆菌感染的患者患胰腺癌的风险明显较高。然而,为了明确解决幽门螺杆菌在PDAC的影响,需要进行更多的人群和动物研究。
PDAC的胰腺微生物群
过去几十年科学家一直认为,在胰腺中存在蛋白酶,且胰腺环境是高碱性的,那么微生物无法生存。
胰腺中存在细菌,PDAC患者细菌更多
用16S rRNA基因特异性PCR对胰腺囊肿液体标本进行分析,发现优势菌:氨基酸球菌属Acidaminococcus, 埃希氏杆菌属Escherichia, 拟杆菌属Bacteroides, 志贺氏杆菌Shigella。这表明胰腺囊液可能是微生物群分析的良好来源。
最近,对PDAC样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,PDAC患者的胰腺组织中存在细菌(约为正常人的1000倍)。
PDAC的标本中的主要菌
对人类PDAC肿瘤标本进行16S rRNA测序,发现了13个不同的门。
PDAC患者:变形菌门 (45 %);拟杆菌门(31 %);厚壁菌门 (22 %);放线菌门 (1%);假长双歧杆菌Bifidobacterium;
·pseudolongum【Kras(G12D)介导的胰腺癌小鼠模型】;假单胞菌属 Pseudomonas;Elizabethkingia;梭杆菌 Fusobacterium
对照组:乳酸菌 Lactobacillus
梭杆菌——预后生物标志物
PDAC肿瘤内梭杆菌Fusobacterium的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
耐药患者的组织标本中 γ -变形菌定植
从耐受"吉西他滨"的PDAC中获得的组织标本中,γ-变形菌门Gammaproteobacteria定植,表明γ -变形菌可能干扰吉西他滨的代谢,并产生耐药性。
男女患者菌群差异
男性和女性患者之间微生物群组成的差异,各自的主导菌群如下:
男性患者:A. ebreus,Acinetobacter baumannii
女性患者:Geobacillus kaustophilus HTA426 ,Escherichia coli 55989
吸烟与非吸烟差距
此外,吸烟PDAC患者与非吸烟PDAC患者的对比,鲍曼不动杆菌A. baumannii 和M. hyopneumoniae高度富集,且与不良临床结果相关。这些微生物显示出富集的致癌信号和抑制肿瘤和免疫信号。
胰腺癌转移相关菌群
胰腺组织中微生物群的丰度与患者的转移和总生存率相关。M. hyopneumoniae、Sitophilus zeamais、宋内志贺菌Shigella sonnei、肠道沙门氏菌Salmonella enteric的高丰度与转移呈正相关。
更具体地说,Acidovorax ebreus与PDAC患者的转移和高肿瘤分级相关。
长期、短期生存的菌群不同
对长期和短期生存的PDAC患者的肿瘤标本进行了16S rRNA测序,肿瘤内微生物群:
PDAC长期生存者:多样性高;以下菌丰富:Pseudoxanthomonas, Saccharopolyspora, Bacillus clausii, Streptomyces
PDAC短期生存者:拟杆菌,梭状芽孢杆菌
上述数据表明,确定微生物群进入胰腺的机制以及这些微生物与胰腺癌的进展和转移之间的关系还有很大的研究空间。
02 微生物群在新陈代谢中的潜在作用
宿主和微生物群形成共生关系。宿主可以通过其遗传、饮食摄入和生活方式影响微生物群的组成和生物量,而微生物群可以通过分泌微生物代谢物、代谢营养物、合成维生素和消化酶来影响宿主。
细菌成分及其代谢物可以渗透到宿主的体循环中,并被运输到发挥激素样作用的部位。这些生物活性代谢物调节宿主中的信号转导,以调节基因表达调节中涉及的各种途径。
代谢物对肿瘤的发生有促进和抑制作用
丁酸盐、乙酸盐和丙酸盐是主要的短链脂肪酸(SCFAs),由结肠中的粪肠球菌、双歧杆菌和梭状芽孢杆菌 等细菌产生,可发挥抗癌作用。
短链脂肪酸通过与游离脂肪酸受体(FFAR2/FFAR3)结合发挥作用,游离脂肪酸受体通常在癌细胞、基质细胞和肠细胞上表达,刺激G蛋白偶联受体,通过激活致癌途径(包括PDAC的AKT、ERK、mTOR和STAT3)促进肿瘤生长和转移。
对微生物代谢物在PDAC和胰腺中刺激FFAR2/3的作用的理解需要进一步详细研究。
改变的微生物群在PDAC免疫反应调节中的作用
Pandya Gouri,et al., Semin Cancer Biol, 2021
体外研究表明,丁酸盐可以减少PDAC细胞的增殖,同时诱导它们向分泌表型分化。
此外,透明质酸与丁酸盐的共轭物显示出在PDAC细胞中诱导细胞抑制作用。据报道,丙戊酸(一种合成SCFA)结合5-FU对PDAC细胞有抑制细胞生长的作用。
PDAC患者多胺代谢失调
在PDAC患者中,益生菌和产丁酸的细菌被大量抑制。细菌可以合成多种多胺,如腐胺、精胺、亚精胺和尸胺。据报道,在PDAC患者中,多胺代谢严重失调。在小鼠模型和患者血清样本中,多胺均上调,并随着肿瘤的进展而进一步增多。
微生物代谢物可作为非侵入性生物标志物
罗伊乳酸杆菌Lactobacillus reuteri 在4个月大的KPC(K-rasLSL.G12D; p53R172 H/+; Pdx1-Cre)小鼠肿瘤标本(K-rasLSL)中定殖。罗伊乳酸杆菌参与多胺代谢。与2个月大的KPC鼠血清标本相比,4个月大的KPC鼠血清标本中多胺的浓度显著高。这些结果表明,微生物代谢物可被开发并用作潜在的非侵入性生物标志物,用于PDAC病的诊断,尤其是在肿瘤变得可见和明显之前的早期阶段。
脂多糖是与炎症、代谢性疾病和胰腺癌相关的关键因素
在PDAC患者中,脂多糖存在于高度富集的革兰氏阴性菌的细胞壁上。
脂多糖与线粒体的代谢重编程有关,从而有助于糖酵解、活性氧和炎症导致肿瘤发生。
脂多糖如何导致免疫抑制?
脂多糖可以有效地与免疫细胞上的toll样受体相互作用,并募集MyD88/TRIF分子来刺激NF-κB和MAPK信号产生炎性细胞因子,从而导致免疫抑制。
代谢产物——脱氧胆酸(DCA)
一些肠道相关细菌代谢原始胆汁并形成脱氧胆酸(DCA)。DCA通过与TGR5 (G蛋白偶联的细胞表面BA受体)结合发挥作用,TGR5反过来刺激PDAC细胞中的EGFR、MAPK和STAT3信号,并进一步导致细胞周期的进展。
代谢产物——熊去氧胆酸
与此相反,熊去氧胆酸通过抑制PDAC细胞系上皮细胞向间充质细胞的转化而显示出抗癌作用。
γ -变形菌科合成酶将化疗药代谢成不活跃形式
肿瘤内细菌属γ -变形菌科,能够合成胞苷脱氨酶(CDD),该酶能有效地将化疗药物吉西他滨代谢成2',2'-difluorodeoxyuridine(不活跃的形式)。
说到化疗药物,为什么同样的药物治疗,有些人有效,有些人无效?这与微生物会有什么样的联系?
我们将在接下来的章节详细阐述。
03 微生物群在化疗中的作用
肠道微生物群在改变癌症治疗中药物治疗的疗效方面发挥着既定的关键作用。当然,化疗药物也会使肠道微生物群失调。
二十多年来,吉西他滨单独和/或与化疗剂/药物联合用于治疗PDAC病患者。
引起化疗耐药性——猪支原体
人皮肤成纤维细胞中猪支原体(Mycoplasma hyorhinis)的存在,在体外和小鼠模型中导致了对吉西他滨的抗性,其中它被代谢为其非活性和脱氨代谢物,名为2’,2’-二氟脱氧尿苷。
引起化疗耐药性——γ - 变形菌
除此之外,γ - 变形菌能够通过表达胞苷脱氨酶(CDD)的长形式灭活吉西他滨。分析113个PDAC患者组织样本时,86个样本(76%)显示了γ - 变形菌的存在。
在结肠癌小鼠模型中,γ - 变形菌诱导的吉西他滨耐药可通过联合应用环丙沙星抗生素逆转。表明这种耐药是可逆的。
引起化疗耐药性——大肠杆菌
大肠杆菌可导致几种药物如克拉屈滨、吉西他滨、CB1954、氟达拉滨的原始化学结构发生改变。
在体外和体内小鼠模型中,非致病性大肠杆菌菌株引起了对吉西他滨治疗的化学抗性。
改变微生物群——更好的抗癌效果
最近,FOLFRNOX已被用于针对PDAC患者的多中心试验。结果报告了比吉西他滨更好的长期生存率。在这些试验中,患者腹泻和恶心的发生率很高。表明药物可以改变微生物群以产生更好的抗癌效果。
其他代谢疾病与胰腺癌的相关性
另一方面,肥胖、2型糖尿病和胰腺癌病例增加之间有很强的联系。
在KC小鼠中,高脂肪热量饮食(HFCD)显示完整腺泡的丧失和胰腺上皮内瘤形成的发展。此外,在小鼠模型中,高脂肪热量饮食显示出明显的微生物群组成变化,特别是梭状芽胞杆菌。
二甲双胍对这些小鼠的治疗与KC小鼠中PDAC的抑制相关,Akkermansia的定植显著增加,梭状芽胞杆菌的丰度显著减少。二甲双胍通过降低循环中脂多糖的水平来促使HFCD-KC小鼠模型的肠道菌群失调。这可以进一步抑制胰腺中M1巨噬细胞的脂多糖依赖性极化,从而抑制上皮内瘤的形成。
药物联合益生菌抗癌
吉西他滨与益生菌联合给药后,随着波形蛋白和Ki-67表达的抑制,上皮内瘤PanIN的形成明显减少。
鼠伤寒沙门氏菌与吉西他滨和贝伐单抗的组合在PDAC异种移植模型中产生了协同抗肿瘤作用。
肠道微生物群在调节化疗反应、将药物代谢成非活性形式,甚至对某些药物产生化学抗性方面起着不可避免的作用,越来越多的临床研究证明了微生物群对化疗的影响。这为癌症患者的治疗目的操控肠道菌群提供了基础。
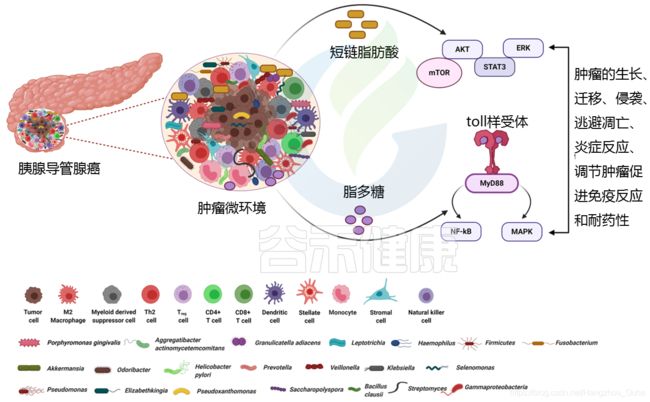
04 PDAC的微生物群和免疫调节
免疫系统和微生物群之间的健康互动对于健康的生活方式和身体稳态至关重要。微生物群的失调会导致全身炎症和细菌代谢物介导的免疫反应,这可能进一步促进免疫调节,从而促使癌症发生和发展。
在胰腺癌的发展过程中,已经观察到胰腺组织内的微生物群和免疫细胞之间存在复杂的关系。癌症免疫可以通过微生物群的存在来改变。
菌群与胰腺癌发生的关系
Thomas R M, et al.,Nature Reviews Gastroenterology & Hepatology, 2019
详见: 微生物,或许是下一个癌中之王(胰腺癌)诊断和干预治疗的新出路
微生物群对免疫系统的影响
当粘膜内层受到任何损伤时,微生物往往会进入肠道固有层,然后迁移到远处的淋巴器官,激活宿主免疫系统。PDAC肿瘤微环境基本上与免疫细胞交织在一起,其中免疫细胞与某些炎症因子一起负责促进肿瘤发生、免疫细胞浸润和疾病进展。
微生物衍生产物或代谢物,如脂蛋白、脂多糖、脂肽、单链或双链DNA,甚至CpG DNA可以有效地结合PPRs以激活TLRs,TLRs通过抑制胰腺癌的免疫反应在炎症和肿瘤发生过程中起关键作用。这与NF-κB和MAPK信号通路的激活有关,导致产生促进肿瘤的细胞因子和其他促炎分子,从而导致癌症的发展。
假长双歧杆菌促进肿瘤发生(TLRs)
假长双歧杆菌Bifidobacterium pseudolongum在肠道和肿瘤区域高度占优势,通过TLR介导的信号传导促进侵袭性肿瘤发生,TLR4和TLR7在PDAC的肿瘤微环境中特别强有力地表达。有研究显示,刺激TLRs会导致胰腺炎,并与K-ras协同促进胰腺癌在动物模型中的发展。
TLR7在人和鼠胰腺癌标本中有强有力的表达,并显示出刺激MAPK、NF-κB、STAT3和Notch信号以增强致癌作用。TLR7阻断可以通过阻止以上通路刺激,从而抑制胰腺癌。
肠道微生物群影响抗癌免疫治疗反应
肠道微生物群(脆弱双歧杆菌、双歧杆菌)的组成通过阻断CTLA-4和PD-1影响抗癌免疫治疗反应。
PDAC肿瘤微环境的产生在小鼠模型中具有免疫抑制作用,这归因于特定的肠道和胰腺内微生物。这也证明了随着免疫治疗抗性的增强,癌症进展的增强。
此外,微小核糖核酸与PDAC患者的生长、血管生成、化疗耐药性和转移增加有关。已知某些微生物如幽门螺杆菌和鼠伤寒沙门氏菌也能调节上述微小核糖核酸的表达,而这些微小核糖核酸又能调节宿主的免疫反应。
这表明肠道微生物群控制宿主免疫反应,从而提高免疫疗法的有效性,并在与PDAC相关的癌症领域具有巨大的意义。
05 基于微生物的治疗潜力是PDAC患者的希望
微生物具有巨大的潜力,可用于设计不同的治疗方法,以对抗疾病的发展和进展。更具体地说,新出现的证据表明,微生物可能导致人类对恶性肿瘤的易感性,也可能影响对治疗的反应,还可能影响治疗相关的毒性。
用有益菌如拟杆菌和伯克霍尔德氏菌Burkholderiales恢复肠道提高了CTLA-4封闭的治疗效果。
双歧杆菌的存在增强了PDL-1阻断的抗癌潜力。
因此,微生物群的保护和恢复对改善治疗效果至关重要。
粪便微生物群移植(FMT)是一种直接有效的方法。肿瘤小鼠接受了来自短期生存期PDAC患者、长期生存期无疾病证据(LTS-NED)和健康对照组的粪便微生物群,发现肿瘤生长明显减少。这表明,在PDAC鼠模型中,来自长期存活者的FMT比来自短期存活者或没有PDAC的那些接受FMT的人对肿瘤有更好的保护作用。
此外,FMT在应对化疗的副作用方面显示出潜力,化疗会导致其他恶性肿瘤如转移性肾细胞癌的腹泻。这表明,用益生菌恢复肠道是一种可行的方法,可以与其他治疗方案一起使用,并且在治疗癌症方面可能非常有效。
目前这些研究探索了微生物群的多样性和组成,以及患者的菌群失调,与健康人的差异等,尽管还需要做深入研究,但这个方向的探索对于癌症治疗无疑是很有希望的。
06 关于胰腺癌的预防
虽然说没有完全避免胰腺癌的特定方法,但以下方法可以降低风险:
■ 戒烟
可避免的最重要的风险因素,戒烟有助于降低患胰腺癌风险
■ 维持正常体重
如果你现在正处于超重或肥胖阶段,减肥有助于降低胰腺癌风险;适当进行锻炼
■ 健康饮食
加工过的红肉和含糖饮料也可能增加患胰腺癌的风险。美国癌症协会建议遵循包括大量水果、蔬菜和全谷物在内的健康饮食模式,并限制或避免红肉和加工肉类、含糖饮料和高度加工食品
■ 不酗酒
大量饮酒与胰腺癌有关,也可能患上慢性胰腺炎,后期有发展成为胰腺癌的风险
■ 避免使用工作场所化学品
工作场所中的某些化学品会增加患胰腺癌和其他癌症的风险
■ 进行肠道菌群检测
维持一个相对健康的肠道菌群,监测健康状态,降低胰腺癌的风险
07 结语
微生物组是一个新兴的前沿领域,它为胰腺癌的诊断、预后和转移的新生物标志物等提供了新的方向。
微生物治疗的个性化在于每个个体微生物群具有独特性,微生物群又与日常饮食,生活习惯,慢性病等息息相关,通过这些方式的改变使菌群维持或恢复到相对健康的状态,这对于胰腺癌及其他癌症的预防、治疗具有重大意义。
主要参考文献:
G.A. Vitiello, D.J. Cohen, G. Miller, Harnessing the microbiome for pancreatic cancer immunotherapy, Trends Cancer 5 (11) (2019) 670–676.
R. Mendez, K. Kesh, N. Arora, L. Di Martino, F. McAllister, N. Merchant, S. Banerjee, S. Banerjee, Microbial dysbiosis and polyamine metabolism as predictive markers for early detection of pancreatic cancer, Carcinogenesis 41 (5) (2020) 561–570.
R.M. Thomas, R.Z. Gharaibeh, J. Gauthier, M. Beveridge, J.L. Pope, M.V. Guijarro, Q. Yu, Z. He, C. Ohland, R. Newsome, J. Trevino, S.J. Hughes, M. Reinhard, K. Winglee, A.A. Fodor, M. Zajac-Kaye, C. Jobin, Intestinal microbiota enhances pancreatic carcinogenesis in preclinical models, Carcinogenesis 39 (8) (2018) 1068–1078.
Pandya Gouri,Kirtonia Anuradha,Singh Aishwarya et al. A comprehensive review of the multifaceted role of the microbiota in human pancreatic carcinoma.[J] .Semin Cancer Biol, 2021
B. Gupta, D. Sadaria, V.U. Warrier, A. Kirtonia, R. Kant, A. Awasthi, P. Baligar, J.K. Pal, E. Yuba, G.Sethi, M. Garg, R.K. Gupta, Plant lectins and their usage in preparing targeted nanovaccines for cancer immunotherapy, Semin. Cancer Biol.(2020).
J. Chakladar, S.Z. Kuo, G. Castaneda, W.T. Li, A. Gnanasekar, M.A. Yu, E.Y. Chang, X.Q. Wang, W.M. Ongkeko, The pancreatic microbiome is associated with carcinogenesis and worse prognosis in males and smokers, Cancers 12 (9) (2020).
J.S. Chang, C.R. Tsai, L.T. Chen, Y.S. Shan, Investigating the association between periodontal disease and risk of pancreatic Cancer, Pancreas 45 (1) (2016) 134–141.
H. Tilg, T.E. Adolph, Beyond digestion: the pancreas shapes intestinal microbiota and immunity, Cell Metab. 25 (3) (2017) 495–496.
Can Pancreatic Cancer Be Prevented? American Cancer Society. May 31, 2016.