动态功能连接
导读
静息态功能磁共振成像(rs-fMRI)通常用于研究大脑不同区域如何相互作用,从而使我们能够表征大脑的功能连接(FC)。然而,大脑会经历不同的状态,FC并不是一成不变的。脑区之间的连接会动态变化,这在整个扫描过程中都可以观察到。这为表征大脑的动态特性(即动态功能连接(dFC))提供了机会,并且能够捕获不同大脑状态和支持认知与行为的持续神经调节。本文以预处理的rs-fMRI数据为起点,描述了不同的连接技术(即基于功能共激活的dFC,如滑动窗口和协同波动,或者基于共振的dFC,如相位同步)。然后,回顾了最常用的特征提取技术,概括了FC随时间的动态变化,例如平均同步或亚稳态。虽然侧重点是rs-fMRI应用,但是所介绍的大多数技术也可以适用于基于任务的fMRI。
方法
本文中描述的方法适用于对rs-fMRI信号进行预处理后,从个体素或对脑区进行平均(这里统称为节点,除非另有说明)得到的BOLD信号。假设此类信号已正确预处理,从rs-fMRI数据到预处理时间序列的一系列步骤如图1所示。输入数据应该是形状为n×t的矩阵,其中n是大脑节点的数量,t表示BOLD信号的时间点。需要注意的是,图像采集和预处理过程中所做的选择会影响所观察到的动态功能连接估计值。
图1.本文描述的方法适用于rs-fMRI信号预处理后从单个体素或脑区平均获得的BOLD信号。
本文中的方法已用Python编程语言实现,可在以下存储库中获取:https://github.com/CoDe-Neuro/dynfc。有关如何使用存储库中的例程生成本文中其余图形的教程可以在https://code-neuro.github.io/dfc_chapter/中找到。
时间分辨功能连接
有几种方法可用于估计不同大脑节点之间的动态连接,本文将介绍三种方法:基于共激活的方法,基于共振荡的方法以及包括使用区域特性和频率波动的其他方法。对于共激活和共振荡部分,这些方法以成对的方式得到一个连接矩阵,该矩阵包含对每对脑节点的评估指标。这些方法会产生一个相似性或连接性矩阵,该矩阵可以是二进制的或加权的,并具有不同大脑节点如何相互作用的信息。矩阵信息的确切含义取决于应用于分析的指标。接下来,将讨论一些最常见的方法,并提供相应的示例。
①基于共激活的方法
滑动窗口
研究dFC最常见且最直接的方法是窗口法。这需要通过选择一个固定长度的时间窗从fMRI信号中创建段。然后利用该窗口中的数据点来计算给定的功能连接测量值。该窗口随后按固定数量的数据点在时间上移动,并在连续的数据段上计算功能连接。这生成了FC的时间分辨测量,被认为反映了大脑功能活动的时间变化。图2呈现了该过程的示意图。原则上,只要窗口包括足够的时间点来稳健地量化功能连接测量,通常从整个扫描中计算的任何测量都可以使用窗口法。
图2.采用滑动窗口法提取dFC矩阵。
然而,使用这种方法需要注意的是选择合适的窗长并没有“黄金标准”。选择足够长的窗口以确保对FC的可靠估计,同时也要确保窗口足够短以便检测瞬时变化,这两者之间需要进行权衡。虽然建议避免窗口短于预处理fMRI数据中存在的最大波长,除此限制之外,窗长的选择是任意的,并且目前对最合适的窗长缺乏共识。最常见做法是使用长度为30-60s的窗口,但文献中也存在使用更长的窗口,长达240s。
对于其他重要参数(包括步长和窗口形状)的最佳实践也缺乏一致意见。值得注意的是,窗口可以是重叠的或非重叠的,其中重叠的窗口移动的步长小于总窗长,从而产生相交的窗口。在非重叠窗口中,连续数据段之间没有重叠。窗口也可以有不同的形状,最常见的是矩形窗和锥形窗。窗口形状决定了每个窗内数据的加权方案。由于如何选择最佳滑动窗参数的讨论仍存在争议,建议读者参考Leonardi和Van De Ville(2015),Mokhtari等人(2019)和Preti等人(2017)的研究。
协同波动
与窗口法相比,另一种方法是评估矩到矩的协同波动模式,该模式量化了各区域在每个时间点上的一致波动幅度。为此,对于每对脑节点,获取脑区BOLD时间序列z得分后的元素积,为每个网络边缘提供时间序列。类似的方法有Shine等人(2015)研究所提出的时间导数的乘积(MTD),其中通过将每对节点的时间序列的标准化时间导数相乘来推断动态功能连接(dFC)。
这些区域间的共波动网络边缘时间序列可以直接进行分析,以探索在评估静态功能连接(sFC)时的共波动幅度、时间以及评估瞬时共波动对整体功能连接模式的影响。高振幅共波动事件被认定为多个边缘共波动的周期。相反,低振幅帧是边缘之间低共波动的周期。
给定来自两个不同脑区i和j,且两个长度为t的BOLD时间序列,即xi=[xi(1),…,xi(t)]和xj=[xj(1),…,xj(t)],首先计算每个节点i的序列的z分数,共波动边缘的时间序列为:
其中μi和σi分别为节点i时间的均值和标准差。获得z分数后,区域i和j的共同波动可以简单地计算为:
![]()
如果Zi和Zj编码的都是正值或负值,则结果应该是一个正值,这意味着两个区域显示出一致的变化。相反,如果Zi和Zj分别编码正值和负值(或者负值和正值),则变量dFC(i,j,t)为负值,这表明两个区域之间的变化不一致。捕捉节点i和j之间共波动的相关性可以计算为:
变量rij表示一对节点之间的相关性,它反映了通过所有可用时间点动态连接的全局特征,相当于sFC。边缘时间序列(共波动/协同波动)和sFC(相关矩阵)之间关系的可视化表征如图3所示:共波动序列的时间平均rij等价于sFC矩阵的上三角形。
图3.通过共波动方法获得的边缘时间序列。
②基于共振的方法
相位同步
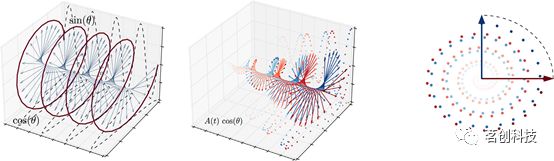
相位同步分析是估计不同脑结构之间时变连接性的一种常用方法。相位同步方法基于提取每个节点信号的相位,并以成对方式评估相位差。这种技术要求首先将时间序列进行窄带带通滤波,通常是“slow4”(0.04-0.07Hz),尽管在0.01-0.10Hz范围内稍宽一些的频带也可以考虑。窄带滤波允许使用解析表征来表示时间序列。解析信号将窄带信号s(t)表示为一个具有瞬时相位φ(t)和振幅A(t)的旋转向量,即s(t)=A(t)cos(ωt+φ(t))。如图4所示,信号的相位φ(t)可以从复信号z(t)=s(t)+i·H[s(t)]中获取,其中i是虚数单位,H[s(t)]是s(t)的Hilbert变换:
图4.由信号的解析表达式可以得到信号的相位。
给定一对脑区i和j,它们各自的时间相位信号由φi(t)和φj(t)表示,相位差Δφij(t)=| φi(t)-φj(t)|的取值范围在0和π之间。通过将相位差归一化到0和1之间,可以得到时间t的dFC实例,即dFC(t)=|(Δφij(t)-π)/π|,其中0表示相位相反,1表示完全相位同步。另外,还可以通过将dFC归一化到-1和1之间,得到dFC(t)=cos(φi(t)-φj(t)),其中-1表示相位相反,1表示完全同步,0表示φi和φj正交(Δφij(t)=π/2)。主对角线上的元素表示处于同相位(dFC(t)=1)的状态。这一步允许使用信号相位来对不同的脑区进行比较以探究潜在的相互作用。
③其他方法
局部动态
在静态功能连接(sFC)分析中,假设大脑活动随着时间的推移是稳定的,局部一致性(ReHo)已成为提取局部短程功能连接特征的常用方法。ReHo的概念涉及将一个灰质体素的BOLD时间序列与其26个相邻体素进行比较,并在时域或频域计算一致性值,例如Kendall系数,作为BOLD信号局部一致性的体素度量。类似地,可以从滑动窗口或从瞬时解析的dFC矩阵中轻松地生成时域分辨(动态)的ReHo观测值,这些矩阵是通过相位同步获得的,被称为动态区域相位同步(DRePS)度量方法。
频率波动动态
sFC中另一种常用的方法是研究整个时间序列的低频振幅(ALFF)和分数低频振幅(fALFF)技术。简而言之,ALFF涉及对低频(通常<0.1Hz)中的频谱绝对振幅进行表征,而fALFF评估的是频谱在低频段相对于整个频谱的相对振幅。这种技术通过滑动窗口计算ALFF和fALFF,它捕捉了低频波动随时间的变化,从而实现对大脑活动的动态ALFF分析。
动态功能连接中的维数问题
共激活和共振荡方法都适用于从基于体素或脑区的分析中获得连接矩阵。然而,当涉及到时间时,这些数组的维数会快速增长。高维问题是计算机科学领域(机器学习和模式识别)中的一个常见挑战,有几种技术可以解决这个问题。接下来将介绍dFC分析中常用的两种技术:主成分分析(PCA)和主导特征向量动力学分析(LEiDA)。
①主成分分析(PCA)
主成分分析(PCA)是一种常见的降维方法,它将数据投影到不同(正交)的坐标系中。在动态功能连接(dFC)中,通常使用PCA来规避数据的高维特性。假设对n个节点进行连接估计,时间分辨功能连接中所描述的方法将返回一个维度为n×n的连接矩阵。假设连接矩阵是对称的(无向的),这种结构将存储[n(n-1)]/2个唯一元素(上三角或下三角)。
PCA可以应用于此类数据的降维,方法是将上三角整形为一个向量,并将它们堆叠成形状为
![]()
的矩阵,其中t表示序列的时间点。这个过程可以用来用表示维数减少后的连接随时间的变化,例如,取前三个成分,那么低维特征将具有t×3维。PCA也可以与后面讨论的其他方法相结合,这对于动态功能连接分析中的某些聚类方法至关重要,如Lord等人(2019)和Vohryzek等人(2020)的研究所示。
②主导特征向量动力学分析(LEiDA)
LEiDA是一种旨在降低时间分辨连接网络维度的方法。该方法通过将连接矩阵分解为特征向量,并将第一个特征向量作为连接矩阵的代表。在时间t上,连接n×n矩阵的主导特征向量V1(t)是一个维度为n×1的向量。图5提供了一个可视化表示。
图5.在LEiDA方法中,dFC矩阵的特征向量分解示意图。
第一个特征向量可以捕获网络中的模块化结构,据报道它可以解释dFC矩阵随时间变化至少50%的总方差。此外,与直接使用全时间分辨连接矩阵相比,LEiDA对高频噪声更具鲁棒性。如果将LEiDA向量转置并垂直堆叠,得到的是一个t×n的矩阵。在获得LEiDA向量之后可能还需要应用PCA来评估功能连接的动态性。
分析动态
通过捕获时间序列的时间分辨表征,可以评估动态功能连接(dFC),无论是否进行了降维处理。这里考虑两种主要的研究dFC的方法:全局方法和模块化方法。全局方法旨在获得表征所有时间序列动态行为的唯一标记,通常是同步性和亚稳态。相反,模块化指标根据这些区域在不同时间点的信号相似性来寻找具有共同属性和属性标记的区域或区域组。
①全局动力学:同步性和亚稳态
相位同步方法常用于表征大脑的全局动态。在每个时间点上,可以用Kuramoto序参量来量化所有脑区之间的全局相位同步水平,定义为
![]()
,其中N是节点数,φj(t)是节点j在时间t上的瞬时相位。Kuramoto序参量旨在量化相位振荡器集合中的全局同步水平,它随着系统中所有ROIs对之间的全局同步水平的增加而单调递增,其中0表示完全异步,1表示完全同步。在每个时间点上定义Kuramoto序参量,将空间相干性的演变描述为时间的函数,因此可以在所有时间点对其进行平均,以获得表征每个个体平均同步水平的全局特征。Kuramoto序参量方差的测量,比如熵或者随时间变化的标准差,可用于评估dFC的瞬态,或者所谓的大脑亚稳态。
亚稳态分析的研究在典型脑功能和临床队列中变得越来越常见。例如,Lee和Frangou(2017)的研究显示了静息态网络(RSN)特征和亚稳态动力学之间的关系,高阶RSNs表现出较低的亚稳态,Alderson等人(2020)报告了认知控制网络内在亚稳态与流体智力之间的关联。许多研究还显示出亚稳态变化与临床状况之间的关系。例如,在创伤性脑损伤后,亚稳态下降与认知灵活性和信息加工能力下降有关。在精神分裂症患者中,突显网络的亚稳态增加与阴性症状相关,Co´rdova-Palomera等人(2017)的研究发现,全局亚稳态降低与阿尔茨海默病相关。
②模块化动力学分析:识别状态及其动态特性
模块化方法基于功能连接矩阵来评估功能动态。这个过程通常使用聚类技术来完成。聚类是一种将数据进行标记的方法,适用于没有预先建立分类的情况。尽管目前有几种不同的数据聚类方法(例如,k均值、谱聚类),但最适合的方法还是取决于数据类型和研究问题。
通常,dFC(t)时序对之间的相似性可以通过递归矩阵或dFC(t)矩阵在不同时间点之间的Pearson相关性来获得(示例见图6)。该递归矩阵描述了具有高度相关性的blocks随时间变化的连接动态。
图6.递归矩阵(或dFC矩阵)。
结论
迄今为止,大多数研究都集中在时域中的功能耦合变化上;要么评估不同大脑状态随时间的变化,要么评估空间固定节点(体素或脑区)耦合强度的时间变化。然而,这种方法并未捕获到大脑功能组织的任何空间变化。虽然评估时间动态的研究是在节点上进行的,节点是固定的空间位置,但旨在捕捉时间和空间变化的研究引入了源的概念,源与节点的不同之处在于,它们的空间位置可以随着时间变化。例如,随着时间的推移,源的大小可能会增加或减小,改变形状或在空间中移动其位置。假设源的空间分布存在这种变化,使用空间固定节点进行分析的有效性可能会受到影响。因为同一空间解剖位置在不同时刻可能具有不同的源。因此,需要有进一步的研究在动态分析中明确地捕捉空域和时域的变化。总的来说,这是一个年轻但非常有前景的研究领域。它既具有挑战性,也充满了潜力。毕竟,大脑功能是非静态的,因此大脑动态必须与解释认知结果的基本属性以及与典型和非典型神经发育、神经系统和精神疾病相关的复杂微妙变化密切相连。
参考文献(上下滑动查看):
Leonardi N, Van De Ville D. On spurious and real fluctuations of dynamic functional connectivity during rest. Neuroimage 2015;104:4306. Available from: https://doi.org/10.1016/j.neuroimage.2014.09.007.
Mokhtari F, Akhlaghi MI, Simpson SL, Wu G, Laurienti PJ. Sliding window correlation analysis: Modulating window shape for dynamic brain connectivity in resting state. Neuroimage 2019; 189:65566. Available from: https://doi.org/10.1016/j.neuroimage.2019.02.001.
Preti MG, Bolton TA, Van De Ville D. The dynamic functional connectome: State-of-the-art and perspectives. Neuroimage 2017;160:4154. Available from: https://doi.org/10.1016/j.neuroimage.2016.12.061.
Shine JM, Koyejo O, Bell PT, Gorgolewski KJ, Gilat M, Poldrack RA. Estimation of dynamic functional connectivity using multiplication of temporal derivatives. Neuroimage 2015;122:399407. Available from: https://doi.org/10.1016/j.neuroimage.2015.07.064.
Lord L-D, Expert P, Atasoy S, Roseman L, Rapuano K, Lambiotte R, et al. Dynamical exploration of the repertoire of brain networks at rest is modulated by psilocybin. Neuroimage 2019;199:12742. Available from: https://doi.org/10.1016/j.neuroimage.2019.05.060.
Vohryzek J, Deco G, Cessac B, Kringelbach ML, Cabral J. Ghost attractors in spontaneous brain activity: recurrent excursions into functionally-relevant BOLD phase-locking states. Front Syst Neurosci 2020;14:115. Available from: https://doi.org/10.3389/fnsys.2020.00020.
Co´rdova-Palomera A, Kaufmann T, Persson K, Alnæs D, Doan NT, Moberget T, et al. Disrupted global metastability and static and dynamic brain connectivity across individuals in the Alzheimer’s disease continuum. Sci Rep 2017;7:114. Available from: https://doi.org/10.1038/srep40268.
Lee WH, Frangou S. Linking functional connectivity and dynamic properties of resting-state networks. Sci Rep 2017;7:16610. Available from: https://doi.org/10.1038/s41598-017-16789-1.
Alderson TH, Bokde ALW, Kelso JAS, Maguire L, Coyle D. Metastable neural dynamics underlies cognitive performance across multiple behavioural paradigms. Hum Brain Mapp 2020;41:321234. Available from: https://doi.org/10.1002/hbm.25009.