意大利国家肿瘤治疗中心的BNCT项目(2023)
硼中子俘获疗法进展
Advances In Boron Neutron Capture Therapy
出版:IAEA
2023年
意大利国家肿瘤治疗中心的BNCT项目
S. AGOSTEO1,2、S. ALTIERI1,3、F. BALLARINI1,3、D. BETTONI1、G. M. CALVI4、V. CONTE1、C. LEE5、L. LICITRA6、P. CIRRONE1、A. FACOETTI6、F. FORNERIS3、P. FRANZOSI4、C. FERRARI3、M. FERRARINI6、G. MAGRO6、S. MOLINELLI6、M. NECCHI6、O. NICROSINI1、E. ORLANDI6、A. PEDOTTI2、P. Pedrazoli3、I. Positma1、N. PROTTI3、A. RETICO1,3、S. ROSSI6、A. SERRA6、G. VAGO6、G. VENCHI6、V. VERCESI1、G. ZANONI3
1意大利INFN国家核物理研究所
2意大利米兰理工大学
3意大利帕维亚大学
4意大利卡尔维工作室
5美国 加利福尼亚州 Foothill Ranch TAE生命科学
6意大利 帕维亚16600 Strada Campeggi 23 CNAO基金会
摘要
在意大利帕维亚的国家肿瘤强子治疗中心(CNAO),一个新的项目正在进行中,除了质子和碳离子的现代疗法之外,还将引入硼中子俘获疗法(BNCT)。2020年11月,TAE生命科学(TLS)和CNAO基金会签署协议,在CNAO建立一个配备专用串列加速器的新设施,以执行BNCT治疗。该合作旨在在CNAO的临床和研究环境中创造最佳条件,以实现使用这种创新模式治疗患者的目标。
Pavia在BNCT的历史上占有一席之地。BNCT的研究自1980年代以来一直在进行,利用了该大学的核研究反应堆(应用核能实验室,LENA)。这项研究开始于一个具有挑战性的移植和照射器官的方案,并促成了两名患者(2001年和2003年)的肝脏离体BNCT的临床应用。
为了取得成功,BNCT需要多学科的方法。已经建立了一个包括CNAO、INFN、帕维亚大学和米兰理工学院在内的合作网络,并与国际研究小组建立了联系,旨在解决以下基本主题:监管方面、放射生物学、计算剂量测定和治疗计划、实验和环境剂量测定、硼测量和临床剂量测定、BNCT的临床试验程序以及新型含硼化合物的开发。
1 简介
在意大利帕维亚的国家肿瘤治疗中心,质子和碳离子的现代疗法拓宽了可以控制的肿瘤的范围。然而,有许多患者由于疾病的性质或部位而不能得到治疗。对他们来说,BNCT代表了一种新颖、有意义的方法。BNCT是一种放射治疗的实验形式,其基础是在灌注硼药物后对肿瘤进行中子照射,硼药物可将硼原子(10B)集中在肿瘤细胞中。10B上的热中子俘获反应很可能产生两个电离粒子:α粒子和7Li离子。这些粒子在相当于细胞直径的距离内失去所有能量,当它们通过细胞核时,会对DNA造成不可修复的损伤。
迄今为止,BNCT的临床应用主要用于治疗脑肿瘤,如多形性胶质母细胞瘤、恶性脑膜瘤、黑色素瘤转移瘤和头颈部肿瘤[IV-1-IV-5]。其中,头颈部肿瘤可能是最成功的靶点,可能是新中心临床试验的一个有意义起点。
Pavia在BNCT的历史上占有一席之地。BNCT的研究自1980年代以来一直在进行,利用了该大学的核研究反应堆(应用核能实验室,LENA)。这项研究从一个具有挑战性的移植和照射器官的方案开始,并促成了两名患者(2001年和2003年)肝脏的体外BNCT的临床应用[IV-6-IV-7]。这一经验对于继续和促进帕维亚大学各小组以及INFN和其他合作机构的研究活动至关重要。
2 项目
最近发展的紧凑型加速器中子源取代了核反应堆,代表了BNCT领域最重要的创新[IV-8],并允许在医院环境中部署和应用该技术。2020年11月,TLS和CNAO基金会签署了一项协议,在CNAO建立一个配备专用串列加速器的新设施,以执行BNCT治疗。该合作旨在在CNAO的临床和研究环境中创造最佳条件,以实现使用这种创新模式治疗患者的目标。第IV-2.1节介绍了基于加速器的BNCT系统特性,第IV-2.2节概述了设施设计和布局。
为了取得成功,BNCT需要多学科的方法。这种方法涉及物理学家和工程师设计和实施所需的技术,以生产和利用有效和安全的中子束;研究和优化硼生物分布和分析放射性生物效应的化学家和生物学家;医学物理学家和内科医生,负责剂量学、治疗计划的制定和患者管理。因此,已经建立了一个由CNAO、INFN、帕维亚大学和米兰理工学院组成的合作网络,并与国际研究小组建立了联系,以解决以下基本主题:监管方面、放射生物学、计算剂量测定和治疗计划、实验和环境剂量测定、硼测量和临床剂量测定、BNCT的临床试验程序以及新型含硼化合物的开发。第IV-2.3节描述了这七个领域的基本活动。
2.1系统
2.1.1串列加速器
CNAO的BNCT将使用TLS的Alphabeam系统,其中子源由标称运行能量为2.5 MeV的强流(标称10 mA)质子束和锂靶组成。紧凑型串列加速器(图IV-1)将产生所需能量和强度的直流束流。
加速器被称为“串联”,因为它两次使用相同的加速电压。负氢离子被注入入口,并通过朝向柱状几何体中心的正电势梯度加速。位于加速器中心的电荷交换器从负离子中剥离出两个电子,将它们转换成带正电的质子。使负离子向中心加速的电压梯度现在使质子从中心加速到入口另一侧的出口。加速电压降低到标称电压的一半,通过简化静电绝缘要求,使加速器更紧凑。
加速器电压梯度由一系列嵌套电极和一个高压电源组成,通过高压馈通柱连接。电源和馈通的下部封装在静电容器(ELV)中,该静电容器延伸至串列加速器下方。利用真空和介质气体(SF6)的组合防止加速器和ELV中的静电击穿。串列加速器和ELV的设计是Budker核物理研究所创建的真空绝缘串列加速器(VITA)的扩展[IV-9]。
图IV-1 串列加速器和ELV
2.1.2低能束线和前置加速器
一组被称为低能束线(LEBL)的组件产生负离子源引入串列加速器。它包括超高纯度氢气气源;负氢离子源;用于射束控制和聚焦的静电和磁性元件;空气、水冷和真空系统;以及在进入串列加速器之前将束流能量增加到80-180 keV的前置加速器。这些组件位于一个隔离的高达180 kV的单个高压平台上。
负氢离子源的设计工作电流高达15 mA,为10 mA的标称工作质子电流提供裕度。负离子束使用XY位置移位器、束流剖面仪和电流监测器的组合来保持束流形状和方向性。它还包括一个法拉第杯,以支持射束的表征和调整。束流刮除器也能去除任何束晕,防止杂散离子进入加速器。
2.1.3高能束线
高能束线(HEBL)系统支持将全能量质子束从串列加速器出口传输到多个治疗室。射束线包括铝质束流管和法兰、真空泵、用于引导和聚焦射束的磁铁、诊断组件、射束转储和靶组件(每个治疗室一个靶)。HEBL磁铁包括:
- 改变射束方向的二极磁铁;比如,90°弯转磁铁,将加速器的射束引导至两个治疗室;
- XY移动磁铁,使射束沿真空室中心线对准;
- 用于射束聚焦的四极磁铁;
- 光栅扫描磁铁,用于将射束改变为围绕靶总表面积上的点。射束光栅扫描改善了靶的热管理。
CNAO的设施配置需要一系列的两个90°弯转(二级)磁铁:由于中子从每个靶回流到对面的房间,无法使用单个分束器从单个磁铁向左或向右发送射束。束流转储设计用于在磁铁失去电源的情况下根据需要接受全束流,也用于系统调试期间。
束线组件的支架设计满足结构刚性、位置可调性和减少中子活化。使用高度精确的对准系统将所有LEBL、加速器和HEBL组件安装在一致的三维坐标系中。
2.1.4中子产生靶
BNCT靶组件由一层自然锂沉积在带有冷却通道的铜背衬盘上组成。用于BNCT治疗的中子来自吸热的7Li(p,n)7Be反应,其中约92%的天然Li为7Li同位素。
2.5 MeV质子一旦穿透锂表面,就会持续减速,产生中子,直到减速到1.88 MeV的反应阈值能量以下。这种能量损失发生在90 μm的距离上;额外的锂厚度会增加锂的最高温度,而不会产生更多的中子。此外,放射性质子俘获和非弹性质子散射反应将产生更多的γ射线,被认为是临床BNCT束的污染物。通过铜衬垫的冷却水保持90-100 μm Li层低于约150°C,以防止靶熔化。在锂靶表面光栅扫描质子束对保持靶温均匀性也很重要。
(p,n)反应的7Be产物具有放射性,半衰期为53天,大约10%的衰变产生478 keV的伽马射线。当新靶照射质子束时,靶中7Be的量将增加,并在HEBL和治疗室中产生伽马射线源。靶组件将定期更换,以保持其表面剂量率足够低,以便安全地从束线移除,并储存在专门的冷却位置。除7Be外,由于强中子场,靶组件中的其他组件将具有放射性,包括铜、铝和微量锰的天然同位素。组分的半衰期将比7Be短得多,28Al为2.25分钟,64Cu为12.7小时。为了减少HEBL中活化的靶组件对人员的整体照射,每条射束线的末端将被安置在带有屏蔽门的小凹室中。
2.1.5中子源模型
对于撞击Li靶的单能质子笔形束,产生了强烈依赖于发射角θn的中子能量En能谱[IV-10]。相对中子分布是质心框架∂σpn/∂ΩCM中的(p,n)微分截面的函数,通常作为质心框架中的质子能量Ep和中子发射角(θCM)的函数制成表格。然而,由于7Li中(p,n)反应的运动学约束,只有一个(En,θn)组合对应于特定的(Ep,θCM)对,从而允许厚靶中子产额(质子能量的积分)的计算坍塌为逐点函数:
式中S(Ep)是自然Li中质子的阻止本领,∂θL和∂ΩCM是实验室和质心框架中的微分立体角元素,K是常数。
该中子产额表达式没有考虑能量或角度离散,但1.88-2.5 MeV范围内质子离散的相对量是有限的(图IV-2),将这些结果与包含离散的蒙特卡罗模型进行比较,结果差异最小。通过改变常数K和新的阻止本领,可以很容易地调节Li化合物的表达式。
图IV-2 中子能量、发射角和相应质子能量的关系
2.1.6射束整形组件和准直
临床BNCT中子束理想情况下由超热中子(从0.5-1.0 eV到10-30 keV)组成,受快中子、热中子和光子的污染最小[IV-11]。然而,锂上2.5 MeV质子产生的中子的最大能量略低于800 keV。需要一种称为射束整形组件(BSA)的精心选择的材料的静态布置,以通过明智的慢化和反射中子,以及吸收热中子和离开表面的光子,将初始中子调整为临床有用的中子源。
BSA的内芯具有低Z非含氢散射材料层,与具有高Z元素和同位素组合的化合物层交替布置,在超热区域上方具有大的散射共振,在超热区域中具有有限共振,例如镁、铝和氟。这种布置在将中子减速一个有限量方面非常有效,因此与单独使用这些材料时相比,可以更频繁地遇到大的共振。BSA的外层使用不同的材料来快速慢化和俘获逃出反射体区域的中子。BSA的总质量超过3吨,主要是由于大量的铅用作反射体和光子屏蔽。
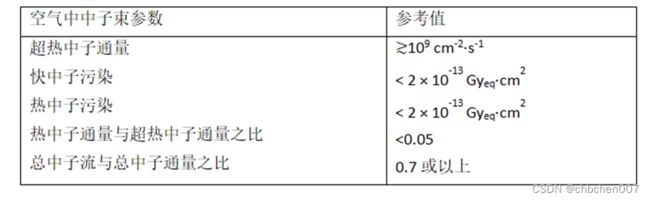
BSA的设计有两个相互关联的指南:表IV-1所示的原始IAEA TECDOC-1223[IV-11]中的空气中射束参数和剂量学参数,如优势深度和治疗比。用两组指标评估BSA设计是很重要的;对于TAE Life Sciences的BSA,在设计决策时更优先考虑剂量学参数。因此,并非所有IAEA空气中射束参数都能实现,但这是一个有意的决定,可改进其他指标,如肿瘤的最大可实现剂量、最大可实现治疗深度(单束)和典型治疗时间。
表IV-1 参考文献[IV-11]中的空气中中子束参数
BSA开放的射束端口直径为25 cm,圆形准直器的标称直径范围为8 cm至20 cm,可用于患者治疗。准直器是联锁的,以防止无意中使用与计划不同的准直器进行治疗。另外,当不进行治疗以减少人员辐射照射时,使用可移动光子屏蔽体来阻断BSA。准直器更换设计为旨在保持临床医生与BSA的距离,并将可移动光子屏蔽保持在适当位置。
2.1.7患者定位系统
患者治疗定位采用6自由度机器人,该机器人安装在天花板上,线性轨道垂直于治疗射束中心线。该机器人设计用于支持碳纤维治疗床,以及未来的坐姿治疗选择。治疗室的尺寸允许治疗床的底座在治疗期间停留在导轨的远端,以尽量减少中子活化。
碰撞传感器与控制软件一起使用,以防止治疗床与BSA、准直器或可移动光子屏蔽发生碰撞。地面安装的光学控制装置也用于保持毫米级的治疗床定位再现性。
2.2设施设计和布局
2.2.1设施用房布局
在CNAO,将安装一个基于串列加速器的紧凑型中子源,这是TAE生命科学公司Alphabeam系统的一部分。该系统设计安装在医院环境中,在CNAO中,将配置在一个双室BNCT套房中,以满足各种临床、研究和容纳能力需求:第一个照射室将预留给患者治疗,第二个照射室将用于研究活动。
BNCT设施设计平衡了Alphabeam系统要求与“建筑扩建”类型项目的固有空间限制和后勤挑战。下文将介绍有关设施主要特征的一些细节,该设施位于新建筑物内,该建筑物将与现有建筑物相邻并与之集成。新建筑设计成了地下两层、地上两层和一个屋顶层,屋顶将容纳技术设备。
BNCT区域的后勤符合辐射防护要求:这意味着加速器和治疗室所在的房间也被放置在建筑物的最极端区域,CNAO工作人员、患者、技术人员和货物的通道和内部路径之间有明确的分隔。下文将对BNCT设施进行详细描述,图片代表了总体布局中最重要的区域和部分。
2.2.2地下楼层
BNCT设施将位于新建筑的地下一层(楼面标高-4.10 m),与用于强子治疗的现有空间保持功能上的连续性。为CNAO新配置了Alphabeam射束线,将每个治疗室放置在高能射束线的两侧,以适应扩展的空间限制。
质子加速器(串联)将沿两层垂直延伸:为此,已设计并将建造第二个地下室层,其平面延伸比其他层小,因为它将仅容纳加速器(图IV-3中的IAT48)和一些辅助技术室(IAT49,装配和储存,如图IV-3所示)。
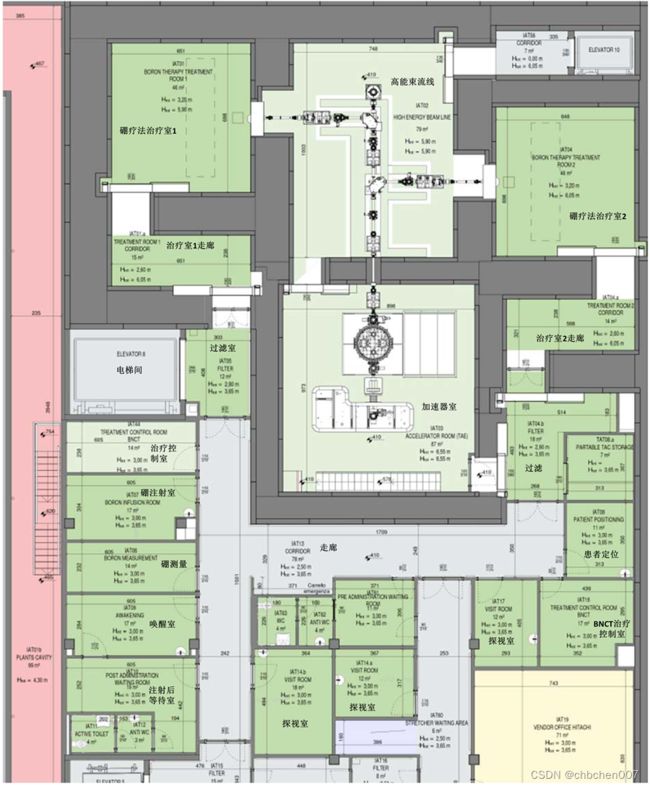
在地下一层可预见的BNCT系统的关键元素包括患者治疗室(图IV-4中的IAT01和IAT04)、加速器束流线(图IV-4中的IAT02)和一些辅助空间。特别是,患者治疗室的设计考虑了各种标准,以支持BNCT临床流程和未来的潜在扩展,包括可能的治疗前患者CT成像、表面引导成像和医疗组件,如麻醉设备。治疗室的尺寸也进行了优化,以考虑屏蔽要求,主要基于患者定位和天花板安装机器人床的中子活化要求。
图IV-3 B02层布局
图IV-4 地下一层B01,含临床和技术室详图
底楼
承载BNCT区域的新建筑的底层将与现有建筑分开。在这一层,将设置服务控制室和BNCT保留的技术室。
一楼
在第一层(+4.10米),新建筑可分为两部分:最南端的一部分将容纳高科技设备操作的技术区,另一部分将容纳新的研究实验室(所谓的研究区)。两部分将由一个露台隔开,露台被布置成一个大的空中花园。
高科技大楼将使用电梯8(图IV-5左下角)从内部配电走廊进入,外部从上述屋顶花园进入。靶贮存室(图IV-5中的PAT07)将在此层上建造:其容量的选择应与预期患者容量、最小靶寿命和放射性成分半衰期一致。从电梯10(图IV-5右上角)可进入该房间。
图IV-5 一楼专用于BNCT的部分(PAT07、PAT06、PAT04a)
屋顶
工厂设备将安置在高科技大楼(L02层)的屋顶上。将在那里修建变压器和热泵专用空间。扩建项目预计将安装一些光伏板:它们将部分安装在屋顶,部分安装在专用金属结构上。可通过电梯8(图IV-5中左下角)和连接新研究实验室屋顶与现有建筑的通风通道进入屋顶。
2.2.3结构和布置要求
Alphabeam系统设施将具有以下主要房间:
- 加速器室(B01层);
- 弱电室(B02层);
- 高能束线(HEBL)室(B01层);
- 服务控制室(L00层);
- 电气柜室(L01层);
- 治疗室1、2(B01层);
- 辅助用房(L00层);
- 技术室(L00层);
- 组件和零件储存室(B02层);
- 靶储藏室(L01层);
- 治疗控制室1、2(B01层)。
离子源、高压(HV)隔离平台、低能束线、串列加速器、支撑平台和一些高能束线组件将位于称为加速器室的建筑物专用部分(图IV-4中的IAT48)。
加速器室内的地板将支撑高压平台,该平台包含统称为低能束线(LEBL)的组件;串列加速器和ELV容器(即连接到串列加速器的电源);以及一些高能束线(HEBL)组件。加速器室中的射束线高度应与HEBL和治疗室中的射束线高度相匹配,规定为1.4米。地板设计用于支撑所有恒载、活载和任何可能的异常情况。加速器室内支撑的主要设备是带有ELV容器的串列加速器,其重量将均匀分布在中心开口支架上。
加速器室内设有楼梯,允许人员从加速器室穿过至ELV室。L01层电气柜室(PAT06)的电缆主要通向加速器室。
HEBL室内高能束线的构件将直接由混凝土楼板支撑,以提高刚度。较重的部件,如屏蔽、射束整形组件(BSA)和治疗室部件,也将由混凝土地板直接支撑,以提高刚度,从而使这些较大的负载不会给敏感的射束线带来偏转或振动。HEBL室内的电缆和管道管理将主要使用沟槽。
永久基准点将与激光跟踪器或类似装置一起使用,以对齐各种部件。这些基准点主要安装在加速器室、HEBL室和治疗室。它们被放置在不同标高和楼层的各种墙上。
为了允许移动和安装Alphabeam系统的最大元件,对货运电梯的尺寸和容积进行了适当的评估和设计;BNCT区域关键点的门道和门开口已得到适当处理。
临床区域和患者路径
设计了BNCT设施布局,以便将患者分别进入BNCT、质子治疗和强子治疗区域的路径分开;CNAO人员的专用路径也已预知。
患者从正门进入中心;他们将在中庭进行同意接收程序,使用楼梯或相应的电梯移动到地下一层(B01),并到达现有的等候室。如果担架上的患者接受硼治疗,他们将使用专用电梯,从建筑物外开始使用预留通道。
治疗后,如有必要,潜在放射性患者将停在唤醒室,或在离开BNCT区域前停在相邻温暖的候诊室;离开该设施时,硼治疗患者将遵循与进入时不同的路径,以避免混合患者流。
由于CNAO也是一个研究中心,其主要目标也是在BNCT中开展研究活动,因此,研究人员可通过专用电梯进入地下一层的实验治疗室,并通过专用路线到达该室。
为了维护的操作和目的,也预见了分开的路线;事实上,技术人员将使用电梯,电梯也可以直接进入大楼外的一楼,也可以用于移动高科技备件,连接不同的楼层,直到屋顶,新设备将设在那里。
2.2.4辐射防护
为了正确解决BNCT设施的辐射安全设计问题,研究了与辐射安全相关的各种问题:瞬发辐射产生、屏蔽效能、空气活化和排气释放的剂量学效应。机器和建筑结构(墙壁、门等)的短期和长期活化问题,考虑到材料处理、人员照射评估和主要退役问题。还考虑了紧急情况的辐射影响。
总的来说,在辐射防护方面面临的主要挑战涉及CNAO厂房不在绿地上的事实:实际上,一个用于强子治疗束的同步加速器已经安装并运行(每周七天),而在BNCT设施准备就绪并投入使用时,一个新的额外质子治疗同步加速器也将运行。
作为辐射安全评估的基础,根据CNAO设施布局(作为研究所用蒙特卡罗模型的基础),对进行BNCT治疗递送的物理进行了研究,并进行了相应的模拟。
首先,已经研究了辐射产生的物理,从中子产生开始:中子是通过用强电流质子束轰击自然锂靶产生的,如前面第IV-2.1.4-IV-2.1.6节所述。TLS的物理学家在MCNP6中开发了高保真、时间相关的辐射输运模型,以了解与这些源项中的每一项相关的潜在辐射危害,这些源项涵盖了从单个治疗间隔到设施寿命结束的时间跨度。同时,CNAO辐射防护部门使用FLUKA 蒙特开罗程序进行模拟:两组结果之间的比较显示了一致性,以支持后勤和物资方面的关键设计选择。
之后,设施房间的屏蔽设计基于完整的BSA系统产生的瞬发辐射:中子、伽马和X射线等。由于选择了相对治疗室的布局,设计中最棘手的问题之一是两个房间之间的相互影响,即一个房间在另一个房间使用时必须是可以进入的,或者当机器打开并且射束停止在射束收集器或诊断检测器上时。
实际上,辐射防护设计是基于对几个瞬发辐射源的影响的评估:
- 当另一个治疗室正在使用时,靶产生的中子或光子以及射束整形组件的后向散射;
- 质子束撞击铜射束收集器、机器部件产生的中子和光子,以及中子束照射材料产生的光子。
此外,由于Alphabeam和设施组件的非期望活化,治疗束中子及其散射出的中子会影响设施设计以及辐射防护规划。由于所涉及的特殊物理现象,选择了仔细的设计和材料的仔细选择,以符合从几个角度产生的需要。
例如,根据模拟结果,治疗室和高科技室的饰面处理将不同于其他区域,以满足辐射防护需求:这些墙壁和地板中使用的混凝土将富含少量硼。这种选择对屏蔽厚度有很大影响,因为第一层中的硼会抑制中子在混凝土上的传输和二次伽马产生,从而降低总的传输剂量率,并降低房间和墙壁中的热中子注量率,同时降低空气活化(主要由于41Ar,通过40Ar的(n,γ) 反应)和壁的活化。
3 监管、研究和临床活动
3.1监管方面
本节不具有法律约束力,但旨在提供适用于意大利情况的BNCT医疗器械设施监管方面的一般概述。适用于医疗器械的标准为MDR 2017/745 EU法规(1)。该法规旨在提高产品质量和安全标准,并采用风险-收益临床方法对设备进行评估。这使得欧盟成为医疗器械领域公共卫生和内部市场顺利运行的保障者。此类医疗器械是否符合MDR(1)要求和任何相关协调标准,将由负责符合性评估程序的公告机构进行认证。
MDR明确侧重于临床调查和评估,即符合性评估中的上市前临床试验,以及CE标志医疗器械的上市后临床随访,其证书取决于预期用途。
医疗器械“制造商”是指“制造或完全翻新器械,或设计、制造或完全翻新器械,并以其名义或商标销售该器械的自然人或法人自然人或法人”(1)。
对于BNCT设备,制造商为TLS,TLS将发布并更新技术文件。根据MDR(1),由于TLS是一家美国实体,因此必须在欧盟成员国确定授权代表,以履行所有制造商职责。技术文件将使装置符合本法规的要求。
(1) https://eur-lex.europa.eu/legal-content/EN/TXT/HTML/?uri=CELEX:32017R0745&from=IT
符合本法规中规定的一般安全和性能要求的证据必须基于临床数据。遵守统一标准是指制造商证明符合一般安全和性能要求以及其他法律要求(例如,EN 60601-1医疗电气设备、EN 60601-1-2电磁兼容性EMC、EN 62304医疗设备软件-软件生命周期过程、IEC辐射防护、EN 10993-1生物相容性等)。这包括机械和/或电气测试、可靠性测试、软件验证和确认、性能测试、生物相容性和生物安全性评估(如适用)。
制造商必须通过临床前试验证明符合IEC标准。制造商必须联系经认证的实验室(例如,意大利IMQ实验室(2)),以执行电气安全、电磁兼容性等测试。临床评估必须基于CNAO基金会负责开展的临床调查的数据。
(2) https://www.imq.it/en
授权流程的另一个重要步骤是批准药物:
- 非商业药物,人类首次。在这种情况下,药物不能给人施用,因此根据第536/2014号法规,需要按照几个不同的步骤进行药物试验。实验过程如下:实验室试验、动物试验,最后还有人体试验;
- 商业药品。在这种情况下,药物可以给人施用,因为它已经获得授权。
在第一阶段,似乎授权机构考虑在特定病理的联合授权下使用药物和医疗器械。最终,授权的延伸可能是一个讨论的问题,为应用于同一医疗设备的新药和新病理开辟了独立的途径。
卫生部评估不带CE标志的医疗器械的临床试验(欧盟MDR 2017/745法规第62条)。在开始临床研究之前,必须向卫生部提交一份申请,并附上法规(附件XV,MDR第二章)要求的所有文件,以证明符合性(根据MDR第70条)。
临床试验可在卫生部检查申请的准确性后开始。然后,卫生部将继续开展科学评估活动,以便根据MDR第76条采取可能的纠正措施。通常,临床研究申请由发起人提交(本例中为CNAO基金会)。只有在获得国家认可的伦理委员会(Comitato Etico Pavia of reference for CNAO)的肯定意见下,才能对申请进行验证。一旦在临床研究结束时收集到临床结果,制造商将能够完成技术档案并要求CE标记。
将硼化合物的授权及其在BNCT设备中的使用与医疗设备本身的授权程序相匹配将是制造商、临床试验发起人和监管机构之间密切合作的结果。
3.2计算剂量测定和治疗计划
中子俘获疗法(NCT)的治疗计划与光子或带电粒子的常规计划有不同的方法。实际上,由于中子与物质相互作用的复杂性,它完全依赖蒙特卡罗(MC)模拟进行剂量计算。
本课题包括许多计算方面,主要涉及中子束孔径附近的中子束模拟。在NCT感兴趣的粒子能量范围内,有许多MC输运工具包具有足够精确的物理模型。尽管如此,定义一个在空间和能量上都可以验证的粒子源并不是一件小事。这是由于NCT照射的粒子混合场特性所致。准确描述初始辐射源是准确评估治疗效果的关键。
将研究为NCT治疗计划定义中子束源的方法,以产生相空间“表面源”文件,该文件定义中子束孔径处/附近辐射源的特性,以避免重复计算中子沿束线输运的高昂计算成本,以供将来研究。相空间文件将记录模拟粒子的位置、方向、能量、粒子类型、统计权重和历史数量,这些数据源于中子束线的详细模拟。
对于研究和相互比较活动,洛斯阿拉莫斯国家实验室[IV-12]开发的辐射输运程序MCNP计划广泛用作剂量计算引擎,因为该程序经过良好验证,相对容易使用,并在源定义和稳健的方差减少技术方面提供灵活性。其他辐射输运程序(例如PHITS[IV-13]、Geant4[IV-14]或FLUKA[IV-15])之间的相互比较也可预见,可能首先在体模几何体中定义独特的物理设置,然后定义类似患者的解剖结构。Geant4 DNA包[IV-16]的辅助支持也将被考虑用于研究在细胞和亚细胞尺度上诱导的生物损伤,目的是开发预测性放射生物学模型。Alphabeam商业治疗计划系统(TPS)中使用的蒙特卡罗程序目前正在评估中。
开发该模拟框架的目的还在于定义一个方案,通过该方案可以通过实验测量来验证计算结果。这可以通过比较两个不同体模的计算和测量来实现,例如,大型矩形或圆柱形水体模和较小的拟人体模,为源模型和TPS提供测试基准。矩形水体模允许剂量计自由定位,并且经常配备电动驱动器,用于探测器的远程定位,以允许在多个位置进行测量。这种能力对于沿多个轴进行测量尤其有利。拟人模型提供了更现实和临床相关的条件,以确定准确性和刻度TPS。
最后,可以开发辅助工具来加速NCT治疗计划的监测单元检查,处理与体模内剂量测量的比较。例如,如JAEA[IV-17]所示,一个简单的水体模可用于进行广泛的测量,以确认治疗计划;例如,在沿着射束的中心轴的中子通量和剂量分量的体模测量中,输出测量作为深度的函数的射束分布以及射束口和体模的尺寸对剂量分量的影响。
3.3实验和环境剂量测定
BNCT辐射场是复杂的,因为它由不同的成分组成,即热中子和超热中子、快中子(尽管应该尽量减少这种成分,但中子能谱中通常存在尾部)、来自中子吸收和非弹性反应的瞬发伽马射线(也来自Li靶),以及来自BSA结构材料活化的伽马射线。
撞击靶的质子束电流和中子辐射场都将被独立实时监测。
辐照场的表征将使用中子活化技术(裸露和镉覆盖的In和Au箔)和用于伽马射线组分的填充有CO2的石墨电离室进行。快中子组分将通过过热乳剂中子谱仪[IV-18]、ACSPECT硅望远镜[IV-19]、DIAMON谱仪[IV-20]和NCT-WES谱仪[IV-21]进行表征。
体模内剂量学将主要使用热释光探测器(TLD)[IV-22]和凝胶剂量计[IV-23]进行。
复合辐射场也将通过微剂量学技术进行表征。微剂量学测量单个事件赋予微观体积的能量的随机分布。通过测量靶材料中有无10B原子的分布,可以表征混合BNCT辐射场,并确定光子和中子相互作用对总吸收剂量的贡献分数。有硼和无硼的两两测量允许量化由于硼中子俘获反应而产生的额外剂量分数。因此,可以估计BNCT辐射场的相对生物有效性(RBE)[IV-24-IV-33]。可使用先进的组织等效比例计数器,在标准1µm位点尺寸处,或在小于等于约30 nm的较小直径处执行微剂量学表征[IV-34]。在纳米范围内的位点尺寸的测量是令人感兴趣的,因为已经证明,对于降低靶直径,特定辐射质量的剂量平均线性能量值与参考辐射场的剂量平均线性能量值之间的比率,yD/yD-ref变得更接近相应的RBE[IV-35-IV-36]。
BNCT的辐射环境监测主要基于治疗室、HEBL和加速器室内外光子和中子成分的测量。房间内涉及的辐射场尤其难以测量,因为它们都是混合的(光子和中子),而且非常强(与设计标准监测器的通常场相比)。中子组分在超热范围内达到峰值,而典型的中子仪器通常没有对此进行优化。在屏蔽外,辐射场完全由光子主导,其中一个重要的高能成分来自核俘获反应。必须选择或设计辐射监测系统,以便能够测量非常强的中子场,具有良好的中子/光子分辨能力和适当的能谱响应。
3.4硼测量和临床剂量测定
由于其独特的细胞水平选择性,BNCT关键依赖于多个分隔间(肿瘤组织、血液和其他健康组织)中10B浓度的估计。理想的10B定量方法既能在宏观水平上进行测量,又能对微观分布(细胞和亚细胞水平)敏感;此外,它将是非侵入性的,并且能够在体内和实时产生结果[IV-37-IV-38]。目前,我们缺乏一种符合所有上述要求的单一技术。
由于临床BNCT的长期经验,科学界可以依靠能够在不同类型的样本和情况下测量10B ppm的良好基准技术[IV-39]。目前,在BNCT治疗过程中,使用原子光谱法测量患者体内的10B浓度,从以下各项中进行选择:
- 电感耦合等离子体原子发射光谱法(ICP-AES)或电感耦合等离子体光学发射光谱法(ICP-OES);
- 电感耦合等离子体质谱(ICP-MS)。
前者是迄今为止最容易获得的,因此目前是BNCT的首选[IV-5,IV-40‒IV-43]。
原子光谱法给出宏观样品中的平均10B量(体积的数量级为几毫升或更少),通常可以根据细胞亚群假设为混合样品。ICP-AES/ICP-OES通常在中子照射之前、期间和之后采集的患者血液样本上进行。由于反应迅速,10B浓度用于监测和校正开处方给每位患者的束流时间,以便更好地符合TPS引擎估计的给肿瘤递送的剂量。这些评估还关键依赖于含硼药物的药代动力学模型以及血液中10B浓度与肿瘤和健康组织之间的固定比率。
所述发射光谱法的一个非常接近的替代方案是瞬发伽马中子活化分析,也称为瞬发伽马射线能谱法或瞬发伽马射线分析,基于对478 keV伽马射线的检测,该伽马射线由94%的10B中子俘获反应后处于初始激发状态的7Li反冲核发射[IV-44‒IV-45]。与ICP-AES/OES的主要区别在于,与治疗中子束并行,需要一个具有非常低背景的专用热中子束,以降低灵敏度,从而尽可能限制测量时间。
中子照射期间通过谱仪技术获得的10B浓度知识通常与通过PET和硼化药物的18F氟化类似物(通常为BPA)对每位患者的硼化药物摄取进行的先验研究相结合[IV-41,IV-46]。PET成像目前已在BNCT临床方案中实施,以评估患者的合格性。通常在实际中子照射前几小时甚至几天进行,并提供有关硼化药物药代动力学的重要信息,特别是用于量化肿瘤与正常组织以及肿瘤与血液的10B浓度比率,该比率将与ICP-AES(OES)测量相结合,以调整治疗。
为了监测硼载体在体内的生物分布,提出了基于磁共振成像(MRI)和波谱(MRS)的方案,目的是利用MR技术的非电离性质来改进BNCT治疗。以检测19F标记BPA为重点的体内临床前研究表明:1H-MRI 19F-MRI可以提供19F-FBPA分布图[IV-47];通过研究19F-MRI与血19F-MRS的相关性,确定最佳照射时间[IV-46];左旋多巴预载入可提高BNCT疗效[IV-48]。这种方法需要非传统MR扫描仪硬件的可用性。为了开发临床上广泛使用的MR采集设备,提出了一种基于MRS检测BPA芳香质子信号的BPA定量技术。在体模研究[IV-49]中证明了其可行性,而在人体上的实施需要重复[IV-50]。
在临床前水平,为了支持硼化药物开发以及体外和体内研究,有大量专用技术能够将我们对10B浓度和微观空间分布的了解推向单细胞摄取。仅举几个例子:中子放射自显影、带电粒子能谱、二次离子质谱、电子能量损失光谱等。通常,这些技术非常耗时,离线工作,最终可能需要高度复杂和昂贵的仪器,因此,很难将这些方法作为量化患者治疗期间10B的一线方法。
在临床剂量学方面,必须强调10B浓度明显控制治疗剂量分布(即硼剂量成分),但不单独起作用。硼剂量来源于某一点的10B浓度与同一位置的中子通量,特别是热份额的卷积。目前,中子通量信息主要由活化方法确定,通过与TPS计算进行比较,在患者照射期间或照射后立即进行验证[IV-51]。其他剂量成分可采用专用方法,例如:伽马剂量和中子束分量通常通过双电离室技术来估计;通过结合活化测量和TPS计算估算的氮剂量分量。必须强调的是,所有这些技术都直接应用于人体模型,而对于患者,它们会受到大量间接和离线估计的影响。
缓解所述技术的许多限制的策略是开发和实施单光子检测实时BNCT剂量监测(PG-SPECT)[IV-52]。如前所述,478 keV伽马射线可用于监测组织中10B引起的治疗剂量,而1H上的辐射中子俘获反应产生的2.2 MeV伽马射线被广泛接受为绘制照射区域中子通量的信号。在这种情况下,优化和专用的单光子检测系统,如改进的SPECT断层摄影术[IV-53]或专用的康普顿相机[IV-54],将在照射期间围绕患者,以产生10B剂量和热中子通量的实时2D和3D图。尽管这样的系统已经提出了好几年,但许多科学团队仍在开发中,BNCT临床设施中仍缺少实际实施。
总之,为了在CNAO实际实施BNCT,我们建议采取以下三种策略:
- BNCT治疗前的18F-FBPA PET与患者血液样本的ICP-AES测量相结合,以了解肿瘤和组织中的10B浓度,以监测和优化递送剂量;
- 进一步研究MRI和MRS技术用于监测硼酸盐化合物体内生物分布的可能性;
- 投资开发基于PG-SPECT的剂量监测系统原型,用于478 keV和2.2 MeV的单光子检测,以在体内和实时量化和成像BNCT治疗剂量以及热中子通量。
3.5放射生物学
预计在CNAO BNCT设施进行的放射生物学研究将侧重于射束/仪器调试,以评估系统的安全性和特性,或侧重于临床前研究,旨在通过BNCT知识,特别是AB-BNCT放射生物学知识,提高治疗效果。事实上,除了需要加深关于BNCT对肿瘤/正常细胞/组织的影响的认识外,AB-BNCT相对较短的历史清楚地反映了缺乏放射生物学研究,这些研究对于强调基于反应堆和基于加速器的BNCT效应之间的潜在差异和相似性以及开发它们以获得更好的治疗至关重要。例如,迄今为止在体外进行的少数基础研究报告了超热中子束的RBE值,其范围为2.2‒2.6(Be靶[IV-55])和1.7‒1.9(Li靶[IV-56])。因此,如果细胞和分子反应的进一步差异将被揭示出来,也就不足为奇了。在比较不同类型设施的背景下,帕维亚团队能够方便地利用反应堆(LENA)和加速器(CNAO)产生的射束进行实验的可能性将是独一无二的。
所有这些实验的设计都将考虑到再现射束质量保证标准实验条件的需要,以及未来将在中心进行的临床试验。CNAO在临床试验前设计射束调试的临床前实验研究方法将首先通过放射生物学标准试验评估正常细胞/组织和动物模型中CNAO治疗的安全性,以便能够将结果与其他BNCT设施收集的结果进行比较。
因此,将在不同的实验条件下评估细胞毒性、克隆形成性和细胞活力,例如,仅使用硼载体、使用带有/不带有硼载体的中子、使用多种浓度的硼载体、使用CHO和V79仓鼠细胞(作为质量保证参考)和人正常细胞系(例如,成纤维细胞和内皮细胞)。同时,相同实验条件下的遗传毒性将通过γ-H2AX染色和微核形成和/或SCE(姐妹染色单体交换)。关于体内试验,将通过它们来评估全身照射或局部照射(不含或不含硼化合物)后,在不同射束深度下的射野内外局部和全身毒性。特别是,将报告肠隐窝再生、皮肤损伤、粘膜损伤和血液毒性,并将其与伽马或X射线照射的结果进行比较,以计算RBE/CBE值。在这方面,将考虑到作为BNCT特征的混合辐射场,其中高LET粒子和低LET粒子共存,使得RBE的评估并非微不足道。尽管传统方法基于固定的RBE和CBE值,但也将探索其他可能性,例如“光子等效应剂量法”[IV-57]和/或“修正的随机微剂量学动力学”模型[IV-58]。
将要考虑的一个重要问题是人和小鼠之间的身体大小和身体厚度的差异:第一个问题将通过使用专用的丙烯酸支架来克服,该支架将允许以覆盖整个辐射场的方式定位动物。第二个问题将通过利用Masutani设计和描述的“小鼠三层模型”来规避[IV-59]。将设立观察期,以调查短期和长期影响。
由于提供了位于LENA中子反应堆和CNAO中心附近的帕维亚大学动物设施,将小型啮齿动物用作活体动物模型成为可能。除了传统的动物饲养和护理设施外,该设施还可提供BNCT治疗的啮齿动物的饲养设施,这要归功于放射生物学实验室的可用性。中心只接受帕维亚大学动物福利机构批准并经卫生部授权的实验方案中的动物。
临床前实验研究的第二步是研究治疗的疗效。因此,将根据计划的临床试验,在有或无硼载体的情况下,通过克隆形成细胞存活试验来测定癌细胞的杀伤作用。同时,将通过肿瘤生长延迟试验在具有靶癌类型的小鼠异种移植模型中评估对肿瘤生长的影响。
3.6临床试验程序
在高科技时代,肿瘤治疗的目标是提高治疗比、局部肿瘤控制率和患者生存率,同时降低治疗相关的毒副作用。
硼中子俘获疗法可能在这种情况下发挥主要作用,通过利用超热中子束照射结合正常组织与癌细胞之间的药物递送和不同摄取的能力,以获得危及器官与肿瘤之间的大剂量梯度[IV-60]。它可以选择性地杀死癌细胞,并且可以代表一种有希望的治疗方法,以克服特定治疗的风险和益处之间的永恒困境[IV-61]。由于其高度集中的辐射,BNCT可以在许多情况下利用,特别是在肿瘤体积接近关键结构或复发性疾病的情况下,独立于其可切除性和以往的照射。
根据最近的文献,BNCT在恶性胶质瘤、多形性胶质母细胞瘤和复发性高级别脑膜瘤中显示出良好的结果[IV-62]。这些试验中的大多数是基于反应堆的超热中子束,尽管现在特别是在日本,BNCT的活动正在转移到医院设置的加速器上[IV-60]。由于意大利的单加速器BNCT设施的性质,CNAO将设计非随机、非比较、前瞻性、开放标签、I/II期研究,以确定BNCT治疗常规放疗后不能手术和/或复发的间变性星形细胞瘤或胶质母细胞瘤的安全性和活性。在这种情况下,此类临床试验旨在将BNCT确立为主要程序和挽救程序的常规临床治疗。
根据日本的经验,BNCT在复发性头颈癌的治疗中发挥了作用,特别是在不适合碳离子再照射的情况下[IV-61,IV-63-IV-64]。在CNAO,由于在治疗复发性肿瘤方面有几十年的经验,我们的目标是进行临床试验,以测试BNCT的治疗比与传统患者选择标准相比的安全性和有效性[IV-65]。
我们将通过剂量/体积递增研究,探讨BNCT在选定的寡转移性癌中的安全性和有效性[IV-62]。另一个感兴趣的话题是研究免疫治疗和BNCT的结合[IV-66]。根据相关国家监管机构的要求,所有试验必须采用10B-BSH(硼卡钠)或10B-BPA((2S)-2-氨基-3-(4(10B)二羟基(10B)苯基)丙酸)或最终更具选择性的含硼化合物进行设计。
在CNAO,具有放射肿瘤学I/II期临床试验经验的临床医生将与行业和监管机构密切合作,使用新型药物进行试验。在包括放射肿瘤学家、医学肿瘤学家、放射学家、核医学医师、病理学家、外科医生、护士、生物学家和医学物理学家在内的多专业人员之间进行多学科协作,对于设计和进行临床试验至关重要。将鼓励与其他BNCT设施进行国际合作,特别是考虑到具有相同方案和处方剂量的多中心研究。
4 新型硼酸盐化合物的开发
BNCT递送载体最重要的要求是:
- 固有毒性低;
- 肿瘤高摄取,通常为20-50 μg 10B,理想摄取量为30 μg 10B;
- 正常组织中的低摄取:理想情况下,肿瘤与正常组织和肿瘤与血液的硼浓度比超过3:1;
- 相对快速地从正常组织和血液中清除,并在肿瘤中持续数小时以允许中子照射。
除了这些特性之外,还希望添加治疗递送剂,即配备有能够在原位或在非常短的时间内(即在清除时间内)执行10B剂量测定的特定表达的那些制剂。
随着科学知识的增长,随着分子生物学、核医学和有机化学的进步,寻找理想载体的金发姑娘区是一个动态的过程。历史上,已经确定了三代不同的BNCT递送剂;第一代硼化合物是在20世纪50年代早期开发的。合成了硼酸、硼砂和五硼酸盐等化合物,但观察到它们在肿瘤中的浓度与在大脑中的浓度相比非常低,而且它们的积累是短暂的。十年后,第二代硼化合物出现。20世纪60年代出现了两种高效、突出的硼化合物,即BPA和BSH。与相关分子相比,它们在动物肿瘤中的毒性更小,持续时间更长。此外,肿瘤/脑以及肿瘤/血液中的硼浓度比为4:1。因此,其在体内外的令人满意的结果允许临床使用的授权。目前,10B-BPA已成为BNCT临床及临床前应用最广泛的硼递送载体。最近,根据GMP协议合成了10B-BPA,并在日本批准了以Borofalan(以前称为SPM 011)命名的BPA用于临床。
脂质体化学、纳米医学、核酸化学的出现以及单克隆抗体的发展,使得第三代硼化合物得以开发。因此,开发高效、高选择性的硼递送载体是一个迫切需要。二元放射治疗模式的成功取决于癌细胞选择性摄取治疗剂量的含硼剂。因此,最具挑战性的任务之一是合成和开发用于临床的智能硼运载剂。具有高水解稳定性的硼团簇是BNCT的新兴工具;然而,它们的毒性和缺乏肿瘤选择性限制了它们在BNCT中的直接益处。肿瘤靶向制剂,如多胺、非天然氨基酸、肽、蛋白质、核苷、糖、卟啉、抗体、脂质体和纳米粒正与BPA或BSH分子结合以开发更好的递送系统。硼化合物也被包裹在脂质体的水核中。由特定脂质成分制成的脂质体保持穿过肿瘤膜并驻留在细胞内的能力。
BNCT现在正处于十字路口:我们将何去何从?这个问题的合理答案是开发第四代硼载体,但即使这样也不够。为了使BNCT在临床上可用,有必要按照GMP标准生产10B-BPA,同时也为了重新调整欧盟战略。第四代硼递送载体可以是10B修饰的亲瘤分子。
对第四代硼递送剂的总结可以追溯到新的合成策略:
- 肽和蛋白质中半胱氨酸(Cys)残基的新型合成生物偶联已成为化学中的一种强大工具。Cys硼化反应可以在室温下进行,并耐受复杂多肽中存在的各种官能团;
- 原则上可以使用一种简单的合成方法来合成各种新的硼化保护的色氨酸,使用4-和5-硼化吲哚的区域和化学选择性(-C-H激活或亲电取代)。含硼杂环在从药物发现到材料科学的各种应用中都很重要。BN/CC同位性可以极大地扩展这种可能性。特别地,将BN/CC同位性应用于芳烃中提供了广阔的可用化学空间;
- 点击化学几乎在现代化学的所有领域都有应用,并对放射性药物的合成和发展产生了重大影响;
- 针对表征肿瘤组织的毛细管之间相对较大间隙的新型药物递送系统也在积极开发中。
新硼酸盐化合物的制备将是CNAO网络内的跨学科合作问题,TLS将发挥关键作用,TLS拥有一个开发下一代BNCT药物的大型活跃团队。
5 结论
在CNAO基金会的章程中,研究是一个基本支柱,创建BNCT临床中心的决定完全符合这一目标。新设施的建设目前正在进行中,预计将于2024年投入使用。
基于加速器的BNCT系统将由TLS在CNAO和TLS于2020年签署的协议框架内提供。该协议的目的是安装、运行和CE认证TLS技术,并启动临床试验阶段,以入组符合BNCT应用条件的患者。
CNAO、帕维亚大学(University of Pavia)、INFN和米兰理工学院(Polytechnic of Milan)之间建立了合作关系,以追求用这种创新模式治疗患者的目标。国际团体可以通过这种合作来整合经验和多学科能力,以实现这一目标。
已确定了七个领域,如本文所述,其工作关注点是:监管方面、放射生物学、计算剂量测定和治疗计划、实验和环境剂量测定、硼测量和临床剂量测定、BNCT的临床试验程序、新含硼化合物的开发。
参考文献
[IV-1] BARTH, R.F., et al., Current status of boron neutron capture therapy of high grade gliomas and recurrent head and neck cancer, Radiat. Oncol. 7 146 (2012) 1-21.
[IV-2] KOIVUNORO, H., et al., Boron neutron capture therapy for locally recurrent head and neck squamous cell carcinoma: An analysis of dose response and survival, Radiother. Oncol. 137 (2019) 153-158.
[IV-3] MIYATAKE, S.I., et al., Boron neutron capture therapy for malignant brain tumours, Neurol. Med. Chir. 56 7 (2016) 361-371.
[IV-4] AIHARA, T., et al., BNCT for advanced or recurrent head and neck cancer, Appl. Radiat. Isot. 88 (2014) 12-15.
[IV-5] WANG, L.W., et al., Clinical trials for treating recurrent head and neck cancer with boron neutron capture therapy using the Tsing-Hua Open Pool Reactor, Cancer Commun. (2018) 37-38.
[IV-6] ZONTA, A., et al., Clinical lessons from the first applications of BNCT unresectable liver metastases, J. Phys. Conf. Ser. 41 (2006) 484-495. on
[IV-7] ZONTA, A., et al., Extra corporeal liver BNCT for the treatment of diffuse metastases: what was learned and what is still to be learned, Appl. Radiat. Isot. 67 (2009) 67-70.
[IV-8] SUZUKI, M., Boron neutron capture therapy (BNCT): a unique role in radiotherapy with a view to entering the accelerator-based BNCT era, Int. J. Clin. Oncol. 25 (2020) 43-50.
[IV-9] BAYNOV, B., et al., Accelerator based neutron source for the neutron-capture and fast neutron therapy at hospital, Nucl. Instrum. Methods Ser. A 413 (1998) 397- 426.
[IV-10] LEE, C., ZHOU, X-L., Thick target neutron yields for the 7Li(p,n)7Be reaction near threshold, Nucl. Instrum. Methods Ser. B 152 (1999) 1-11.
[IV-11] INTERNATIONAL ATOMIC ENERGY AGENCY, Current Status of Neutron Capture Therapy, TECDOC 1223, IAEA, Vienna (2001).
[IV-12] WERNER, C.J., et al., “MCNP6.2 Release Notes”, Los Alamos National Laboratory, report LA-UR-18-20808 (2018).
[IV-13] SATO, T., et al., Features of Particle and Heavy Ion Transport Code System PHITS, Version 3.02, J. Nucl. Sci. Technol. 55 (2018) 684-690.
[IV-14] AGOSTINELLI, S., et al., GEANT4—a simulation toolkit, Nucl. Instrum. Methods Ser. A 506 3 (2003) 250-303.
[IV-15] FERRARI, A., RANFT, J., SALA, P.R., FASSÒ, A., FLUKA: A multi-particle transport code (Program version 2005) (No. CERN-2005-10). CERN (2015).
[IV-16] INCERTI, S., et al., The GEANT4-DNA project. Int. J. Model. Simul. Sci. Comput. 1 02 (2010) 157-178.
[IV-17] JAPAN ATOMIC ENERGY AGENCY, https://www.jaea.go.jp/english/.
[IV-18] D’ERRICO, F., Radiation dosimetry and spectrometry with superheated emulsions, Nucl. Instrum. Methods Ser. B 184 (2001) 229-254.
[IV-19] AGOSTEO, S., FAZZI, A., INTROINI, M.V., LORENZOLI, M., POLA, A., A telescope detection system for direct and high resolution spectrometry of intense neutron fields, Radiat. Meas. 85 (2016) 1-17.
[IV-20] POLA, A., RASTELLI, D., TRECCANI, M., PASQUATO, S., BORTOT, D., DIAMON: a portable, real-time and direction-aware neutron spectrometer for field characterization and dosimetry, Nucl. Instrum. Methods Ser. A 969 (2020) 164078.
[IV-21] BEDOGNI, R., et al., NCT-WES: A new single moderator directional neutron spectrometer for neutron capture therapy. Experimental validation, EPL 134 (2021) 42001.
[IV-22] GAMBARINI, G., et al., Determination of gamma dose and thermal neutron fluence in BNCT beams from the TLD-700 glow curve shape, Radiat. Meas. 45 (2010) 640-642.
[IV-23] GAMBARINI, G., et al., Fricke gel dosimetry in epithermal or thermal neutron beams of a research reactor, Radiat. Phys. Chem. 116 (2015) 21-27.
[IV-24] ZAMENHOF, R.G., Microdosimetry for boron neutron capture therapy: A review, J. Neuro-Oncol. 33 (1997) 81.
[IV-25] WUU, C.S., et al., Microdosimetry for boron neutron capture therapy, Radiat. Res. 130 (1992) 355.
[IV-26] KOTA, C., et al., The use of low pressure tissue equivalent proportional counters for the dosimetry of neutron beams used in BNCT and BNCEFNT, Med. Phys. 27 (2000) 535.
[IV-27] BURMEISTER, J., et al., Microdosimetric intercomparison of BNCT beams at BNL and MIT, Med. Phys. 30 (2003) 2131.
[IV-28] HSU, F.Y., et al., Microdosimetry study of THOR BNCT beam using tissue equivalent proportional counter, Appl. Radiat. Isot. 67 (2009) S175.
[IV-29] MORO, D., et al., BNCT dosimetry performed with a mini twin tissue-equivalent proportional counter (TEPC), Appl. Radiat. Isot. 67 (2009) S171.
[IV-30] COLAUTTI, P., et al., Microdosimetric measurements in the thermal neutron irradiation facility of LENA reactor, Appl. Radiat. Isot. 88 (2014) 147.
[IV-31] SATO, T., et al., Microdosimetric modeling of biological effectiveness for boron neutron capture therapy considering intra- and intercellular heterogeneity in 10B-distribution, Sci. Rep. 8 (2018) 988.
[IV-32] HU, N., et al., Evaluation of PHITS for microdosimetry in BNCT to support radiobiological research, Appl. Radiat. Isot. 161 (2020) 109148.
[IV-33] SELVA, A., et al., Microdosimetry of an accelerator based thermal neutron field for boron neutron capture therapy, Appl. Radiat. Isot. 182 (2022) 110144.
[IV-34] BORTOT, D., et al., A novel TEPC for microdosimetry at nanometric level: response against different neutron fields, Radiat. Prot. Dosim. 180 1-4 (2018) 172- 176.
[IV-35] LINDBORG, L., GRINDBORG, J.E., Nanodosimetric results and radiotherapy beams: a clinical application?, Radiat. Prot. Dosim. 70 1-4 (1997) 541-546.
[IV-36] MAZZUCCONI, D., et al., Nano-microdosimetric investigation at the therapeutic proton irradiation line of CATANA, Radiat. Meas. 123 (2019) 26-33.
[IV-37] WITTING, A., et al., Boron analysis and boron imaging in biological materials for BNCT, Crit. Rev. Oncol. Hematol. 68 (2008) 66-90.
[IV-38] PROBST, T.U., Methods for boron analysis in boron neutron capture therapy (BNCT). A review, Fresenius’, J. Anal. Chem. 364 (1999) 391-403.
[IV-39] WITTIG, A., MOSS, R., NAKAGAWA, Y., (Eds), Neutron Capture Therapy - Principles and Applications, Springer (2012).
[IV-40] SHIBATA, Y., et al., Prediction of boron concentration in blood form patients on boron neutron capture therapy, Anticancer Res. 23 (2003) 0250-7005.
[IV-41] SAVOLAINEN, S., et al., Boron neutron capture therapy (BNCT) in Finland: technological and physical prospects after 20 years of experience, Phys. Med. 29 3 (2013) 233-248.
[IV-42] BUSSE, P.M., et al., “The Harvard-MIT BNCT program”, Frontiers in Neutron Capture Therapy, Springer (2001) 37-60.
[IV-43] GONZÁLEZ, S.J., et al., First BNCT treatment of a skin melanoma in Argentina: dosimetric analysis and clinical outcomes, Appl. Radiat. Isot. 61 5 (2004) 1101- 1105.
[IV-44] MATSUMOTO, T., et al., Phantom experiment and calculation for in vivo 10boron analysis by prompt gamma ray spectroscopy, Phys. Med. Biol. 36 3 (1991) 329- 338.
[IV-45] RAAIJMAKERS, C.P.J., et al., Boron neutron capture therapy using prompt gamma-ray analysis, Acta Oncol. 34 (1995) 517-523.
[IV-46] ISHIWATA, K., 4-Borono-2-18F-fluoro-L-phenylalanine PET for boron neutron capture therapy-oriented diagnosis: Overview of a quarter century of research, Ann. Nucl. Med. 33 (2019) 223-236.
[IV-47] PORCARI, P., et al., In vivo 19F MRI and 19F MRS of 19F-labelled boronophenylalanine-fructose complex on a C6 rat glioma model to optimize boron neutron capture therapy (BNCT), Phys. Med. Biol. 53 (2008) 6979-6989.
[IV-48] CAPUANI, S., et al., L-DOPA Preloading increases the uptake of borophenylalanine in C6 glioma rat model: A new strategy to improve BNCT efficacy, Int. J. Radiat. Oncol. Biol. Phys. 72 (2008) 562-567.
[IV-49] TIMONEN, M., et al., Acquisition-weighted MRSI for detection and quantification of BNCT 10B-carrier L-p-boronophenylalanine-fructose complex, a phantom study, J. Radiat. Res. 50 (2009) 435-440.
[IV-50] TIMONEN, M., et al., 1H MRS studies in the Finnish boron neutron capture therapy project: Detection of 10B-carrier, L-p-boronophenylalanine-fructose, Eur. J. Radiol. 56 (2005) 154-159.
[IV-51] JÄRVINEN, H., VOORBRAAK, W. (Eds), Recommendations for the Dosimetry of Boron Neutron Capture Therapy, NRG Report 21425/03.55339/C, Petten, The Netherlands (2003).
[IV-52] KOBAYASHI, T., et al., A noninvasive dose estimation system for clinical BNCT based on PG-SPECT - Conceptual study and fundamental experiments using HPGe and CdTe semiconductor detectors, Med. Phys. 27 9 (2000) 2124-2132.
[IV-53] MINSKY, D., et al., First tomographic image of neutron capture rate in a BNCT facility, Appl. Radiat. Isot. 69 (2011) 1858-1861.
[IV-54] LEE, T., et al., Monitoring the distribution of prompt gamma rays in boron neutron capture therapy using a multiple-scattering Compton camera: a Monte Carlo simulation study, Nucl. Instrum. Methods Ser. A 798 (2015) 135-139.
[IV-55] ONO, K., Prospects for the new era of boron neutron capture therapy and subjects for the future, Ther. Radiol. Oncol. 2 (2018) 40-46.
[IV-56] IMAMICHI, S.Y., “Evaluation of the BNCT System in National Cancer Center Hospital Using Cells and Mice”, 16th International Congress of Radiation Research, 25-29 August 2019, Manchester, UK (2019).
[IV-57] GONZÁLEZ, S., SANTA CRUZ, G., The photon-isoeffective dose in boron neutron capture therapy, Radiat. Res. 178 (2012) 609.
[IV-58] SATO, T., MASUNAGA, S.I., KUMADA, H., HAMADA, N., Microdosimetric modeling of biological effectiveness for boron neutron capture therapy considering intra- and intercellular heterogeneity in 10B-distribution, Sci. Rep. 8 (2018) 988.
[IV-59] MASUTANI, M., “Pre-clinical evaluation of biological effects of AB-BNCT system”, IAEA Virtual Technical Meeting on Best Practices in Boron Neutron Capture Therapy (March 2022), IAEA, Vienna (2022).
[IV-60] MATSUMOTO, Y., et al., A critical review of radiation therapy: From particle beam therapy (proton, carbon, and BNCT) to beyond, J. Pers. Med. 11 8 (2021) 825.
[IV-61] HE, H., et al., The basis and advances in clinical application of boron neutron capture therapy, Radiat. Oncol. 16 1 (2021) 216.
[IV-62] MALOUFF, T.D., et al., Boron neutron capture therapy: A review of clinical applications, Front. Oncol. 11 (2021) 601820.
[IV-63] HIROSE, K., et al., Boron neutron capture therapy using cyclotron-based epithermal neutron source and borofalan (10B) for recurrent or locally advanced head and neck cancer (JHN002): An open-label phase II trial, Radiother. Oncol. 155 (2021) 182-187.
[IV-64] AIHARA, T., et al., BNCT for advanced or recurrent head and neck cancer, Appl. Radiat. Isot. 88 (2014) 12-15.
[IV-65] WARD, M.C., et al., Refining patient selection for reirradiation of head and neck squamous carcinoma in the IMRT era: a multi-institution cohort study by the MIRI collaborative, Radiat. Oncol. Bio. Phys. 100 (2018) 586-585.
[IV-66] TRIVILLIN, V.A., et al., Evaluation of local, regional and abscopal effects of boron neutron capture therapy (BNCT) combined with immunotherapy in an ectopic colon cancer model, Br. J. Radiol. 94 1128 (2021) 20210593.