中国科学技术大学研究生2021生化原理与应用复习资料及往年考试题
持续更新中!完整版由于排版待上传至资源
复习资料:
1.思考题
 基于上述结果阐述该蛋白质的基本特性,如需要得到状态稳定性质均一的蛋白,在表达和纯化过程中需要注意哪些基本事项?
基于上述结果阐述该蛋白质的基本特性,如需要得到状态稳定性质均一的蛋白,在表达和纯化过程中需要注意哪些基本事项?
参考答案:
(1)β-Me β-巯基乙醇能促进蛋白质链间或链内二硫键的断裂
(2)97℃ 5 min 热变性是指蛋白质环境温度升高到某一限定点时可以破坏氢键和范德华力,分子即处于热变性状态
作业:请阐述PCR的原理,基本步骤和注意事项
1.PCR原理
PCR即聚合酶链式反应,类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。根据DNA半保留复制的原理,在耐高温的DNA聚合酶(Taq酶)作用下,添加dNTPs、设计的20bp左右的寡核苷酸引物,控制温度变化使反应经过变性、退火(复性)、延伸3个步骤的多次循环,实现目的基因的体外指数倍扩增。
2.基本步骤:
①变性:模板DNA经过加热到93℃左右一定时间后,使得模板DNA双链或扩增的DNA双链解螺旋成单链,以便与引物结合。
②退火:即复性过程,模板DNA经加热变性成单链后,温度降至55℃左右,引物即与模板DNA通过碱基互补配对结合形成局部双链。
③延伸:DNA模板-引物结合后在72℃,在Taq酶作用下,以4种dNTP为原料,靶序列为模板,按照碱基互补配对原则与半保留复制原理,合成一条新的与模板DNA互补的半保留复制链。
重复变性-退火-延伸,可以获得更多的半保留复制链,而新合成的链又可作为下次循环的模板,经过25-30次左右的循环,可以实现目的基因的指数扩增。一般还经过开始一次预变性10min以充分解开双链,最后一次延伸设置较长时间(5min)以使DNA充分延伸。
3.注意事项
①避免混用枪头造成样品间交叉污染。
②退火温度根据引物Tm值为参考,根据扩增长度适当下调作为退火温度。
③带一次性手套,若不慎溅到反应液,及时更换。
④操作多份样品时,先配置反应混合液,再分装,从而减少操作次数,避免污染。
⑤加完模板后及时盖上反应管,并做好标记
⑥ 设立空白对照及阴阳性对照,以验证PCR反应的可靠性。
基因工程实验技术-2作业:(第二次)
1.简述DNA-sequencing的过去,现在和将来(原理及应用)
2.列举至少3种目的基因在受体细胞中的检测和鉴定的方法
1.简述DNA-sequencing的过去,现在和将来(原理及应用)
DNA测序技术的发展
(1)DNA测序的历史:
DNA测序建立在蛋白质(胰岛素)和RNA(丙氨酰-tRNA)测序的基础上,其中:
1976年,Sanger等提出了双脱氧链终止法测序技术:
在DNA合成的四管反应系统中分别按比例引入四种双脱氧核苷酸,只要双脱氧核苷酸掺入链端,该链就停止延长,链端掺入单脱氧核苷酸的片段可继续延长。如此每管反应体系中便合成以共同引物为5’端,以双脱氧核苷酸为3’端的一系列长度不等的核酸片段。反应终止后,分四个泳道进行电泳。以分离长短不一的核酸片段(长度相邻者仅差一个核苷酸),根据片段3’端的双脱氧核苷酸,便可依次阅读合成片段的核苷酸排列顺序。如今该反应体系可以通过将ddNTPs标记上不同的荧光在同一个反应体系中实现。
1987年,Smith、Hood和Applied Biosystems开发了Sanger荧光测序仪,Sanger荧光测序仪一天可以测出约1000bp个碱基
1982-今
序列的储存平台的建立与发展,如:Genbank,WGS数据库,UCSC数据库等以及基因序列搜索工具Blast的开发和应用
2001年
人类基因组计划通过鸟枪测序法策略完成
第二代测序技术,即Next-generation sequencing NGS:
454焦磷酸法平台是最早上市的循环微阵列法平台,使用的是边合成边测序的策略。其大致原理是将目的基因打断,继而加衔接头固定到磁珠上,将磁珠包裹进乳滴中进行平行扩增乳滴PCR,随后将DNA片段放入PTP反应管中进行测序,每次只加入一种碱基,如果发生配对就会释放焦磷酸盐PPi,PPi在ATP硫酸化酶的催化下与腺苷酰硫酸反应生成 ATP,ATP 与虫萤光素反应发光,光信号被仪器高灵敏度实时捕获,依次拼接从而进行测序。
Solexa基因组分析仪也称为Illumina测序仪,所使用的技术是克隆单分子阵列技术,先加DNA片段打断成100-200bp左右的片段,在固相载体上进行桥PCR循环,产生大量的DNA簇,再用sanger测序类似的方法加入用4种不同荧光标记并结合了可逆终止剂的 dNTP,由于终止剂的作用,DNA 聚合酶每次循环只延伸一个 dNTP。每次延伸所产生的光信号被标准的微阵列光学检测系统分析测序,下一次循环中把终止剂和荧光标记基团裂解掉,然后继续延伸 dNTP,实现了边合成边测序技术。
第三代测序技术,即单分子测序技术
单分子测序技术代表性的技术为美国螺旋生物(Helicos)的SMS技术和美国太平洋生物(Pacific Bioscience)的SMRT技术。脱氧核苷酸用荧光标记,显微镜可以实时记录荧光的强度变化。当荧光标记的脱氧核苷酸被掺入DNA链的时候,它的荧光就同时能在DNA链上探测到。当它与DNA链形成化学键的时候,它的荧光基团就被DNA聚合酶切除,荧光消失。这种荧光标记的脱氧核苷酸不会影响DNA聚合酶的活性,并且在荧光被切除之后,合成的DNA链和天然的DNA链完全一样。
第四代测序技术,即纳米孔测序技术
单分子DNA从纳米孔通过;通过纳米孔上的酶对于测序分子在单核苷酸精度的控制;结合单核苷酸的测序精度控制进行测序,目前市场上广泛接受的纳米孔测序平台是Oxford Nanopore Technologies(ONT)公司的MinION纳米孔测序仪。它的特点是单分子测序,测序读长长(超过150kb),测序速度快,测序数据实时监控,机器方便携带。
DNA测序技术的应用:
1.基因组的de novo组装
进行(1)遗传图谱(2)物理图谱(3)双端测序,8-10冗余,1/100,000的错误率(4)Celera, 从贪婪算法(phrap and the TIGR -assembler)到基于图的方法(重叠–布局–-共识)(5)de Bruijn graphs (如 EULER and Velvet)(6)高分子量high molecular weight (HMW)(7)HiC的工作
2. 基因组重测序
3.临床应用,如无创产前诊断,利用WES诊断疾病,癌症的靶向治疗
4. 测序仪作为分子计数装置,如RNA-seq取代芯片序列标签
5.宏基因组测序,以获得100%的基因组,没有任何gap;人口规模的测序;
6.单细胞RNA-seq、基因编辑、实时便携式测序仪、DNA生物合成。
可以说未来DNA测序对生物学的影响堪比甚至超过显微镜将人们带入了生物微观世界。
.列举至少3种目的基因在受体细胞中的检测和鉴定的方法
(1)蓝白斑筛选
原理是利用载体上含有抗生素基因,同时又含有β-半乳糖苷酶基因lacZ的调控序列和一段编码序列,在这段编码区中间有一个多克隆位点MCS,它并不破坏阅读框,并且可以与宿主大肠杆菌工程菌编码的的lacZ的C段部分序列形成有酶活性的β-半乳糖苷酶,称为α-互补,通过这种途径,没有导入质粒的受体菌不能在选择培养基上生长,而导入了质粒的宿主菌又分为2种情况:①外源基因片段没有插入质粒,在IPTG的诱导下,互补且具有酶活性的β-半乳糖苷酶可以分解底物X-gal,形成蓝色菌落。②外源基因片段插入质粒,破坏了阅读框,从而无法实现α-互补,不能分解培养基中的X-gal,显示是白色的。因此重组质粒在生色诱导培养基上表现为白色菌落。
(2)Southern印迹法
具有一定同源性的两条核酸单链在一定的条件下,可按碱基互补的原则特异性地杂交形成双链。一般利用琼脂糖凝胶电泳分离经限制性内切酶消化的DNA片段,将胶上的DNA变性并在原位将单链DNA片段转移至尼龙膜或其他固相支持物上,经干烤或紫外线照射固定,再与相对应结构的标记探针进行杂交,用放射自显影或酶反应显色,从而检测特定DNA分子的含量。
(3)Northern印迹法
检测目的基因是否转录:裂解表达菌株,提取纯化mRNA,经过琼脂糖凝胶电泳,转膜,利用设计好的探针杂交,如果出现杂交带,表明目的基因已转入受体细胞中。
(4)蛋白水平检测
·进行SDS-PAGE电泳确定表达条带,切胶经过肽指纹谱测序确定是否为目标蛋白。
·抗原抗体杂交实验:提取出表达蛋白,加入相应的抗体,如果出现杂交条带,说明目标蛋白已表达。
请简述至少三种分子克隆的原理和方法,并比较优缺点
(1)依赖连接反应的克隆
通过聚合酶链式反应扩增目的基因片段,再用限制性内切酶酶切目的基因和载体片段,得到碱基互补配对的黏性末端,进而通过T4 DNA连接酶将载体与目的基因片段连接。
(2)TA克隆技术
利用Taq聚合酶具有末端转移酶(TdT)活性,但却不具有3’-5’端外切酶校准活性的特点,可在PCR产物的3’端加上一个非模板依赖碱基“A”。pMD18-T是一种高效克隆PCR产物的专用载体,其3’端添加带有一个突出的“T”尾,在连接酶作用下,能高效地与带“A”尾的PCR产物连接,极大地提高了克隆的效率。TA克隆是目前克隆PCR产物最简便、快捷的方法。
连接反应一般在灭菌的0.5ml离心管中进行。
10μl体积反应体系:取T载体1μl (50ng),加入等摩尔数PCR产物 。加入含ATP的10×Buffer 1μl,T4 DNA连接酶合适单位,用ddH2O 补足至10μl 。
稍加离心,通常为14-16℃水浴连接8-14hr,或4℃过夜染后进行蓝白斑筛选。
(3)不依赖基因序列和连接反应的克隆SLIC
不依赖基因序列和连接反应的克隆方法,即Sequence and ligation-independent cloning SLIC,利用PCR技术在载体和目的基因片段添加15-30bp的同源末端,利用T4DNA聚合酶的3’-5’端外切酶活性,在没有dNTP存在情况下,22℃左右将DNA片段消化,并产生含同源序列的5’突出端,控制时间加入dCTP可以终止反应。然后,将T4 DNA聚合酶处理后的DNA片段置于T4 DNA连接缓冲液中,于37 ℃完成突出单链的复性重组,形成含有缺口的环状中间体,直接转化细胞。利用大肠杆菌自身的修复系统使其形成完整的环状质粒。
(4)Gibson等温一步拼接法
不考虑目的基因片段的长度或末端的互补性,利用T5核酸外切酶5’→3’核酸外切酶活性消化载体和目的基因片段进而产生3’突出末端,该单链DNA的重叠序列在50℃特异性退火,并使得外切酶逐渐热失活,最后由Phusion聚合酶和Taq DNA连接酶修复连接,从而形成完整的双链DNA分子,实现无痕拼接。
其他新兴的分子克隆方法还有聚合酶环形延伸克隆、细胞裂解物体外无痕连接、细胞体内组装克隆等。
各种常见的分子克隆方法的优缺点比较如下:
分子克隆方法 优点 缺点
依赖连接反应的克隆 被实验室广泛应用,技术成熟 操作步骤费时费力,培训周期长
TA克隆技术 简便、快捷 载体来源受限,效率取决于所用的DNA聚合酶,末端易降解
不依赖连接反应的克隆 不需要连接酶,也不必考虑插入片段的序列,可实现多个 DNA 片段的一次性连接重组,用途非常广泛,有商品化GatewayTM 精确度低,重组结合的效率低
Gibson
等温一步拼接法 不用考虑目的片段长度、末端的互补性,效率高,无痕连接 构建成本高,不适合大规模应用
作业:简述蛋白质的四个结构层次以及特点
·蛋白质一级结构: 指蛋白质分子内氨基酸组成及排列顺序。相邻两个氨基酸之间依靠肽键连接。
·蛋白质二级结构: 指由相邻连续的若干氨基酸在局部空间折叠形成具有一定规则的片段子结构,如α-螺旋、β折叠、β转角、无规卷曲等。氢键是二级结构的主要维持力。
·超二级结构 在二级结构与三级结构之间还有超二级结构,指蛋白质中由二级结构按照一定的特殊的几何关系组合起来的结构。
·蛋白质三级结构:蛋白质分子在二级结构、超二级结构的基础上进一步盘曲折叠形成的高级结构,三级结构产生于肽链氨基酸侧链之间的相互作用。次级键是维持三级结构最主要的力,最主要的键是疏水键。
·蛋白质四级结构:蛋白质各个亚基通过非共价键作用排列组装成的立体结构。是蛋白质亚基通过非共价键(氢键、疏水键、离子键、范德华力)形成的聚合体的结构。

作业:简述常用的表达系统和组成
(1)原核生物-大肠杆菌表达系统
组成:1.启动子(强启动子,有基础性表达,且通常是可诱导型的,如lac启动子)
2.转录终止子(阻止转录通读,并能增强mRNA分子的稳定性);
3.翻译起始序列(包括核糖体结合位点RBS)
4.翻译增强子(一些元件能增强表达效率)
5.翻译终止密码(大肠杆菌偏爱UAA作为终止密码)
常用的载体系统是pET,表达系统有BL21(蛋白酶缺陷型)、Rosetta 2(添加稀有密码子tRNA,提高真核基因的表达效率)、Origami 2(还原途径双突变菌株,提高二硫键形成几率,促进蛋白溶解性及活性表达)。
(2)真核生物-酵母表达系统(常用的是巴斯德毕赤酵母,此外还有酿酒酵母)
有分泌性和胞内性2大类(取决表达载体构建是否带有信号肽),酵母表达系统的组成包括 醇氧化酶-1(AOX1)基因的强启动子和转录终止子(5’AOX1和3’AOX1),它们被多克隆位点(MCS)分开,可帮助外源基因整合进入酵母基因组,此外还有组氨醇脱氢酶基因(HIS4)选择标记。
真核哺乳动物表达系统,表达载体的必要元件包括一个强启动子(CMV)、转录终止序列和一个有效的mRNA翻译信号、标记基因(包括稳定细胞系筛选基因、大肠杆菌筛选基因)、增强子、内含子(增加转录产物的稳定性)
真核转基因植物:根瘤农杆菌可以引起双子叶植物致癌的质粒Ti质粒,其上的T-DNA片段会与植物细胞的核基因组整合,Ti质粒是200kb左右的环状质粒,由毒性区(Vir)、结合转移区(con)/复制起始区(Ori)和T-DNA区四部分组成,vir区和T-DNA区与冠瘿瘤生成相关,T-DNA区可以携带任何外源基因整合到植物基因组中。
(3)无细胞蛋白合成系统
无细胞蛋白质合成系统是一种以外源mRNA或DNA为模板,在细胞抽提物的酶系中补充底物和能量来合成蛋白质的体外系统。有原核大肠杆菌S30 T7高产系统,真核动物兔网织红细胞系统。
作业:简述蛋白质纯化的基本原理、策略和常用的方法
(1)基本原理:
蛋白质纯化是根据不同蛋白质在电荷、大小、疏水性、生物学活性、溶解度都会有差异,利用它们之间的差异,经样品捕获、中度纯化、精细纯化3个过程,采用不同的分离方法,从而将目的蛋白从蛋白混合物中纯化出来。
(2)纯化策略:
①尽早去除对样品有损伤的杂质,如蛋白酶、DNA、RNA、其他高聚小分子成分
②在每一步纯化过程中使用不同的纯化技术
③纯化步骤及中间步骤尽可能少,以减少损失提高得率
④根据目的相应的纯度和产量要求制定纯化策略,以维持生物学活性,节约成本及时间;
⑤明确目标蛋白特性,合理选择纯化分离技术。
(3)常用方法
初步纯化(样品捕获)常采用捕获能力强的亲和层析、离子交换层析或疏水层析,在中度纯化则采用一次离子交换层析或疏水层析,在精细纯化阶段则采用分子筛或者反相层析得到高分辨率、高选择性的蛋白质样品。
各纯化步骤常用的纯化方法原理及操作如下:
①亲和层析:
利用生物分子间专一的亲和力而进行分离的一种层析技术,表达的目的蛋白一般会添加His标签,通过镍柱可以与Ni2+形成配位键选择性结合在金属离子上,结合在介质上的His标签蛋白可以通过提高缓冲液中的咪唑浓度进行竞争性洗脱,同时也可以利用组氨酸咪唑基团带正点通过提高洗脱液PH值进行洗脱。
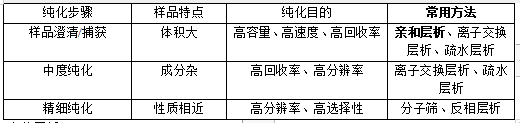
②离子交换层析:
利用在一定PH条件下,蛋白质所带电荷不同而进行分离的方法,常用的有弱酸型的羧甲基纤维素(CM)和弱碱性的DEAE纤维素柱。
③疏水层析:
是根据蛋白质分子表面疏水性差别来分离蛋白质和多肽等生物大分子。
④凝胶过滤层析(分子筛):
利用多孔网状结构的颗粒的分子筛作用,根据被分离样品各组分相对分子质量大小的差异进行洗脱分离。大分子先流出来,小分子后流出来。
⑤反相层析:
通过在支持物上涂上一层高碳原子的疏水性强的烷烃类,洗脱液用极性强的溶液(甲醇、水混合物),则被分离样品中极性强的物质不被吸附,最先洗下来,与普通吸附层析法相反。主要用于蛋白质分析。
除此之外,还可以通过电泳、结晶的方法进行提纯,实际蛋白纯化过程中,要结合目标蛋白的特性,灵活选用不同的方法进行分离纯化。
·题目:举1个荧光染料或荧光蛋白的例子,说明它的最大激发波长,最大发射波长和具体用途。
Hoechest 染料:
Hoechest系列荧光染料可以穿透细胞膜,通过染细胞核DNA分子,可确定细胞的精确位置和数量。Hoechest倾向于结合DNA小沟富含A/T的DNA链,富含A/T的DNA双链使得荧光强度显著增强,嵌入双链DNA后释放强烈的蓝色荧光,对细胞的毒性较低。
Hoechst 33342的最大激发波长和最大发射波长:
和双链DNA结合后,最大激发波长为350nm左右,最大发射波长为461nm。发出蓝靛色荧光。
Hoechest用途:
1.可以穿过细胞膜,可以结合于活细胞或固定过的细胞,因此可以用于活细胞标记
2.通过染核DNA,确定细胞的精确位置和数量
(较之另外一种DNA染色剂DAPI(最大激发波长358nm,最大发射波长461nm)而言,Hoechest染料的毒性低))
3.可以用于细胞凋亡检测,染色后用荧光显微镜或流式细胞仪检测。
利用荧光染料 SYBR® Green I 做荧光定量 PCR 检测时,为什么要用熔解曲线来判断产物特异性?
答:随着特异性PCR产物的指数扩增,每个循环的的延伸阶段,SYBR Green I染料掺入到双链DNA中,其荧光信号强度与PCR产物的数量呈正相关。但是当PCR反应中有引物二聚体或者非特异性扩增时,该染料也可以结合发出荧光,从而干扰对特异性产物的准确定量。
因此,基于非特异性染料 SYBR® Green I 的定量PCR,可以通过对PCR产物的熔解曲线进行分析,使得非特异性问题得以解决,保证荧光信号的特异性。
2 、如何检测某个癌症基因在不同药物处理条件下的表达情况?
答:通过实时荧光定量PCR技术进行检测:
第1步:分离不同药物处理条件下目的基因-癌基因mRNA,
第2步:设计和优化引物
第3步:通过逆转录合成cDNA及互补链并进行cDNA的扩增,设置GAPDH cDNA作为内对照
第4步:运行qPCR
第5步:分析:对不同药物处理条件下的目的基因的mRNA经反转录扩增下的cDNA进行cDNA起始量检测,即可确定癌症基因在不同药物处理条件下的表达情况:
采用2-ΔΔc(t)法:(相对于未经药物处理的癌症基因表达而言):
注:F为经过不同药物处理后癌症基因相对于未经药物处理的表达情况
除此之外,还可以采用表达序列标签ECT,微阵列杂交micro array方法检测。
Q:请简要说明电渗流的形成及其影响因素。
A:电渗流是指将电场加在一个带电荷的表面或多孔的固体介质的两端,同时该表面或介质处在电解溶液中的时候,溶液会以某一固定的速度流动,由溶液中施加在净移动电荷上的电场产生的库仑力引起,外加直流电场对管壁溶液双电层的作用而产生的溶液相对于固体表面的整体流动称为电渗流。

Q:请简述GC-MS对物质进行定性分析的主要依据:
A:GC-MS对物质进行定性分析是通过气相色谱中色谱峰的保留时间和质谱中的m/z(质荷比)质谱峰处出现的位置以及其对应的各离子峰强度(intensity)、可以进行定性分析。
列举你身边用到“液相色谱”?举一个经典的实验例子说明实验流程。
超纯水 由 离子交换技术进行制备。离子交换树脂是有机高分子聚合物,基于树脂与自来水中各种离子间的可交换性,采用R-SO3H型阳离子交换树脂,交换基团中的H+可以和天然水中的各种阳离子进行交换,使得其中的Ca2+、Mg2+、Na+、K+等阳离子结合到树脂上,而H+进入水中,于是就去除了水中的金属阳离子杂质。当水通过阴离子交换树脂时,交换基团中的OH-可以将HCO3-、Cl- 、SO42-等阴离子除去,而交换出来的OH-和H+发生中和反应,得到超纯水