1.简介:
(1)介绍:
MCScanX采用改进了的MCScan算法,分析基因组内或者基因组间的共线性区块。它利用两个物种蛋白质(或核酸)blastp比对结果,再结合这些蛋白质基因在基因组中的位置(处理过的gff),得到两个物种基因组的共线性区块。如果是分析基因组内的共线性区块,物种内蛋白质自己比对自己就可以。
mannual:http://chibba.pgml.uga.edu/mcscan2/documentation/manual.pdf
软件包含两个部分:1.MCScan算法;2.后期的可视化分析。目前这个软件可以在MAC OS(需要提前安装xcode)和 linux(需要Java SE Develoment Kit和“libpng”)上使用。MCScanX包括MCScanX、MCScanX_h、duplicate_gene_classifier三个主程序,位于主文件夹中;还有12个下游分析程序位于downstream_analyses文件夹。注意:优化版本中,13年发布的MCScanX-transposed是用来检测基因组内或组间的transposed gene重复。
(2)发表文献:Wang Y , Tang H , Debarry J D , et al. MCScanX : a toolkit for detection and evolutionary analysis of gene synteny and collinearity[J]. Nucleic Acids Research, 2012, 40(7):e49-e49
2.安装
pengzw@super-server:~$ wget http://chibba.pgml.uga.edu/mcscan2/MCScanX.zip
pengzw@super-server:~$ unzip MCScanX.zip -d ~/biosoft/ #安装在~/biosoft/下
pengzw@super-server:~/biosoft/MCScanX$ cd ~/biosoft/MCScanX
pengzw@super-server:~/biosoft/MCScanX$ make #会出现如下报错,修改文件以后再make
pengzw@super-server:~/biosoft/MCScanX$ make ##出现以下信息,则证明安装对啦
g++ struct.cc mcscan.cc read_data.cc out_utils.cc dagchainer.cc msa.cc permutation.cc -o MCScanX
g++ struct.cc mcscan_h.cc read_homology.cc out_homology.cc dagchainer.cc msa.cc permutation.cc -o MCScanX_h
g++ struct.cc dup_classifier.cc read_data.cc out_utils.cc dagchainer.cc cls.cc permutation.cc -o duplicate_gene_classifier
g++ dissect_multiple_alignment.cc -o downstream_analyses/dissect_multiple_alignment
g++ detect_collinear_tandem_arrays.cc -o downstream_analyses/detect_collinear_tandem_arrays
cd downstream_analyses/ && make
make[1]: Entering directory '/home/pengzw/biosoft/MCScanX/downstream_analyses'
javac -g family_circle_plotter.java
javac -g dot_plotter.java
javac -g family_tree_plotter.java
javac -g family_tree_plotter_show_length.java
javac -g bar_plotter.java
javac -g dual_synteny_plotter.java
javac -g circle_plotter.java
javac -g family_tree_plotter_chr.java
make[1]: Leaving directory '/home//pengzw/biosoft/MCScanX/downstream_analyses'
pengzw@super-server:~/biosoft/MCScanX$ echo 'PATH=$PATH:~/biosoft/MCScanX/ ' >> ~/.bashrc
pengzw@super-server:~/biosoft/MCScanX$ source ~/.bashrc
pengzw@super-server:~/biosoft/MCScanX$ MCScanX
报错如图:是因为MCScanX 不支持64位系统。如果要在 64位上运行,需要加入相关库文件
 1.png
1.png
报错1: "msa.cc:289:9: error: ‘chdir’ was not declared in this scope"
解决方案: 打开msa.cc,在顶部加上#include
 2.png
2.png
报错2: "dissect_multiple_alignment.cc:252:44: error: ‘getopt’ was not declared in this scope"
解决方案: 打开"dissect_multiple_alignment.cc",在顶部加上#include
报错3: "detect_collinear_tandem_arrays.cc:286:17: error: ‘getopt’ was not declared in this scope"
解决方案: 打开"detect_collinear_tandem_arrays.cc",在顶部加上#include
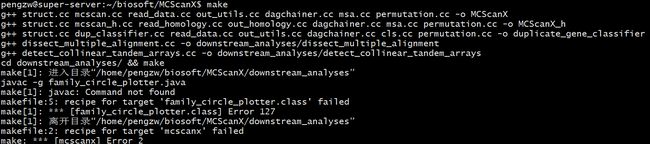 3.png
3.png
报错4: "make[1]: javac: Command not found"
解决方案: 在https://www.oracle.com/technetwork/java/javase/downloads/index.html下载JDK,安装Java环境
有权限就直接sudo,因为我真的很懒。
pengzw@super-server:~$ sudo apt install openjdk-8-jdk
3.使用
(1).准备文件xyz.gff
MCscanX要求的gff文件和标准的gff文件不一样,它只有四列, 其中"sp#"的sp意味着你要用2个字母代表物种(多个字母好像也不影响结果),#则表示是哪条染色体。而"gene"则要是你蛋白序列的基因名。
sp# gene starting_position ending_position
gff3文件第九列是=连接,利用awk指定多个分隔符就可得到
pengzw@super-server:~/reference/At$ awk -F "[= \t]" '$3 == "gene" {print$1"\t"$11"\t"$4"\t"$5}' Athaliana_167_TAIR10.gene.gff3|head -n 10
Chr1 AT1G01010 3631 5899
Chr1 AT1G01020 5928 8737
Chr1 AT1G01030 11649 13714
Chr1 AT1G01040 23146 31227
Chr1 AT1G01050 31170 33153
Chr1 AT1G01060 33379 37871
Chr1 AT1G01070 38752 40944
Chr1 AT1G01073 44677 44787
Chr1 AT1G01080 45296 47019
Chr1 AT1G01090 47485 49286
(2)xyz.blast文件
ncbi-blast+安装(sudo安装可能不是最新版):
pengzw@super-server:~$ sudo apt install ncbi-blast+
## 或者本地安装
pengzw@super-server:~$ mkdir biosoft
pengzw@super-server:~$ wget ftp://ftp.ncbi.nlm.nih.gov/blast/executables/blast+/LATEST/ncbi-blast-2.8.1+-x64-linux.tar.gz
pengzw@super-server:~$ tar zxvf ncbi-blast-2.8.1+-x64-linux.tar.gz -C ~/biosoft/
pengzw@super-server:~$ cd ~/biosoft/ncbi-blast-2.8.1+/bin
pengzw@super-server:~/biosoft/ncbi-blast-2.8.1+/bin$ ls #绿色为程序
blastdb_aliastool blast_formatter blastx dustmasker makeblastdb psiblast segmasker update_blastdb.pl
blastdbcheck blastn convert2blastmask get_species_taxids.sh makembindex rpsblast tblastn windowmasker
blastdbcmd blastp deltablast legacy_blast.pl makeprofiledb rpstblastn tblastx
pengzw@super-server:~/biosoft/ncbi-blast-2.8.1+/bin$ echo 'PATH=$PATH:~/biosoft/ncbi-blast-2.8.1+/bin/' >> ~/.bashrc
pengzw@super-server:~/biosoft/ncbi-blast-2.8.1+/bin$ source ~/.bashrc
pengzw@super-server:~/biosoft/ncbi-blast-2.8.1+/bin$ makeblastdb
blast建库(索引):
makeblastdb -in refpep.fa -dbtype prot -parse_seqids -out refpep.db
options:
-in :带格式化的序列文件,必须为fa
-dbtype :数据库类型,prot或者nucl
-out:数据库索引名
......
blast比对:
blastp -query yourpep.fa -db refpep.db -out xyz.blast -evalue 1e-10 -num_threads 24 -outfmt 6 -num_alignments 5
options:
-parse_seqids:解析序列标识,一般都要加上
-evalue:E值的阈值设置官网推荐的1e-10
-num_threads 24:线程为24
-num_alignments5:是取最好的5个比对结果
-outfmt 6:输出文件格式,总共有12种格式,6是tab格式
注意:
1.需要对序列进行预处理,仅保留每个基因中的一个转录本。
2.注意统一gff和blast文件中ID,不然无结果(0 matches )。
3.blastp format6:12列
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| queryID | dbID | identity% | length | mismatch | gap | querypos1 | querypos2 | dbpos1 | dbpos2 | e-value | bit-score |
4.如果要做基因组组内和组间的共线性,那么就要将这两个基因组先进行合并, cat 1genome.fa 2genome.fa > all.fa, 然后用all.fa建索引,用all.fa进行比对。文件生成后也需要整合 cat 1genome.gff 2genome.gff > all.gff。
(3)使用MCScanX分析基因组共线性区块:
./MCScanX dir/xyz #xyz.blast and xyz.gff在同一文件夹下
options:
[Usage] ./bin/mcscan2 prefix_fn [options]
-k MATCH_SCORE, final score=MATCH_SCORE+NUM_GAPS*GAP_PENALTY
(default: 50)
-g GAP_PENALTY, gap penalty (default: -1)
-s MATCH_SIZE, number of genes required to call a collinear block
(default: 5)
-e E_VALUE, alignment significance (default: 1e-05)
-m MAX_GAPS, maximum gaps allowed (default: 25)
-a only builds the pairwise blocks (.aligns file)
-b patterns of collinear blocks. 0:intra- and inter-species (default); 1:intra-species; 2:inter-species -h print this help page
运行结果如图:
4.结果
注意:0 matches imported (xxxxx discarded), 那么一定是你的GFF文件里的基因名和blast结果的基因名不对应导致
程序输出3个文件:
| Filename | Description |
|---|---|
| xyz.collinaeriry | 共性性区域数据。可以是同一物种类的共线性区域,也可以是物种间的共线性区域 |
| xyz.html | 在网页中浏览,可以直观看到在各个染色体上共线性的状态。灰色表示染色体序列;红色表示染色体上的串联基因;黄色表示共线性基因。 |
| xyz.tandem | 基因串联数据。2个或2个以上的同源基因在基因组上紧挨在一起。 |
核心程序:
- MCScanX 检测共线性区域,并比对到参考染色体上。
- MCScanX_h 和MCScanX类似,只不过输入文件是成对的用tab隔开的同源基因。
- duplicate_gene_classifier 基因分类
5.下游分析及可视化
12个下游分析程序:
1.detect_collinear_tandem_arrays
2.dissect_multiple_alignment
3.add_ka_and_ks_to_collinearity.pl
4.group_collinear_genes.pl
5.detect_collinearity_within_gene_families.pl
6.origin_enrichment_analysis.pl
7.dot_plotter.java
8.dual_synteny_plotter.java
9.circle_plotter.java
10.bar_plotter.java
11.family_circle_plotter.java
12.family_tree_plotter.java
(1)duplicate_gene_classifier(基因分类):
其中0,1,2,3,4分别代表了哪五大类:
0:singleton(非重复基因)
1:dispersed(不是2,3,4的其它重复)
2:proximal(染色体附近的重复,但是不相邻)
3:tandem(串联重复)
4:WGD/segmental(在共线性区域的共线性基因)
(2)detect_collinearity_within_gene_families.pl:提取基因家族的分析结果
1)准备gene_family_file:txt, 以tab键分隔
2)detect_collinearity_within_gene_families.pl用法:得到复制基因对
perl detect_collinearity_within_gene_families.pl -i gene_family_file.txt -d xyz.collinearity -o
output_file
3)对基因家族的复制基因对分类:
安装:
wget http://chibba.pgml.uga.edu/mcscan2/transposed/MCScanX-transposed.zip
unzip MCScanX-transposed.zip -d ~/biosoft/
cd ~/biodoft/MCScanX-transposed
make
提取结果:
perl MCScanX-transposed.pl -i data -t at -c al,br,cp,pt,vv -o result/at_result -x 3
绘图:
按照manual中画图,
若结果不满意可以下载分析结果用circos软件绘图。
6.参考
1)http://chibba.pgml.uga.edu/mcscan2/transposed/example.php
2)http://chibba.pgml.uga.edu/mcscan2/documentation/manual.pdf
3)http://blog.biochen.com/archives/category/bioinfo
4)https://www.jianshu.com/p/8373e50722f6
5)https://www.jianshu.com/p/740cb9eccf2b