过去几年对成人胶质瘤的生物学研究产生了重要的见解。诸如癌症基因组图谱(TCGA)等努力已经全面地记录了胶质母细胞瘤和低级别胶质瘤中发生的一连串体细胞改变,从而导致发现诸如IDH1突变在低级别胶质瘤和继发性胶质母细胞瘤的发展中的重要性。另一方面,小儿弥漫性脑桥脑胶质瘤(DIPG) - 儿童期最常见的恶性原发性脑肿瘤 - 已被发现具有截然不同的生物学基础。例如,百分之八十的这些肿瘤含有编码组蛋白H3的基因突变。脑干胶质瘤能治好吗?
在这两个诊断的关系是成人脑干胶质瘤。不幸的是,它可能更容易描述成人脑干胶质瘤,因为山谷笼罩在代表成人神经胶质瘤和儿科DIPG的两个不断增长的知识山之间的阴影中,因为很少有研究调查这种特殊的诊断。成人脑干胶质瘤的解剖学基础并不适合简单的研究,因为脑干充满了脑干核和白质束,这是基本功能必不可少的。切除通常是不可能的; 即使是活组织检查也具有挑战性,并发症风险很高。
在成人脑干胶质瘤的保护伞内,有一部分肿瘤外观相似,病因可能与儿童期DIPG相似,但发病时间略长,一般影响年轻人。还有另一组更明确的病变,其与毛细胞星形细胞瘤具有临床和影像学特征,并且在发病时年龄中位数较年轻。在成年后期出现的成人脑干胶质瘤的子集通常更类似于成年期的其他从头恶性神经胶质瘤。然而,尽管存在这些差异,但就临床考虑而言,这些实体之间也存在共性。
在本文中,我们将回顾成人脑干胶质瘤的当前知识状态(和缺乏知识),并突出治疗进展的前景。
临床表现
相比于儿科DIPG,占儿科原发性脑肿瘤的大约20%,成人脑干胶质瘤构成成人胶质瘤的小于2%,有轻微的雄性优势。诊断时的中位年龄在30岁左右,但脑干胶质瘤可以在任何十年的生命中出现。
这正适合包围病理生理改变的阵列的诊断,成人脑干神经胶质瘤的放射线照相外观差别很大,大约40%显示出增强。相比之下,在儿科DIPG中,对比度增强通常不是一个突出的特征。对比度增强本身可以呈现可变的外观,其中一些肿瘤表现出最小或部分增强,而其他肿瘤表现出强烈的增强。MR光谱可以作为诊断的有用辅助,因为胆碱/ NAA比率的升高通常是可检测的,对成人脑干胶质瘤的一项分析显示在100%分析的病例中发现这一发现。FDG-PET也可能有助于区分侵袭性病变与惰性病变。
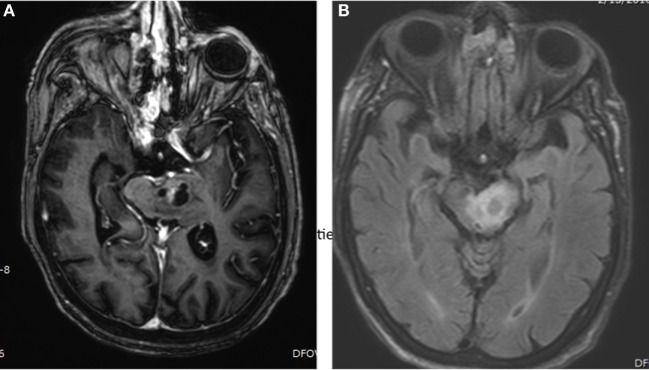
脑干胶质瘤在大约60%的病例中以脑桥为中心,但也可能来自中脑或髓质,并且可以渗透到脑干之外。它们可以是外生性或膨胀上成像,或中,与经典DIPG的情况下,可以是浸润性,几乎没有显着的质量效应(图中扩散图1)。
图1
脑MRI显示存在脑干胶质瘤的82岁女性患有组织学诊断的星形细胞瘤,III级。(A)轴向,后钆MRI序列显示囊性,增强左脑桥质量。(B)轴向,FLAIR MRI序列显示左脑桥肿块的周围水肿。
临床上,重要的是区分涉及中脑顶盖的神经胶质瘤 - 通常表现为懒惰 - 和经典的弥漫性脑桥神经胶质瘤,它们通常不会增强对比度或具有不同的增强模式。顶盖胶质瘤通常是低级的,非增强的,并且通常是非进行性的。它们在儿童期最常被诊断出来,但可以在任何年龄检测到。观察通常是一种合理的管理选择,当需要进行干预时,通常只能解决阻塞性脑积水问题。一小部分顶盖胶质瘤可能表现得更积极; 对比增强和囊性变化的发展可能预示着这种进展。由于其独特的自然史,顶盖胶质瘤通常不被认为与其他脑干胶质瘤的脉络相同,并且在本综述中将不再进一步阐述。
组织学上,成人脑干胶质瘤可具有星形胶质细胞,少突神经胶质细胞或混合外观,星形细胞肿瘤进一步表征为毛细胞性或弥漫性浸润性。一项针对21例组织学证实的疾病患者的单机构意大利回顾性分析确定了2例毛细胞星形细胞瘤,9例低级别星形细胞瘤,8例间变性星形细胞瘤和1例胶质母细胞瘤。MD Anderson回顾性分析包括98例组织学病例,确定28例胶质母细胞瘤,43例间变性星形细胞瘤,15例弥漫性星形细胞瘤和11例未另行规定的胶质瘤。
成人脑干胶质瘤最常见的症状是头痛,这可能是脑积水的表现。颅神经缺损和长道标志也很常见。“交叉”缺陷,其中面部症状和症状是手臂/腿部症状和症状的对侧,是脑干病理学的另一个特征标志。偶尔,临床衰退可能先于放射学进展,因为脑干中关键结构的密度在出现缺陷之前几乎没有生长边缘。
预后考虑因素
虽然儿科DIPG与10个月的惨淡预后相关,只有10%的儿科患者生活超过诊断2年,但成人脑干胶质瘤的中位生存期仍处于严峻但不完全沮丧的范围内。 -40个月。此外,由于成人脑干胶质瘤的侵袭性差异很大,因此诊断时个体患者的预后结果可能很困难。
增加肿瘤等级和对比度增强与显着降低的存活率相关。对17名DIPG成人进行的分析显示,低级别的中位OS为57个月,高级别胶质瘤的中位OS为16个月。在本研究中,对比度增强与组织学分级强烈相关 - 非增强型DIPG患者的中位OS为57,而肿瘤增强患者为13个月。MD Anderson对成人脑干胶质瘤患者的回顾性分析显示,WHO 2级弥漫性星形细胞瘤的中位OS为77.0个月,WHO 3级间变性星形细胞瘤为21.1个月,胶质母细胞瘤为14.8个月。
年龄的增加也与生存率的恶化有关。MD Anderson回顾性研究显示,22-59岁患者的中位生存期为34个月,而60岁及以上患者仅为14.2个月。
已被鉴定为良好的预后因素其它特征包括的症状>病程3个月,和“坏死”对MRI的存在。位置也影响预后 - MD Anderson研究显示,中脑肿瘤的中位生存期为66.0个月,脑桥肿瘤的中位生存期为25.3个月,延髓肿瘤的中位生存期为51.3个月。虽然有一例脑垂体胶质瘤在垂体腺瘤放射治疗后发展8年,但其易感因素尚不明确。
脑干胶质瘤能治好吗?治疗方案有哪些
对于儿科DIPG,标准护理治疗包括涉及的野外放射治疗,通常为约54-60Gy的剂量。儿科DIPG的替代性分次方案 - 包括超分割,加速和大分割方案 - 不能提高生存率,在剂量> 64Gy时放射毒性风险显着增加。
迄今为止,DIPG的儿科治疗试验未能确定化疗的显着益处。口服烷基化药物替莫唑胺以及放射性佐剂替莫唑胺的第2阶段试验 - 与成人恶性胶质瘤的标准Stupp方案相似 - 导致中位OS仅为9.5个月。
在儿科DIPG人口的其他失败的战略包括大剂量化疗,并与依托泊苷,氯乙环磷酰胺,或替莫唑胺。已经进行了几项I期和II期靶向治疗试验,包括抗EGFR药物如厄洛替尼,吉非替尼和尼妥珠单抗的试验; 使用伊马替尼靶向PDGFR的试验; 使用法尼基转移酶抑制剂替比法尼和洛那法尼的试验; 抗血管生成药物如贝伐单抗,semaxanib和整合素抑制剂西仑吉肽的试验; mTOR抑制剂依维莫司的试验; 和多激酶抑制剂凡德他尼的试验。总体而言,这些试验的结果并不令人满意,尽管在这些患者的一小部分中已经报道了长期疾病控制。
对于患有脑干神经胶质瘤的成人,通常以54-60Gy的剂量进行的野外放射治疗被认为是标准的前期治疗,如儿科DIPG的情况。很少有研究利用化学疗法治疗成人脑干胶质瘤,而且这些研究通常仅限于单臂,单一机构或回顾性分析。然而,有理由希望成人的化学治疗更有成效。RTOG 9802的最终结果显示,对于所谓的“高风险”2级胶质瘤患者,单独使用联合化放疗与单独放射治疗有明显的益处,本研究将患者定义为40岁以上或经过次全切除术的患者。对于患有IDH1突变的肿瘤患者,联合治疗的益处尤其显着。
也许支持使用前期化疗(以及放射线)治疗成人脑干胶质瘤的最佳证据来自MD Anderson回顾性分析,该分析显示用标准Stupp方案治疗的成人脑干胶质母细胞瘤的生存率存在显着差异(并发放射线)和替莫唑胺加辅助替莫唑胺)与这些谁没有-用于改善与Stupp方案治疗的患者中位生存期为23.1与4.0个月病人谁没有。当然,该分析的范围受限于其数量较少(28名患者)和回顾性,因为接受Stupp治疗的患者在基线时往往具有更好的表现状态(KPS 90对80),并且在替莫唑胺时代,其他治疗和管理方面的进步可能会影响生存。对复发时用替莫唑胺治疗的15名成人“低度”弥漫性脑干胶质瘤(组织学或放射学外观定义)的单机构回顾性分析显示,中位PFS为9.5个月,中位OS为14.4个月。60%的患者出现临床改善,15例患者中有6例出现放射学反应(4例部分和2例轻微反应)。
再次照射是复发性成人脑干胶质瘤的另一种潜在治疗策略。单一机构回顾性分析5例成人进展性/复发性脑干胶质瘤经重复放射治疗后,治疗后生存期为3至36个月以上。五名患者中有四名患者在治疗后表现状态有所改善,另一名患者表现出可能归因于放射毒性的新症状。
抗血管生成药物贝伐单抗也可能在脑干神经胶质瘤成人的治疗中起作用。一项回顾性分析显示,接受贝伐单抗治疗的17例患者的中位PFS为2.0个月,6个月PFS为21%,其中1例患者无进展9个月(5例)。虽然有些令人鼓舞,但与幕上胶质母细胞瘤的6个月PFS相比,6个月PFS为21%。值得注意的是,除了抗肿瘤活性之外,贝伐单抗可能具有姑息性益处。贝伐单抗可减轻血管源性脑水肿,经常导致症状改善。此外,这种效果通常允许患者逐渐减少其类固醇剂量,这也可以具有下游益处。因为贝伐单抗既可以血管收缩,又可以降低血管通透性,贝伐单抗治疗通常可以减轻对比度。在这种情况下,监测T2 / FLAIR和扩散 - 重量成像(DWI)的变化具有更重要的意义。
DIPG基因检测研究
很少有科学的研究具体地研究成人脑干胶质瘤,但我们的儿科DIPG的生物学的理解已经在过去的几年中由几个里程碑式的研究。在2012年发表的一项此类研究中,吴等人。在78%的儿科DIPG中发现了H3F3A和HIST1H3B的突变。这两个基因中的突变导致组蛋白H3中的K27M氨基酸取代,并且表明表观遗传失调是儿科DIPG发病机制的重要贡献者。相反,组蛋白H3突变很少发生在成人幕上胶质母细胞瘤中。
另一方面,体细胞IDH突变在成人非脑干低级(2/3级)胶质瘤中非常常见。在对这些肿瘤的TCGA分析中,发现80.1%具有IDH突变。这些突变以前被认为在成人脑干胶质瘤中并不常见,因为儿科DIPG的研究未发现任何此类突变,并且在一项研究中仅在6%的成人脑干胶质瘤中发现了通过免疫组织化学检测到的IDH1 R132H突变 。然而,脑干胶质瘤的全外显子组测序研究表明,IDH突变在成人肿瘤亚组中并不常见,特别是当替代非R132H时包括突变(仅占成人幕上胶质母细胞瘤中IDH突变的5%)。在本研究中经历全外显子组测序的13个成人脑干胶质瘤中,5个(38%)是IDH1突变的。有三个IDH1 R132H突变,一个R132C和一个R132L突变。所有这些病例也有突变型TP53,其中4例病例有突变型ATRX。在遗传学上,该组类似于经典的IDH1突变脑星形细胞瘤,其通常也含有TP53和ATRX突变。。这5名患者的平均年龄为40岁,主要肿瘤位置在脑桥,所有5名患者都有脑桥位置,其中4名位于脑桥和髓质中。组织病理学检查发现4例为2或3级少突细胞瘤,1例为GBM。IDH1- 突变病例的中位生存期明显优于IDH1野生型病例。
在同一研究中,在7/13(54%)肿瘤中鉴定出H3F3A突变。这7个病例中的每一个还在TP53(4例)或PPM1D(3例)中都有突变。PPM1D抑制几种DNA损伤反应介质的激活; PPM1D中鉴定的突变增强了这种活性。其中一例病例携带PDGFRA突变(除PPM1D外)。一个人有NF1突变(除了PPM1D)。这些成年患者的平均年龄为29岁,主要位于髓质(4例)和中脑(2例)。其中两个病例在髓质和脑桥中具有双重位置。值得注意的是,虽然所有IDH1突变病例都有脑桥位置,但只有2/7的H3F3A突变病例具有脑桥位置,并且H3F3A突变病例平均倾向于更年轻。该组的组织病理学为少突细胞瘤(2例),星形细胞瘤(2例),少突神经胶质瘤(1例)和胶质母细胞瘤(2例)。在该研究中鉴定的所有H3F3A突变都涉及K27M氨基酸取代。没有H3F3A G34突变或HIST1H3B检测突变。H3F3AG34的突变通常在大脑半球中发现,并且发生在青春期和年轻的成年人,与K27的H3F3A突变相反,K27的H3F3A突变在幼儿的脑干神经胶质瘤中最常见,但也可能在成人中发生,如本研究所示。
成人脑干胶质瘤中MGMT启动子甲基化的频率尚未得到充分评估,尽管在一个系列中发现阳性MGMT表达(与未甲基化的MGMT启动子相关)为64.7%。在成人脑干胶质瘤中很少检测到1p / 19q的编码。对9个成人脑干胶质瘤的基因组分析研究确定了一个BRAF V600E突变和两个PIK3CA突变。在突变AVCR1(编码I型激活素A受体激酶)通常见于儿科DIPG和可能导致BMP-TGF-β信号传导途径的过度激活。然而,成人脑干胶质瘤中AVCR1突变的频率尚不清楚。发现MYCN的扩增在一个基因组分析中定义了儿科DIPG的子集; 这一发现在成人脑干胶质瘤中的发生频率也是未知的。
脑干胶质瘤能治好吗?未来发展方向
脑干胶质瘤,特别是成人,不是一种疾病。随着基因组测序技术的日益成熟和广泛应用,成人脑干胶质瘤治疗的未来在于解析哪些肿瘤最有可能对哪种疗法做出反应。例如,基于目前的知识,基于肿瘤是否具有IDH突变或H3F3A突变,似乎大多数成人脑干神经胶质瘤可以分层为两组之一。有趣的是,IDH突变导致DNA甲基化在整个基因组中,而H3F3A突变肿瘤与DNA相关的低甲基化。因此,虽然这两种肿瘤类型都具有显着的表观遗传基础,但是需要相反的策略来靶向这两组的DNA甲基化状态。组蛋白H3去甲基化的药理学抑制已显示在临床前研究诺上H3F3A -mutant脑干神经胶质瘤细胞系,和小分子H3脱甲基酶抑制剂正在开发中。多组蛋白去乙酰化酶抑制剂panobinostat也被证明可以在DIPG的临床前模型中恢复甲基化并使基因表达正常化。其他研究表明,体细胞组蛋白H3的改变可能导致含溴结构域蛋白1和4(BRD1和BRD4)的表达增加。因此,具有这些突变的肿瘤可能易于用溴结构域抑制剂治疗,其中一些正在开发中。具有MYCN扩增的脑干胶质瘤子集也可能对溴结构域抑制敏感。
另一方面,具有IDH突变的脑干胶质瘤可能对低甲基化剂有反应,例如5-氮杂胞苷和地西他滨,这两种药物都被FDA批准用于骨髓增生异常综合征。虽然尚未通过临床试验证实,至少三个临床前研究已经证明DNA去甲基化剂上的治疗效果IDH1 -mutant肿瘤细胞系。在这些研究之一中,将5-氮杂胞苷腹膜内施用于携带来自IDH1- 突变间变性星形细胞瘤样品的皮下异种移植物的裸鼠。在第14周,在5-氮杂胞苷处理的小鼠中观察到肿瘤消退,与对照小鼠形成鲜明对比。最近的一项研究概述了IDH突变胶质瘤发病机制中的一种新机制:DNA内绝缘子蛋白结合位点的甲基化,导致PDGFRA启动子与远端增强子元件异常接触,导致PDGFRA(一种已知的胶质瘤癌基因)过度表达。体外治疗IDH1 - 具有5-氮杂胞苷的突变BT142胶质瘤球使绝缘子蛋白结合位点的甲基化减少约2.5倍并且下调PDGFRA表达5倍。需要进行I期药代动力学/药效学试验以证实DNA低甲基化药物如5-氮杂胞苷和地西他滨在治疗浓度下到达中枢神经系统内的肿瘤的能力。
AG-120(一种突变型IDH1的口服抑制剂)的I期试验表明,20例IDH1突变型胶质瘤患者中有10例病情稳定,6个月的临床受益反应率为25%。正在进行进一步测试。已经在成人脑干神经胶质瘤中报道的其他突变,例如PDGFRA,PIK3CA和PPM1D的突变,也可以用已经商业化或正在开发的药物靶向。
将基因组数据纳入治疗策略 - 一些被称为“精准医学”的方法 - 也面临着重大挑战。为了实现这一战略,获得肿瘤组织进行基因组分析是一个先决条件。虽然在脑干上进行操作需要极大的专业知识和关注,但神经外科医生目前可以操作的精确度,加上基因组分析的组织需求减少,使得在标准基础上获得组织现在是更合理的选择。
采用精准医学方法的另一个挑战是如何将这种策略纳入传统的临床试验框架。采用这种方法,DIPG儿科患者的临床试验 - 仍在进行,但未招募 - 使用EGFR和MGMT启动子甲基化检测的结果来确定患者是否接受替莫唑胺和/或厄洛替尼以及贝伐单抗和照射。不幸的是,成人脑干胶质瘤的发病率可能太低,不适合进行小规模试验。然而,患有脑干胶质瘤的成人仍然可以作为临床试验的候选者,作为所谓的“篮子”试验的参与者,其通过分子改变对患者进行分层,而不管肿瘤组织学如何。例如,携带BRAF V600E突变的复发性脑干胶质瘤成人可能有资格参加最近发起的NCI-MATCH研究,其中包括BRAF V600E肿瘤患者的手臂突变接受dabrafenib和trametinib的组合。患者还可以寻求在临床试验框架之外对其肿瘤组织进行基因组分析。在这些情况下,患者必须明白使用此类数据来指导管理是一种尚未经过验证的治疗策略,虽然可能会有所改善。
免疫疗法也可能有一天在成人脑干神经胶质瘤的治疗中发挥作用。成人恶性胶质瘤的疫苗试验已经进行了十多年,但直到最近,这些试验通常要求患者进行总切除或接近总切除,这使得患有脑干胶质瘤的患者无法参与。然而,最近,一些疫苗试验已经开始允许具有显着残留疾病的患者参与。使用自体肿瘤裂解物制造的疫苗通常需要比脑干胶质瘤患者更多的组织。然而,利用肿瘤相关肽的试验通常具有更少限制性的组织要求。
阻断PD1,PDL1和CTLA4等靶标的免疫检查点抑制剂最近在一系列晚期恶性肿瘤中表现出令人印象深刻的活性。这些疗法尚未评估脑干胶质瘤,尽管兴趣很高。
结论
因为成人脑干胶质瘤是临床和组织学实体的集合,个体患者治疗取决于症状,表现状态,年龄,组织学,分子病理学和新治疗研究的可用性。IDH和组蛋白突变是相对较新的发现,现在才被引入即将进行的儿科研究中; 在选定的成年患者群体中正在进行回顾性分析。鉴于分子分类,表观遗传学和癌症治疗领域的快速发展,我们很可能在未来十年内在这方面取得重大进展,从而为儿科和成人DIPG以及更大的脑干肿瘤组。目前,我们明智地活检/切除我们认为安全的患者,以便进行症状控制和分子检测预后,以及参加通常需要组织诊断和突变状态的治疗研究(例如,IDH1 / 2突变,BRAF突变) ,组蛋白3突变)。辐射和替莫唑胺通常在前期使用,并且通常在复发时提供再辐射。我们对成人脑干胶质瘤的发病机制仍有很多了解,但一方面对儿科DIPG和另一方面成人非脑干胶质瘤的具有里程碑意义的研究可能具有相当程度的相关性。随着我们对成人脑干胶质瘤的了解增加,肯定会有更好的治疗方法。