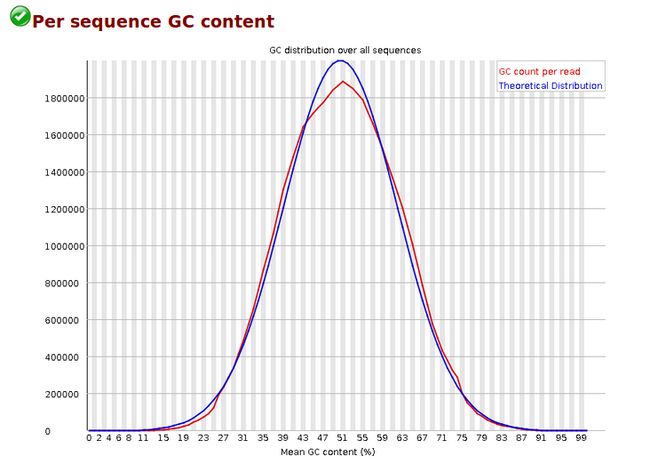
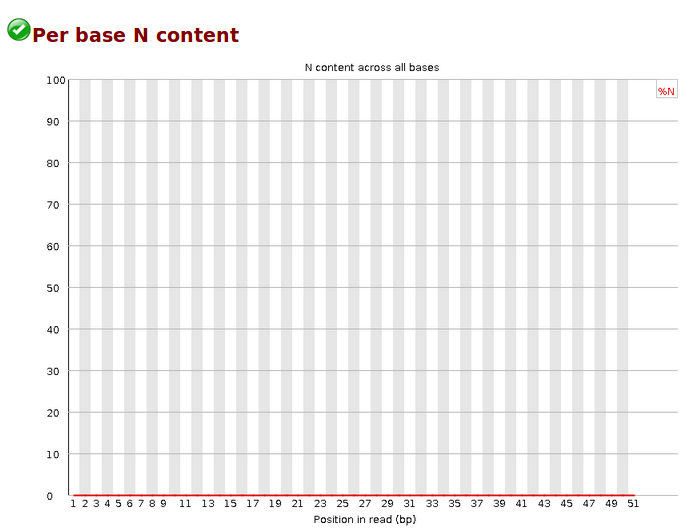
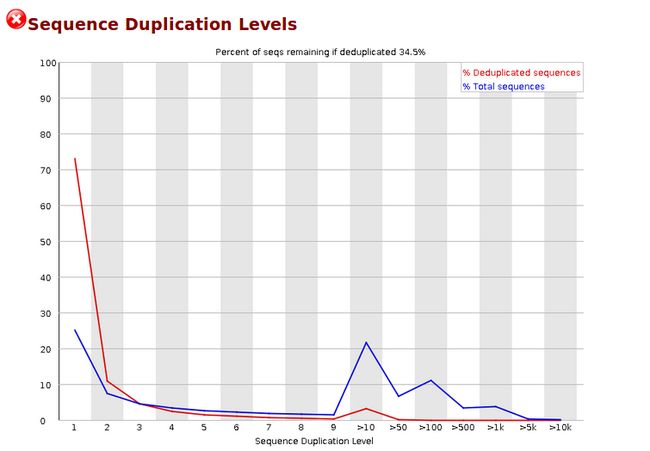
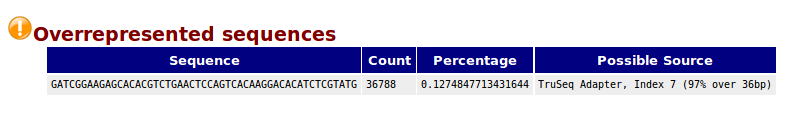
- 黑客?设计师?
二十年前,最好的程序员是一个能够将整个应用程序拟合到64KB的.COM文件,那些能够将小的可怜的80386玩转到极致的人就是当时的编程大师。那是因为在二十年前电脑非常昂贵而编程极其廉价。那是真正的“黑客精神”的时代。那个时代已经终结。由于市场的完完全全的本末倒置,在今天黑客精神再无生存之地。今天,电脑越发廉价,设计师日益珍贵。当代码可读性的远比其性能重要的时候,“开发者精神”的末日已然来临。价格V
- 《翻转课堂与微课程教学法》学习心得 4组11号 孙娜
4组11号孙娜
读完《翻转课堂与微课程教学法》这本书让我对为何要进行翻转课堂,以及如何进行有了一些了解,教学观念和思想有了一种新的认识。对翻转课堂和微课程早有耳闻,也或多或少地在网络上进行过一些查阅,但都是一些零碎的、浅尝辄止的了解,现在静下心来读这本系统的著作,使我对翻转课堂和微课程有了更清晰的认识。这本书共分为上、下两部分,上篇主要是翻转课堂的相关理论和目前翻转课堂进行的一些案例,后半部主要介绍如何实施翻转课
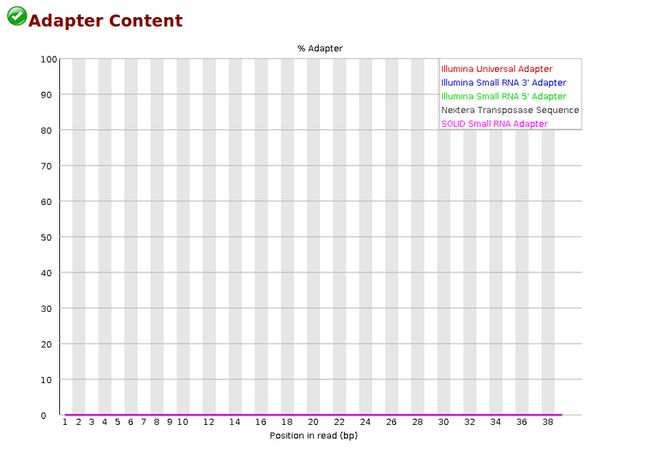
- MYOJ_8515:CSP初赛题单4:计算机软件
Jayfeather松鸦羽_sch
CSP初赛题目算法c++
更多初赛题单请参见题目整理CSP初赛题目整理题单,谢谢。题目描述1.[J-2015-3]操作系统的作用是()。A.把源程序译成目标程序B.便于进行数据管理C.控制和管理系统资源D.实现硬件之间的连接答案:C解析:操作系统(OperatingSystem,简称OS)是管理计算机硬件与软件资源的系统软件,其主要功能包括:处理器管理(CPU调度)内存管理(分配和回收内存)设备管理(管理输入/输出设备)文
- 在 Conda 中删除环境及所有安装的库
Studying 开龙wu
conda
注意事项1.删除环境前确保你没有在该环境中运行任何程序。2.删除操作是不可逆的,所有该环境中的包和配置都会被永久删除。3.如果你想保留环境的配置信息,可以在删除前使用condaenvexport>environment.yml导出环境配置。关于requirements.txt和environment.yaml文件使用介绍详情可参考以往文章,争对机器学习和深度学习里Python项目开发管理项目依赖的
- 2023-03-22
小郭不会打篮球
3.21笔记一、定位作用:显示定在所有其他元素之上、可以让元素在浏览器中任意位置。a标准流块级元素独占一行→垂直布局行内元素/行内块元素一行显示多个→水平布局b浮动可以让原本垂直布局的块级元素变成水平布局c定位可以让元素自由的摆放在网页的任意位置一般用于盒子之间的层叠情况1、属性名:position静态定位:static相对定位:relative绝对定位:absolute固定定位:fixed向下移
- ZooKeeper学习专栏(三):ACL权限控制与Zab协议核心原理
文章目录前言一、ACL访问控制列表二、原子广播协议(Zab协议)总结前言在分布式系统中,安全访问控制和一致性保证是两大核心需求。本文将深入探讨Zookeeper的ACL权限控制机制和Zab协议的核心原理,帮助读者理解Zookeeper如何保障数据安全性和系统一致性。一、ACL访问控制列表ACL(AccessControlLists)是Zookeeper保护ZNode数据安全的关键机制,它定义了哪些
- You have a Server Component that imports next/router. Use next/navigation instead
啃火龙果的兔子
网络
解决Next.js13+中“Usenext/navigationinsteadofnext/router”的问题在Next.js13及更高版本中,AppRouter引入了新的导航系统,需要使用next/navigation替代传统的next/router。以下是完整的解决方案:1.理解新旧路由的区别特性next/router(PagesRouter)next/navigation(AppRoute
- 宝妈在家做什么能赚钱?适合宝妈在家做的分享优惠券赚钱方法(附具体操作方式)
高省APP大九
作为一位宝妈,如何在照顾家庭的同时还能有所收入,成为了许多人的难题。而微信羊毛群则为宝妈们提供了一个在家创业的好机会。通过参与羊毛群活动,宝妈们可以利用闲暇时间获取优惠券和折扣信息,然后分享给朋友和亲人,实现赚钱的目的。本文将介绍如何利用高省APP在微信羊毛群中赚钱的方法。一、了解微信羊毛群微信羊毛群是一种以分享优惠券和折扣信息为主的社交群体。群主通常会与商家合作,发布一些带有优惠券和折扣的商品信
- Rovo Dev CLI Windows 安装与使用指南
执剑走天涯xp
windows
RovoDevCLIWindows安装与使用指南(修订版)前提条件与准备工作1.Atlassian账号注册访问注册页面:AtlassianAIInnovation注册这里我使用的是Google账号登录2.安装必备软件Git(必需组件)GitforWindows官方下载VisualStudioCode(推荐终端环境)VSCode官方下载3.管理员启用RovoDevAgents需组织管理员在Atlas
- 在 Ubuntu 中配置 Samba 实现「特定用户可写,其他用户只读」的共享目录
执剑走天涯xp
ubuntuwindows网络
需求目标所有认证用户可访问Samba共享目录/path/to/home;**仅特定用户(如developer)**拥有写权限;其他用户仅允许读取;禁止匿名访问。配置步骤1.设置文件系统权限将目录/home3/guest的所有权设为developer用户和所属组,并设置权限:sudochown-Rdeveloper:developer/path/to/homesudochmod-R755/path/
- next.js 如何实现动态路由?
在Next.js12中,动态路由和参数传递主要通过文件系统路由(File-systemRouting)实现。以下是详细步骤和示例:一、创建动态路由文件命名规则在pages目录下创建文件名用[参数名].js格式的文件,例如:pages/posts/[id].js//单个参数pages/[category]/[id].js//多段参数匹配的URL示例/posts/123→id:'123'/ne
- 【laravel+redis】分布式锁的实现
起灵人
phplaravelredislaravelredisphp
laravel官方支持“原子锁”,并且说“要使用这个功能,应用必须使用memcached、dynamodb、redis、database或array缓存驱动作为应用默认的缓存驱动,此外,所有服务器必须和同一台中央缓存服务器进行通信”。前半句不多解释,后半句也强调了laravel的原子锁不负责在集群架构中保障故障转移期间的数据安全性。我贴一下laravel的源码看一下它是怎样用redis实现的分布式
- 渭南7家正规亲子鉴定中心办理地址大全(附2024年鉴定攻略)
国医基因周主任
渭南市不仅以其独特的地理风貌和丰富的文化传统著称,也因其提供的亲子鉴定服务而受到广泛关注。为了协助市民和家庭找到值得信赖的亲子鉴定中心,我们特别搜集并整理了2024年渭南市7家正规亲子鉴定中心的详细地址,并提供了一份实用的鉴定指南。以下是对这些中心的全面介绍和相关攻略。渭南7家正规亲子鉴定中心办理地址大全1、渭南市国医基因亲子鉴定中心渭南市亲子鉴定中心地址:渭南市临渭区胜利大街35号咨询范围:个人
- 【一张图背论语】Day 029| 为政第二 | 2.13 子贡问君子
Heger_四维脑图
子贡问君子。子曰:“先行其言而后从之。”子贡问怎样才能做一个君子。孔子说:对于你要说的话,先实行了,然后说出来。在孔子的弟子中,子贡在“言语”一科中,这也说明了子贡本人在言辞方面是比较擅长的。子贡虽然善辩,但是也有言多失礼的地方。孔子在此处的这番言论,意在教育子贡,说得再好都不如做得好更让人信服,这也是孔子“因材施教”的典例。
- 计算机毕业设计Python+uniapp校园兼职系统小程序(小程序+源码+LW)
Python毕设源码程序高学长
python课程设计uni-app
计算机毕业设计Python+uniapp校园兼职系统小程序(小程序+源码+LW)该项目含有源码、文档、程序、数据库、配套开发软件、软件安装教程项目运行环境配置:Pychram社区版+python3.7.7+Mysql5.7+uni+HBuilderX+listpip+Navicat11+Django+nodejs。项目技术:django+python+UNI等等组成,B/S模式+pychram管理
- Python-Django毕业设计养老院老人日常生活管理系统(程序+Lw)
Python计算机毕设程序源码_
pythondjango课程设计
该项目含有源码、文档、程序、数据库、配套开发软件、软件安装教程项目运行环境配置:Pychram社区版+python3.7.7+Mysql5.7+HBuilderX+listpip+Navicat11+Django+nodejs。项目技术:django+python+Vue等等组成,B/S模式+pychram管理等等。环境需要1.运行环境:最好是python3.7.7,我们在这个版本上开发的。其他版
- Java程序设计笔记
是程序蜂啊
java笔记开发语言
Java程序设计目录Java程序设计第一章java语言开发环境1.1工具篇1.2Eclipse调整字体第三章Java基础3.1java基本数据类型3.2关键字与标识符3.3常数3.4变量3.5.数据类型转换3.6由键盘输入数据4.1顺序结构4.2分支语句5.1什么是数组5.2数组赋值:5.3一维数组5.4二维数组6.1类的基本概念6.2定义类6.3对象的创建与使用6.4参数的传递第七章java语言
- 《缱绻天堂》:第3集:时间尽头
郭星池
第3集:时间尽头三个小时之前,我接到囧三的电话,他在信号那端哭得像个傻狗,我气急败坏。他抽抽噎噎老半天才说清楚——你没了。什么叫没了?没了就是死了…不存在了…永远消失了…你个傻货!囧三哭得更凶了,他在电话那头不停的骂着,我下意识回了句:你他妈才傻货!然后就什么也听不见了,脑子里只剩下那句——没了就是死了,永远消失了……我忘了自己到底有多久没哭过了,15年了,我仍然记得那个夏天,在那个偏僻的小城里,
- 1.1分钟了解Jocelynapp不让提出曝光!别再被洗脑了赶紧止损
最新曝光29
1.JocelynAPP在平台不能提现怎么办?2.JocelynAPP这个软件靠谱可信吗?3.JocelynAPP在软件做任务被骗?4.JocelynAPP软件app无法登录?5.JocelynAPP平台是真的吗?6.JocelynAPP被骗无法提现,操作失误!7.JocelynAPP平台是騙局吗?8.JocelynAPP被骗无法出金如何维护自己的合法权益!希望看到这篇文章的人可以及时止损;请及时
- [C/C++安全编程]_[中级]_[如何实现不可变变量]
Peter(阿斯拉达)
C/C++安全编程constconstexprrust不可变变量C++
场景在Rust里有不可变变量,不可变变量可以保证编译器内存安全,禁止数据竞争;并且不可变可以安全的跨线程共享,无需锁。那么C/C++对象有这种不可变变量吗?说明首先说下简单类型是可以通过const来修饰不可变特性的。对象类型结构的不可变特性。先说C肯定是没有的,C的结构体都是public结构,想要让成员不可变,只能通过const来修饰成员变量,但是如果修饰了,也不能改了,虽然可以通过const_c
- 预售工作一周小结
小西FineYoga梵音瑜伽
12-13号两天的培训,我清晰了解了梵音的整个发展历程;更清晰预售工作性质以及如何更好的做好预售工作;信息量之大,跨度广,我吸收并不多,希望多跟几次教授的培训,会有不一样的启发!教授是个非常有魅力的天生演讲者,风趣幽默,肢体语言表情丰富,特别有感染力。有着独到的眼光和超强的学习能力,他会从各行各业中取其精华去其糟粕,从每一期预售中不停的去总结,分析,判断,不停优化预售方案14号开始由李白店长带领我
- Javascript 平行四边形周长计算程序(Program for Circumference of a Parallelogram)
给定平行四边形的边,计算周长。示例:输入:a=10,b=8输出:36.00输入:a=25.12,b=20.4输出:91.04平行四边形的对边长度相等且平行。两角相等,但不一定为90度。平行四边形的周长可以计算为两条相邻边之和,每条边乘以2。计算平行四边形周长的公式:(2*a)+(2*b)//JavascriptProgramtocalculatethe//CircumferenceofaParal
- 使用 .NET 6.0 的简单 WebSocket 客户端和服务器应用程序
几个月前,有同事来找我,问能否用.NET创建一个简单的WebSocket服务器(以及之后的客户端)。据我了解,他想用它来控制对方电脑上的进程。或许对其他人也有用,所以我把它发布在这里。让我们从服务器开始。我这里使用的是.NET6和ASP.NETCore,不需要任何额外的配置。它实际上是一个准系统应用程序,没有任何花哨的附加功能。Console.Title="Server";varbuilder=W
- Supervisor 入门指南一篇就够 —— 安装、项目配置与常见报错速查
逻极
python开发工具笔记python运维工具开发supervisor
Supervisor入门指南一篇就够——安装、项目配置与常见报错速查一、Supervisor是什么在服务器进程管理中,Supervisor是一款用Python编写的进程守护与管理工具。它的核心功能是将普通的命令行进程转变为后台daemon进程,并且在进程因意外情况退出时,能够自动将其重启,保证进程的持续运行。在实际应用中,它常出现在多层架构里。比如在Nginx→Gunicorn/Django→Su
- 日本公然挑衅,排放核污水,如何救济
高手秘笈
从未有过如此厚颜无耻之国,日本政府竟然可以无视自身责任,毫无负担地将一切不利后果转嫁给全世界。日本NHK新闻网站曾在2021年指责苏联处理切尔诺贝利核电事故,没有采取任何措施处理废弃核反应堆,严重影响当地生态环境。然而,到了2023年8月24日12点,日本政府全然不顾全世界人民与国家反对,正式向太平洋排放大量核污水,预计核污染水排放量为200到210吨,之后每天排放情况将于次日公布。首次排海每天将
- 什么是Java?想学习却不知道从哪开始?
不熬夜不是好程序员
谈起Java,相信有很多小伙伴们也跟我刚开始一样,对他的了解只有难,学成之后工资高,从入门学到入土,但当你真正开始系统的学习之后才发现其实哪些程序猿们也不过尔尔(刚学习完刚入职那种。。。)什么是Java?Java是一门编程语言,Java是一门掌握了技术就可以拿到高薪的工作岗位。Java这个语言在我国发展的很完善,相当于你掌握了Java技术出来,具备一定的开发经验,既可以在一线城市找到合适的岗位工作
- Unreal Engine开发:Unreal Engine基础入门_C++编程基础v1
chenlz2007
游戏开发虚幻c++javaunity游戏引擎交互lucene
C++编程基础在开始学习UnrealEngine之前,掌握C++编程基础是非常重要的。C++是一种强大的面向对象编程语言,广泛应用于游戏开发、系统软件开发等领域。本节将介绍C++的基本概念、语法和一些常用的功能,为后续的UnrealEngine开发打下坚实的基础。1.C++简介C++是一种静态类型的、编译式的、通用的、中级到高级的编程语言,它支持多种编程范式,包括面向对象编程、泛型编程和过程化编程
- 头条搜索极速版邀请码是多少-2024头条搜索极速版邀请码怎么填写
熊熊福利
头条搜索极速版邀请码是多少呢?拉到文章末尾就可以看到!在文章的结尾可以看到头条搜索极速版邀请码是多少。头条搜索极速版邀请码怎么填写第1步首先打开【头条搜索极速版】客户端,然后点击右下角底部【我的】第2步接着点击去领钱,任务栏里面找到【填写邀请码】右侧的【去填写】第3步再输入邀请码,最后点击【立即领取】即可。2024年头条搜索极速版为了回馈广大用户朋友的支持和厚爱,特推出邀请好友填写邀请码来获得一系
- 失业程序员的逆袭:从代码渣到百万架构师
金牌学霸
就业规划人生规划职业规划能源软件开发职场和发展职业规划就业指导
职业规划分析:30岁离异失业程序员的重启之路核心优势分析:技术根基扎实:211计算机本科+多年开发经验(假设5年+)行业适配性强:IT领域存在大量技术迁移机会危机意识觉醒:失业状态激发转型动力关键挑战:年龄焦虑(30+求职竞争)职业空白期解释技术更新迭代压力分阶段职业发展路径(3年规划)阶段时间核心目标具体行动方案重启期1-3个月快速就业+心理建设-主攻中大型企业维护型岗位-每天4小时LeetCo
- 李和我 学神百日培养计划学习打卡第14天20210928
玫瑰之梦
今天继续阅读《学习的格局》。今天的小收获:一、有效提升时间观念和学习效率的七个方法1.尽早养成做计划的好习惯。2.用有趣的方式和孩子讨论时间。3.关注点放在时间管理训练上。4.定期整理练习物品归类。5.做好时间规划,利用试、听小工具。6.放手让孩子学习设定目标及优先次序7.学会准确预估时间,制定中长期学习计划。二、克服重度作业拖延症的五大招1.用好生物钟效应,建立有序健康的时间管理观念。2.列出时
- Java开发中,spring mvc 的线程怎么调用?
小麦麦子
springmvc
今天逛知乎,看到最近很多人都在问spring mvc 的线程http://www.maiziedu.com/course/java/ 的启动问题,觉得挺有意思的,那哥们儿问的也听仔细,下面的回答也很详尽,分享出来,希望遇对遇到类似问题的Java开发程序猿有所帮助。
问题:
在用spring mvc架构的网站上,设一线程在虚拟机启动时运行,线程里有一全局
- maven依赖范围
bitcarter
maven
1.test 测试的时候才会依赖,编译和打包不依赖,如junit不被打包
2.compile 只有编译和打包时才会依赖
3.provided 编译和测试的时候依赖,打包不依赖,如:tomcat的一些公用jar包
4.runtime 运行时依赖,编译不依赖
5.默认compile
依赖范围compile是支持传递的,test不支持传递
1.传递的意思是项目A,引用
- Jaxb org.xml.sax.saxparseexception : premature end of file
darrenzhu
xmlprematureJAXB
如果在使用JAXB把xml文件unmarshal成vo(XSD自动生成的vo)时碰到如下错误:
org.xml.sax.saxparseexception : premature end of file
很有可能时你直接读取文件为inputstream,然后将inputstream作为构建unmarshal需要的source参数。InputSource inputSource = new In
- CSS Specificity
周凡杨
html权重Specificitycss
有时候对于页面元素设置了样式,可为什么页面的显示没有匹配上呢? because specificity
CSS 的选择符是有权重的,当不同的选择符的样式设置有冲突时,浏览器会采用权重高的选择符设置的样式。
规则:
HTML标签的权重是1
Class 的权重是10
Id 的权重是100
- java与servlet
g21121
servlet
servlet 搞java web开发的人一定不会陌生,而且大家还会时常用到它。
下面是java官方网站上对servlet的介绍: java官网对于servlet的解释 写道
Java Servlet Technology Overview Servlets are the Java platform technology of choice for extending and enha
- eclipse中安装maven插件
510888780
eclipsemaven
1.首先去官网下载 Maven:
http://www.apache.org/dyn/closer.cgi/maven/binaries/apache-maven-3.2.3-bin.tar.gz
下载完成之后将其解压,
我将解压后的文件夹:apache-maven-3.2.3,
并将它放在 D:\tools目录下,
即 maven 最终的路径是:D:\tools\apache-mave
- jpa@OneToOne关联关系
布衣凌宇
jpa
Nruser里的pruserid关联到Pruser的主键id,实现对一个表的增删改,另一个表的数据随之增删改。
Nruser实体类
//*****************************************************************
@Entity
@Table(name="nruser")
@DynamicInsert @Dynam
- 我的spring学习笔记11-Spring中关于声明式事务的配置
aijuans
spring事务配置
这两天学到事务管理这一块,结合到之前的terasoluna框架,觉得书本上讲的还是简单阿。我就把我从书本上学到的再结合实际的项目以及网上看到的一些内容,对声明式事务管理做个整理吧。我看得Spring in Action第二版中只提到了用TransactionProxyFactoryBean和<tx:advice/>,定义注释驱动这三种,我承认后两种的内容很好,很强大。但是实际的项目当中
- java 动态代理简单实现
antlove
javahandlerproxydynamicservice
dynamicproxy.service.HelloService
package dynamicproxy.service;
public interface HelloService {
public void sayHello();
}
dynamicproxy.service.impl.HelloServiceImpl
package dynamicp
- JDBC连接数据库
百合不是茶
JDBC编程JAVA操作oracle数据库
如果我们要想连接oracle公司的数据库,就要首先下载oralce公司的驱动程序,将这个驱动程序的jar包导入到我们工程中;
JDBC链接数据库的代码和固定写法;
1,加载oracle数据库的驱动;
&nb
- 单例模式中的多线程分析
bijian1013
javathread多线程java多线程
谈到单例模式,我们立马会想到饿汉式和懒汉式加载,所谓饿汉式就是在创建类时就创建好了实例,懒汉式在获取实例时才去创建实例,即延迟加载。
饿汉式:
package com.bijian.study;
public class Singleton {
private Singleton() {
}
// 注意这是private 只供内部调用
private static
- javascript读取和修改原型特别需要注意原型的读写不具有对等性
bijian1013
JavaScriptprototype
对于从原型对象继承而来的成员,其读和写具有内在的不对等性。比如有一个对象A,假设它的原型对象是B,B的原型对象是null。如果我们需要读取A对象的name属性值,那么JS会优先在A中查找,如果找到了name属性那么就返回;如果A中没有name属性,那么就到原型B中查找name,如果找到了就返回;如果原型B中也没有
- 【持久化框架MyBatis3六】MyBatis3集成第三方DataSource
bit1129
dataSource
MyBatis内置了数据源的支持,如:
<environments default="development">
<environment id="development">
<transactionManager type="JDBC" />
<data
- 我程序中用到的urldecode和base64decode,MD5
bitcarter
cMD5base64decodeurldecode
这里是base64decode和urldecode,Md5在附件中。因为我是在后台所以需要解码:
string Base64Decode(const char* Data,int DataByte,int& OutByte)
{
//解码表
const char DecodeTable[] =
{
0, 0, 0, 0, 0, 0
- 腾讯资深运维专家周小军:QQ与微信架构的惊天秘密
ronin47
社交领域一直是互联网创业的大热门,从PC到移动端,从OICQ、MSN到QQ。到了移动互联网时代,社交领域应用开始彻底爆发,直奔黄金期。腾讯在过去几年里,社交平台更是火到爆,QQ和微信坐拥几亿的粉丝,QQ空间和朋友圈各种刷屏,写心得,晒照片,秀视频,那么谁来为企鹅保驾护航呢?支撑QQ和微信海量数据背后的架构又有哪些惊天内幕呢?本期大讲堂的内容来自今年2月份ChinaUnix对腾讯社交网络运营服务中心
- java-69-旋转数组的最小元素。把一个数组最开始的若干个元素搬到数组的末尾,我们称之为数组的旋转。输入一个排好序的数组的一个旋转,输出旋转数组的最小元素
bylijinnan
java
public class MinOfShiftedArray {
/**
* Q69 旋转数组的最小元素
* 把一个数组最开始的若干个元素搬到数组的末尾,我们称之为数组的旋转。输入一个排好序的数组的一个旋转,输出旋转数组的最小元素。
* 例如数组{3, 4, 5, 1, 2}为{1, 2, 3, 4, 5}的一个旋转,该数组的最小值为1。
*/
publ
- 看博客,应该是有方向的
Cb123456
反省看博客
看博客,应该是有方向的:
我现在就复习以前的,在补补以前不会的,现在还不会的,同时完善完善项目,也看看别人的博客.
我刚突然想到的:
1.应该看计算机组成原理,数据结构,一些算法,还有关于android,java的。
2.对于我,也快大四了,看一些职业规划的,以及一些学习的经验,看看别人的工作总结的.
为什么要写
- [开源与商业]做开源项目的人生活上一定要朴素,尽量减少对官方和商业体系的依赖
comsci
开源项目
为什么这样说呢? 因为科学和技术的发展有时候需要一个平缓和长期的积累过程,但是行政和商业体系本身充满各种不稳定性和不确定性,如果你希望长期从事某个科研项目,但是却又必须依赖于某种行政和商业体系,那其中的过程必定充满各种风险。。。
所以,为避免这种不确定性风险,我
- 一个 sql优化 ([精华] 一个查询优化的分析调整全过程!很值得一看 )
cwqcwqmax9
sql
见 http://www.itpub.net/forum.php?mod=viewthread&tid=239011
Web翻页优化实例
提交时间: 2004-6-18 15:37:49 回复 发消息
环境:
Linux ve
- Hibernat and Ibatis
dashuaifu
Hibernateibatis
Hibernate VS iBATIS 简介 Hibernate 是当前最流行的O/R mapping框架,当前版本是3.05。它出身于sf.net,现在已经成为Jboss的一部分了 iBATIS 是另外一种优秀的O/R mapping框架,当前版本是2.0。目前属于apache的一个子项目了。 相对Hibernate“O/R”而言,iBATIS 是一种“Sql Mappi
- 备份MYSQL脚本
dcj3sjt126com
mysql
#!/bin/sh
# this shell to backup mysql
#
[email protected] (QQ:1413161683 DuChengJiu)
_dbDir=/var/lib/mysql/
_today=`date +%w`
_bakDir=/usr/backup/$_today
[ ! -d $_bakDir ] && mkdir -p
- iOS第三方开源库的吐槽和备忘
dcj3sjt126com
ios
转自
ibireme的博客 做iOS开发总会接触到一些第三方库,这里整理一下,做一些吐槽。 目前比较活跃的社区仍旧是Github,除此以外也有一些不错的库散落在Google Code、SourceForge等地方。由于Github社区太过主流,这里主要介绍一下Github里面流行的iOS库。 首先整理了一份
Github上排名靠
- html wlwmanifest.xml
eoems
htmlxml
所谓优化wp_head()就是把从wp_head中移除不需要元素,同时也可以加快速度。
步骤:
加入到function.php
remove_action('wp_head', 'wp_generator');
//wp-generator移除wordpress的版本号,本身blog的版本号没什么意义,但是如果让恶意玩家看到,可能会用官网公布的漏洞攻击blog
remov
- 浅谈Java定时器发展
hacksin
java并发timer定时器
java在jdk1.3中推出了定时器类Timer,而后在jdk1.5后由Dou Lea从新开发出了支持多线程的ScheduleThreadPoolExecutor,从后者的表现来看,可以考虑完全替代Timer了。
Timer与ScheduleThreadPoolExecutor对比:
1.
Timer始于jdk1.3,其原理是利用一个TimerTask数组当作队列
- 移动端页面侧边导航滑入效果
ini
jqueryWebhtml5cssjavascirpt
效果体验:http://hovertree.com/texiao/mobile/2.htm可以使用移动设备浏览器查看效果。效果使用到jquery-2.1.4.min.js,该版本的jQuery库是用于支持HTML5的浏览器上,不再兼容IE8以前的浏览器,现在移动端浏览器一般都支持HTML5,所以使用该jQuery没问题。HTML文件代码:
<!DOCTYPE html>
<h
- AspectJ+Javasist记录日志
kane_xie
aspectjjavasist
在项目中碰到这样一个需求,对一个服务类的每一个方法,在方法开始和结束的时候分别记录一条日志,内容包括方法名,参数名+参数值以及方法执行的时间。
@Override
public String get(String key) {
// long start = System.currentTimeMillis();
// System.out.println("Be
- redis学习笔记
MJC410621
redisNoSQL
1)nosql数据库主要由以下特点:非关系型的、分布式的、开源的、水平可扩展的。
1,处理超大量的数据
2,运行在便宜的PC服务器集群上,
3,击碎了性能瓶颈。
1)对数据高并发读写。
2)对海量数据的高效率存储和访问。
3)对数据的高扩展性和高可用性。
redis支持的类型:
Sring 类型
set name lijie
get name lijie
set na
- 使用redis实现分布式锁
qifeifei
在多节点的系统中,如何实现分布式锁机制,其中用redis来实现是很好的方法之一,我们先来看一下jedis包中,有个类名BinaryJedis,它有个方法如下:
public Long setnx(final byte[] key, final byte[] value) {
checkIsInMulti();
client.setnx(key, value);
ret
- BI并非万能,中层业务管理报表要另辟蹊径
张老师的菜
大数据BI商业智能信息化
BI是商业智能的缩写,是可以帮助企业做出明智的业务经营决策的工具,其数据来源于各个业务系统,如ERP、CRM、SCM、进销存、HER、OA等。
BI系统不同于传统的管理信息系统,他号称是一个整体应用的解决方案,是融入管理思想的强大系统:有着系统整体的设计思想,支持对所有
- 安装rvm后出现rvm not a function 或者ruby -v后提示没安装ruby的问题
wudixiaotie
function
1.在~/.bashrc最后加入
[[ -s "$HOME/.rvm/scripts/rvm" ]] && source "$HOME/.rvm/scripts/rvm"
2.重新启动terminal输入:
rvm use ruby-2.2.1 --default
把当前安装的ruby版本设为默