文献DOI:10.1016/j.bbrc.2005.05.119
文献PMID:15950945
文献原文链接:https://sci-hub.se/10.1016/j.bbrc.2005.05.119
alpha-Lipoic acid supplementation inhibits oxidative damage, accelerating chronic wound healing in patients undergoing hyperbaric oxygen therapy
α-硫辛酸补充剂可抑制氧化损伤,加速高压氧治疗患者的慢性伤口愈合
文章摘要:
高压氧(HBO)疗法成功用于治疗各种病症。 然而,长时间暴露于高浓度的氧会引起活性氧的产生,从而导致细胞受损。 因此,已提出抗氧化剂补充剂作为佐剂以减弱这种有害的继发效应。 我们评估了α-硫辛酸(LA)对接受HBO治疗的慢性伤口患者的影响。 LA补充剂有效地减少了由氧气暴露引起的脂质和DNA氧化。 LA通过直接与自由基相互作用或通过回收维生素E发挥其抗氧化活性。观察到LA对促炎细胞因子白细胞介素-6的抑制作用。 总之,我们证实了LA在用于伤口愈合受损治疗的HBO治疗中的辅助作用。 我们建议LA可用于进一步促进HBO治疗的有益效果。
全文翻译:
高压氧(HBO)治疗涉及在大于绝对大气压(ATA)的压力下间歇地吸入100%的氧气。 HBO已经建立了各种治疗用途,包括减压病、一氧化碳中毒、空气栓塞、软组织感染和有问题的软组织缺损[1,2]。特别是,高压氧治疗是治疗伤口愈合受损的一种治疗方法。在增加的压力下吸入纯氧决定了血液中氧分压(pO2)的强烈增加,这对于向组织细胞供应氧气是重要的。愈合效果是由于氧气梯度的局部增加导致灌注减少区域的氧气分解率增加,导致血管生成增加,生长因子刺激增加[3-5],并增加局部对感染的抵抗力[ 6,7]。由于其有益的作用,HBO疗法已广泛应用于治疗慢性不愈合伤口[8]。 HBO有助于糖尿病溃疡的愈合[9-12],当重建手术不可行时,它是一种有价值的辅助治疗[9]。尽管在治疗慢性伤口方面获得了非常有希望的临床结果,但暴露于高浓度氧气会导致体内活性氧(ROS)的增加[13]。当抗氧化防御效果不佳时,增加的自由基形成可能会加剧损害。据记载,HBO疗法通过氧化脂质、蛋白质和DNA引起细胞损伤[13-15]。因此,已经提出抗氧化剂补充剂作为辅助剂以减弱氧暴露的有害次级效应。
α-硫辛酸(LA)及其还原形式二氢硫辛酸以其生物抗氧化活性而闻名[16,17]。 LA作为ROS的清除剂,与其他抗氧化剂如抗坏血酸、维生素E和谷胱甘肽(GSH)相互作用,促进其再生[18,19]。由于其抗氧化活性,LA已被证明在各种形式的氧化应激中是有益的,并且作为缺血再灌注损伤、糖尿病并发症、白内障形成、HIV激活、神经退行性疾病和放射性损伤的治疗剂而受到关注[16 ]。
在这里,我们调查了接受HBO治疗的患者LA补充的效果。我们表明,LA通过直接与自由基相互作用发挥其抗氧化活性,从而抵消由氧暴露引起的脂质和DNA氧化,或通过回收维生素E,从而增强血浆的总抗氧化状态。还观察到LA对促炎性细胞因子的抑制作用。因此,我们通过消除不希望的氧暴露的次级效应证明了HBO治疗中伤口愈合受损的LA的辅助效应,这加速了愈合过程。
材料和方法
试剂: α-生育酚、辅酶Q10、低熔点(LMP)琼脂糖和HPLC质量的所有有机溶剂购自Sigma Chemical(St.Louis,MO)。 RPMI培养基和胎牛血清(FBS)获自Euroclone(Euroclone,UK)。 Lymphoprep购自ICN Biomedical(Irvine,UK)。 Formamidopyrimidine glycosylase(Fpg蛋白)是来自英国阿伯丁Rowett研究所的Andrew R. Collins的慷慨赠送。a硫辛酸胶囊(Byodinoral 300)由M.D.M Spa(Milano,Italy)友情提供。
受试者和抗氧化剂补充剂:在获得知情同意后,20名患者(8名男性和12名女性,平均年龄75±12岁)在意大利博洛尼亚的高压治疗中心(MPM)注册。通过HBO治疗的病理学是糖尿病足(n = 1),血管病变(n = 16),无菌性骨坏死(n = 2)和慢性创伤(n = 1)(表1)。
纳入标准是溃疡至少30天的非吸烟者,根据Wagner的糖尿病足<第4阶段,踝压力> 50mmHg,基础血氧测量可变(pTcO2)> 20mmHg。患有其他疾病(炎症,风湿性和内分泌疾病)和药物治疗或抗氧化剂补充的受试者被排除在研究之外。患者双盲随机分为两组,α-硫辛酸组(LA-组)和安慰剂组(PL-组)。在第一次HBO期间,受试者在接触氧气前1小时接受300mg LA(1粒胶囊,Byodinoral 300)或安慰剂(1粒胶囊),并在治疗后立即接受1粒胶囊。然后,患者接受抗氧化剂或安慰剂补充(2粒/天)用于接下来的30次连续HBO治疗(1次/天)。
高压协议:根据常规治疗方案,患者接受30次连续HBO治疗(1次/天)。多室(Sistemi Iperbarici,Ardea,Italy)用压缩空气加压,患者在2.5 ATA的压力下使用面罩呼吸100%O2总共三次25分钟,间隔3分钟呼吸。
采样和淋巴细胞分离:在肝素化管中收集的静脉血样(10ml)在第一次HBO期间之前(T1)和立即从腔室(T2)退出,并且在第20次HBO期间,在(T3)之前和之后HBO治疗之后采集(T4)。将血液样品立即以1000g离心15分钟,并将获得的血浆储存在~80℃下用于后续的生化分析。除去表面涂层,置于15ml Falcon管中,并悬浮于4ml RPMI 1640培养基中。然后将悬浮液分层到4ml Lymphoprep培养基上并在700g(20℃,30分钟)下离心。离心后,收集混浊层并置于15ml Falcon管中,用PBS(pH7.4)填充,并在700g(20℃,5分钟)下离心。除去上清液后,将沉淀重悬于补充有10%FBS的RPMI 1640培养基中,计数细胞并通过台盼蓝排除法评估活力。将等份的5·10 6个细胞储存在~80℃直至进一步使用。为了评估DNA氧化损伤,解冻人淋巴细胞,用20体积的PBS(pH7.4)洗涤、计数,并在开始彗星试验之前确定生存力。
创面临床分析:使用mouse-eye软件(Taylor,USA)、EcoDoppler、oxymetry trans-cute进行创面的临床分析。在开始HBO治疗之前(T0)和之后20(T20)和40(T40)天确定伤口面积。结果表示为T20和T40处伤口面积百分比的变化并且与基础值(T0)相关。
脂质过氧化物测定:通过脂质过氧化物测定试剂盒II(Calbiochem,EMD Biosciences CA,USA)测定脂质过氧化物。该测定基于在酸性条件下氢过氧化物(ROOH)将亚铁离子氧化成三价铁离子。铁离子结合指示剂染料二甲酚橙,形成稳定的复合物,在560 nm处测量吸光度[20]。
总抗氧化能力:根据制造商的方案,使用总抗氧化剂状态(TAS)试剂盒(Randox Laboratories,UK)测定血浆的总抗氧化状态。将2,20-氮杂 - 二 - (3-乙基苯并噻唑啉)(ABTS)与高铁肌红蛋白和过氧化氢一起温育以产生自由基阳离子ABTS +,其是在600nm处可测量的相对稳定的色原体。添加样品中的抗氧化剂会导致ABTS +颜色产生的抑制程度与其浓度成正比[21]。
白细胞介素-6测定:根据制造商的说明书使用人白细胞介素-6(IL-6)酶联免疫试剂盒(EuroClone,UK)测定血浆样品中的IL-6蛋白水平。
彗星试验:使用其他地方描述的单细胞凝胶电泳测定的修改来测量DNA断裂和氧化的嘌呤碱基[22]。简而言之,将淋巴细胞包埋在显微镜载玻片上的LMP琼脂糖中,用Triton X-100和2.5M NaCl裂解以产生类核,并在该溶液中电泳之前用0.3M NaOH加1mM EDTA处理。在电泳过程中,DNA向阳极移动,如果存在断裂,则更为重要。出现在彗星尾部的DNA的相对量(通过Silver Stain Kit,Sigma Chemicals,St.Louis,MO可视化)与DNA断裂频率线性相关。通过包括额外的步骤,该测定法可以用于检测除DNA断裂之外的氧化碱基,其中凝胶中的核仁用修复核酸内切酶消化,所述修饰核酸内切酶特异性用于氧化嘌呤,包括8-氧鸟嘌呤(甲酰胺基嘧啶DNA糖基化酶)。有或没有酶处理的DNA断裂被估计为任意单位(au)。通过从酶孵育的值中减去没有酶孵育(即DNA链断裂)的值来计算氧化的嘌呤碱基。DNA迁移的程度是通过视觉评分来评估的。
研究者:彗星被分类并根据DNA迁移的程度分配到五个类别(0-4)。如在别处所述[22,23],基于彗星外观(即尾长,头部直径和强度)进行分类。每张幻灯片上计数的彗星数为100.每个样本一式两份进行分析,氧化损伤值以任意单位(au)表示。
LA、α-生育酚和辅酶Q10的测定:如前所述,通过HPLC用荧光检测法测定LA含量[24]。简言之,将血浆样品(1ml)用0.2ml 2M HCl酸化,然后加入1.25ml二氯甲烷。将所得混合物涡旋1分钟,并立即在4℃下以4000g离心5分钟以除去蛋白质。然后分离二氯甲烷层并在氮气下蒸发。蒸发后,将残余物用乙腈重构并衍生化。将100微升偶联剂加入100升提取物中。
将混合物在60℃下温育5分钟,然后加入100μl含有碱催化剂的试剂(荧光胺)溶液并再温育30分钟。冷却至室温后,将10μl所得酰胺衍生物注入HPLC系统。使用乙腈/水(80:20)等度洗脱,在C8柱(250·4.6mm,5μm粒径,Beck-man,USA)上分离荧光酰胺,并通过荧光检测(激发343nm,发射423nm) 。基于标准曲线计算血浆LA浓度。
通过与电化学检测器(ED)偶联的HPLC测定α-生育酚和辅酶Q10(还原和氧化形式)血浆含量。将等分试样的血浆样品(50μl)与250μl异丙醇混合,混合1分钟,并以1000g离心3分钟。然后将20微升上清液注入HPLC装置中。将α-生育酚和辅酶Q10(还原和氧化形式)在分析型C18柱(150·4.6mm,3μm粒径,Supelco Bellefonte,PA)上用C18保护柱(50·4.6mm,3μm,Supelco)分离。 通过将LiClO 4(10mM)溶解在甲醇:叔丁醇(80/20,v / v)中并以0.6ml / min的流速使用来制备流动相。使用装配有5021型调理细胞和5010型分析细胞的Coulochem检测器(ESA,5100A型)检测化合物。三个串联电极的电位分别设定为≤0.6,≤0.15和+ 0.6V。通过使用已知浓度的纯标准品进行抗氧化剂的定量。
统计分析: 数据显示为平均值±SD。 对于彗星试验,为每个样品制备两个载玻片。 通过Kruskall-Wallis测试分析结果以评估各个载玻片之间的同质性。 使用Kolmogorov-Smirnov检验分析所检查组之间DNA损伤程度的差异。 进行Mann-Whitney U检验以比较LA-组和PL-组的生化分析。 p <0.05的概率值被认为具有统计学意义。
结果
补充LA可抑制氧暴露引起的氧化损伤
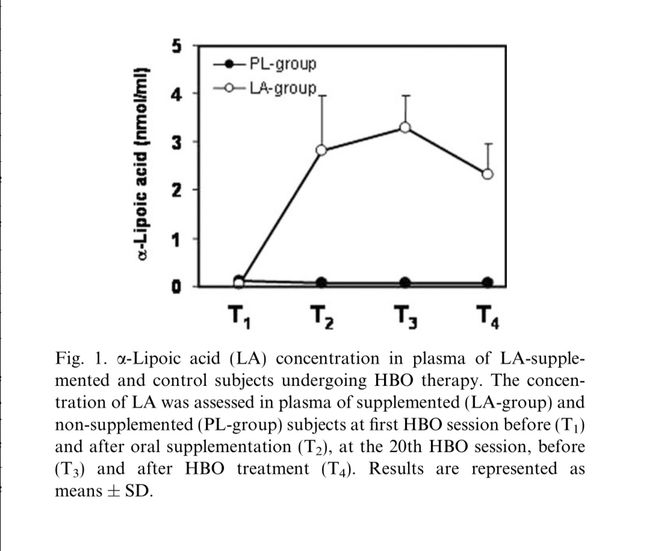
LA(600mg /天)的摄入导致血浆中抗氧化剂浓度的增加。在第一次抗氧化剂给药(T2)后立即观察到高水平的LA,并且浓度在连续时间点保持在相同水平(图1)。
使用碱性彗星试验,我们量化单个DNA链断裂形成以及从接受HBO治疗的受试者分离的淋巴细胞的核DNA中对甲酰胺嘧啶DNA糖基化酶(fpg蛋白)敏感的修饰数量。在暴露于氧气之前接受LA(LA-组)的患者中检测到的DNA氧化损伤与接受安慰剂(PL-组)的患者在统计学上不同。在PL组中,HBO处理在第一次氧暴露(T2)后立即诱导由fpg蛋白(氧化嘌呤)识别的DNA碱基修饰,而没有发生DNA链断裂的形成(图2A)。在第20次HBO会议上,预先形成的DNA氧化嘌呤被完全修复(T3)并且连续暴露于氧气不会诱导进一步的DNA损伤(T4),这可能是由于在连续HBO处理后诱导细胞修复酶。
相反,在长时间暴露于氧气(T3)后发生氢过氧化物的形成。然而,HBO处理后氧化脂质降至基础水平(图2B),证实了HBO治疗终止脂质过氧化链反应的能力,如先前报道[25]。如图1和2中所观察到的,LA的补充有效地抑制了氧化性DNA损伤和脂质过氧化。
LA回收内源性抗氧化剂,增强血浆的抗氧化能力
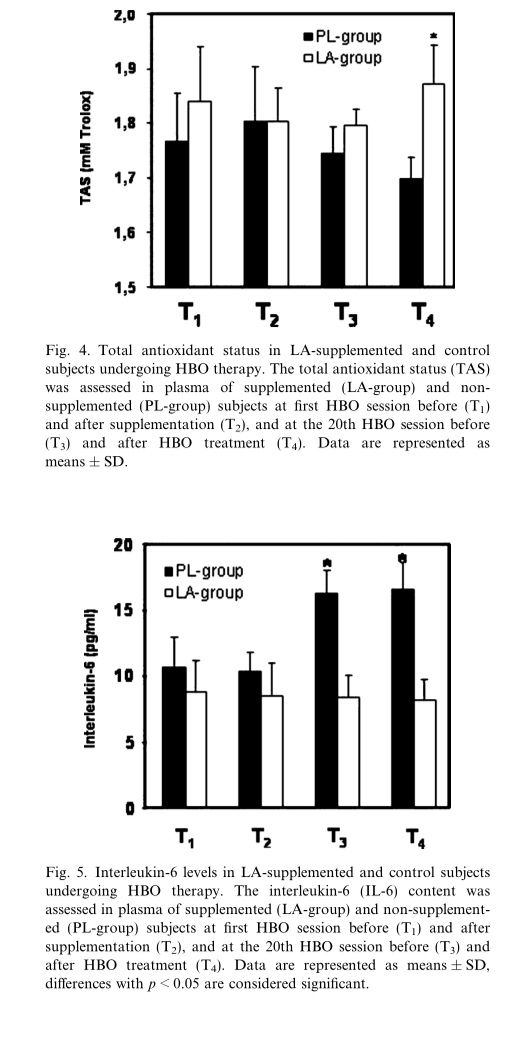
已经报道了LA与其他血浆抗氧化剂如抗坏血酸、GSH和间接α-生育酚相互作用的能力[18,19]。 在这里,我们评估了LA在HBO处理过程中作为α-生育酚和CoQ10(氧化和还原形式)再生中的共同抗氧化剂的作用。 与PL组相比,LA补充剂诱导α-生育酚血浆浓度显着增加(p <0.05)(图3A)。 观察到HBO治疗诱导PL组中总CoQ10血浆水平的增加,并且在接受LA补充的患者中引起较小程度的增加而不影响其氧化/降低的比例(图3B)。 通过总抗氧化状态(TAS)分析评估LA增加血浆抗氧化活性的能力。 图4显示与T4处的PL-组相比,LA-组中TAS的轻微增加。
LA通过抑制IL-6的表达来影响免疫系统
LA对免疫功能紊乱的治疗效果归因于其抗氧化活性[26,27]。 为了评估LA是否影响HBO治疗期间促炎性细胞因子的产生,我们在上述时间点(T1,T2,T3和T4)测量了IL-6的释放。 在接受安慰剂的患者中,HBO治疗后血浆中IL-6的产生增加,最可能是由于炎症事件,而LA抑制其表达(图5)。
LA改善HBO治疗后慢性伤口的愈合过程
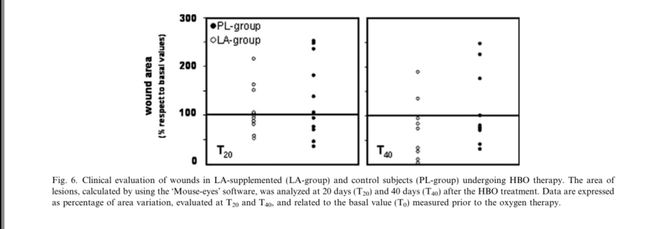
鉴于LA具有很强的抗氧化和免疫功能,我们检查了抗氧化剂的使用是否会影响接受HBO治疗的患者慢性伤口的愈合过程。 通过对伤口面积的分析,我们观察到在PL组中,约50%的患者在第一评估时间(T20)显示病变减少,而在第二次评估(T40)时未发现显着变化。 LA的每日口服加速了HBO治疗诱导的愈合过程。 如图6所示,约60%的患者在HBO治疗后20天(T20)显示伤口面积减少。 在第二次评估(T40)时,显示溃疡减少的患者百分比增加至80%,其中一些伤口总体缓解。
LA gǎishàn H
讨论
高压氧会增加组织的氧气张力,这可能会在细胞水平上产生许多有益的影响。然而,尽管有数据支持在临床实践中使用HBO [10-12],但已显示氧自由基对细胞功能的有害影响[13-15]。在其他细胞靶标中,基因组特别脆弱。氧化性DNA损伤由链断裂、无碱基位点和氧化碱组成[22,23]。各种DNA修复机制参与去除氧化性DNA损伤以确保遗传信息的稳定性[23,28]。如果没有充分修复,ROS诱导的DNA损伤可能导致突变。
使用彗星试验,我们发现HBO暴露导致氧化DNA碱基的形成。 DNA损伤仅在第一次治疗后发现,但在第二次或更进一步的HBO暴露后未发现(参见图2A)。重复HBO后DNA损伤的程度甚至低于第一次氧暴露前的基础样品,因此表明诱导损伤的完全修复。治疗相关条件下的HBO具有诱导细胞DNA损伤的潜力。然而,由于DNA修复系统的诱导,由ROS诱导的DNA损伤被快速修复。增强的DNA修复活性导致细胞的“适应性反应”,其迅速修复ROS诱导的DNA氧化。其他人也观察到HBO诱导的DNA损伤的修复和“适应性反应”的刺激[29]。
研究还表明,HBO治疗不会在健康志愿者中诱导基因突变或增加突变频率[30]。与第一次HBO暴露后出现的氧化性DNA损伤相反,在长时间暴露于氧气后检测到脂质过氧化物(参见图2B)。氢过氧化物是脂质氧化的第一氧化产物,它们在其中积累。我们观察到在T3时间形成的氢过氧化物在暴露于HBO后完全消除(点T4),表明氧处理能够相互作用并终止过氧化链反应,如前所述[25]。 LA的补充有效地抑制DNA和脂质氧化(参见图2A和B)。在接受LA的患者的血浆中,我们发现与安慰剂组的患者相比,T4时TAS值的增加(尽管是轻微的)(参见图4)。
血浆的总抗氧化活性增强可归因于LA血浆浓度升高(参见图1)或LA对血浆抗氧化剂的内源性循环,其他人已观察到[18,19]。在这里,我们分析了两种脂溶性抗氧化剂,α-生育酚和辅酶Q10的浓度。后者CoQ10是线粒体电子呼吸链中特别重要的组分,其发挥增加的抗氧化活性。 CoQ10以氧化和还原形式存在,其氧化/还原比被认为是与氧化应激相关的病理状态的生物标志物[31]。
HBO暴露后CoQ10含量的增加可能是对氧化应激的适应性反应的结果;事实上在LA的存在下,CoQ10的血浆水平略有增加。然而,在HBO处理后CoQ10的氧化和还原状态没有变化,因此表明通过氧气暴露产生的大多数自由基被血浆的亲水性抗氧化剂如抗坏血酸和谷胱甘肽清除。相反,在氧气处理后α-生育酚含量没有增强,但是在补充LA后患者的血浆中发现了维生素E的再循环(参见图3A)。
总之,我们的研究结果表明,HBO疗法会对生物分子产生氧化损伤,生物分子可通过激活高效的细胞修复系统(自适应反应)迅速修复。然而,在一些病理条件下,例如伤口愈合受损,由氧暴露后与自由基相关的慢性炎症产生的ROS可能导致过度的氧化应激,这可能压倒内源性细胞抗氧化机制,从而损害溃疡的愈合过程。因此,与HBO相关的抗氧化疗法可以恢复正常的细胞功能。值得注意的是,LA降低了由于HBO暴露而产生的促炎细胞因子如IL-6的水平(参见图4),因此表明其作为免疫系统调节剂的作用。 LA还有助于加速慢性溃疡的消退,既可作为抗氧化剂,也可作为免疫系统的调节剂。在HBO治疗后,大约50%属于PL组的患者在治疗后第20天(第20天)显示第一对照组的伤口面积减少,但在第二次评估时没有观察到伤口大小的进一步减少 (T40)。相反,LA组中60%的受试者在T20时显示溃疡面积减少,治疗后40天愈合过程进一步改善,确定伤口明显减少,在某些情况下导致总数减少缓解(参见图6)。伤口愈合是一个复杂的过程,历史上被描述为具有三个不同的阶段,即炎症、纤维瘤和成熟,但它现在被认为是一个连续的过程[32]。细胞因子和生长因子在以几种方式起始,控制和终止伤口愈合的细胞事件中起着至关重要的作用[33]。已经表明,伤口具有不同的蛋白酶、蛋白酶抑制剂和细胞因子以及不同的组织重塑速率。因此,蛋白酶、蛋白酶抑制剂、细胞因子和生长因子之间的相互作用是复杂的,对伤口愈合过程至关重要[34]。我们发现LA促进伤口愈合过程并抑制IL-6的表达。
因此,我们假设抗氧化剂可与严格参与伤口愈合的因子相互作用,促进瘢痕形成,并表明其适用于临床实践。