冰桶挑战发起者之一去世:只活了34岁的他,让全世界认识了渐冻症

弗拉泰斯与他的家人。图片来源:DAVID L RYAN/GLOBE STAFF
撰文:莱昂纳德·彼得鲁切利(Leonard Petrucelli)、阿龙·吉特勒(Aaron Gitler)
翻译:刘晓鲁 樊东升
还记得“冰桶挑战”吗?
2014 年,冰桶挑战公益活动火遍全球。被点名的人要么接受挑战、被冰水浇头,要么选择向研究肌萎缩侧索硬化症(ALS,也称渐冻症)的机构捐出 100 美元。这场活动让 ALS 受到前所未有的关注,也为 ALS 筹集了大量研究经费。
就在昨天,这场活动的发起者之一,34 岁的 ALS 患者皮特·弗拉泰斯(Pete Frates)在美国马萨诸塞州的家中去世。
肌萎缩侧索硬化症,是一类极其凶险的罕见疾病。患者脑部和脊髓的运动神经元陆续死亡,因此其活动能力、敏捷程度、语言能力和吞咽功能下降,只能眼睁睁地在轮椅上看着自己的身体被疾病吞噬。大多数患者会因呼吸衰竭在3~5 年内去世。
冰桶挑战在一开始与 ALS 无关。直到 2014 年 7 月,美国佛罗里达州的高尔夫运动员克里斯·肯尼迪(Chris Kennedy)接受了这项在当时还鲜为人知的挑战。在考虑下一个目标时,他想到了 ALS 患者安东尼·塞内尔基亚(Anthony Senerchia)。于是,他点名塞内尔基亚的妻子接受挑战,希望借此为 ALS 患者的家庭带来一些欢乐。很快,挑战通过帕特·奎因(Pat Quinn)传到了他的朋友弗拉泰斯那里。
弗拉泰斯曾是波士顿学院棒球队的队长。2012 年,27 岁的弗拉泰斯被诊断患上 ALS,不仅告别了棒球场,运动神经元的受损也让他的身体状况每况愈下。但在死神的阴霾下,弗拉泰斯依然保持乐观,他拍摄被浇水的视频、为 ALS 协会筹集资金,成了第 4 位为了 ALS 进行挑战的人。

弗拉泰斯(图中坐轮椅者)与马萨诸塞州官员进行冰桶挑战。(图片来源:Charles Krupa/AP)
在上传挑战视频至 Facebook 时,弗拉泰斯添加了#StrikeOutALS 的标签。在那之后,冰桶挑战开始在网络上迅速传播,并引发巨大的轰动。包括马克·扎克伯格、比尔·盖茨、莱昂纳多·迪卡普里奥、勒布朗·詹姆斯在内的众多名人也纷纷响应,参加了挑战。短短 8 周时间内,Facebook 用户就发布了超过 1700 万条挑战视频。根据《波士顿环球报》的数据,冰桶活动共募集到 1.6 亿~2.2 亿美元,用于 ALS 的科学研究、患者和社会服务等。
这篇原载于《环球科学》2017 年 7 月刊的文章,讲述了 ALS 是如何让患者逐渐丧失活动能力的,并且介绍了科学家在寻找 ALS 药物中的最新进展。基于基因沉默技术、基因测序技术、生物标记物的早期诊断和药物疗法,我们看到了治愈 ALS 的曙光。
肌萎缩侧索硬化症(ALS)的出现往往悄无声息。患病初期虽无疼痛,但患者神经细胞支配骨骼肌的能力受到影响。他们会出现一些细微的症状,如走路磕绊、行动笨拙和口齿不清。而这些症状常常会被忽视。因为著名棒球运动员卢·格里克(Lou Gehrig),这种疾病才走进了公众视野。卢·格里克曾被誉为铁马,连续 14 年征战超过 2130 场比赛。他于 1939 年 6 月被确诊为 ALS,一个月后就在扬基体育场悲壮退役。卢·格里克的病情发展迅速,当年 12 月就虚弱到无法参加自己入选名人堂的典礼了。随着病势加重,他最终卧床不起,并于 1941 年结束了年仅 37 岁的生命。
每年,美国有超过 6000 人确诊为 ALS。患病年龄多为 50~60 岁,但也有患者是在很年轻或者 80 岁的时候发病的。发病时,脑部和脊髓的运动神经元会开始死亡,而这些细胞的功能是从大脑经脊髓向肌肉发出信号。因此这将导致患者的活动能力、敏捷程度、语言能力甚至吞咽功能下降。大多数患者脑部高级认知功能并未受损,只能眼睁睁地看着自己的身体一点点地被疾病吞噬。他们很快就被困在轮椅上,逐渐丧失交流、进食或呼吸的功能,大多数患者会因呼吸衰竭在3~5 年内去世。美国食品及药品管理局(FDA)唯一批准用于治疗 ALS 的药物——谷氨酸阻滞剂利鲁唑(glutamate blocker riluzole)——平均也只能延长患者 3 个月的生命,但尚无方法将其治愈。
法国神经病学先驱让-马丁·沙尔科(Jean-Martin Charcot)在 1869 年首次提出并命名该病,通过“肌萎缩侧索硬化”这个名称概括了此病的特点:“肌萎缩”指肌肉缺乏营养;“侧索”是脊髓的一个区域,这是死亡的运动神经元所在的位置;“硬化”则是指神经退化过程中的组织硬化或瘢痕化。沙尔科所描述的疾病特点简练清晰,但近一个半世纪以来,ALS 的复杂性仍使研究人员深感困惑。尽管这是一种致命的疾病,但不知为何,也有约 10% 的患者生存期达到 10 年以上。这部分患者中就包括著名物理学家史蒂芬·霍金(Stephen Hawking),他已在 ALS 的折磨下生活了 50 余年。近来的研究显示,环境因素对诱发 ALS 仅起到很小的作用,可能只是增加了携带易感基因的人群的患病风险。最让人感到困惑的是疾病发生的随机性,只有不足 10% 的病例是由父母遗传给孩子,其余的病例都是非遗传性或者说散发性的。
在过去 10 年里,精准的测序技术使我们在生物学层面对疾病有了更深的了解。越来越多的研究显示,许多不同的基因都跟这种疾病有关,它们单独表达或共同作用,增加了个体的患病几率。一些基因突变甚至与 70% 以上的家族性 ALS 和约 10% 的散发性 ALS 相关。反过来,这些新的基因研究也为更好的治疗指出了方向。基因沉默技术是某些 ALS 潜在的治疗手段,作用于特定目标基因的两种药物有望在今年进行临床试验。与此同时,研究人员也在寻找特异性的生物标记物,包括体液或脑电活动中的可测量成分,这将有助于临床医生早期诊断和定量评估疾病进展。这些生物标记物对其他药物的研发也很有帮助。
早期的遗传发现
大多数家族性 ALS 患者有 50% 的几率把疾病遗传给下一代。尽管在患者中只占很小的比例,他们极大地加深了人类对 ALS 遗传机制的认知。关于 ALS 的第一个遗传学发现,是在 1993 年确认了SOD1基因突变,约 20% 的家族性 ALS 患者都携带有这种突变。SOD1基因负责编码的是抗氧化物超氧化物歧化酶(antioxidant enzyme superoxide dismutase),这种酶的作用是将高反应性超氧化物分子转化为无害的形式。
起初,研究人员推测SOD1突变可能减弱了酶的抗氧化能力,导致氧自由基对运动神经元造成破坏。二十多年后,我们知道情况并非如此。突变导致酶的作用超出了正常范畴,细胞获得了一些新的功能,这种情况被科学家称为毒性功能获得(toxic gain of function)。
更为严重的是,这些新出现的功能导致了神经元内某些蛋白形态的改变。通过对 ALS 患者进行尸检,研究人员发现绝大多数患者都有一个典型的脑病理特征,那就是运动神经元内的蛋白聚集。若想让神经元正常工作,组建细胞结构的蛋白必须要有效地循环起来,但在 ALS 患者的细胞中,这一循环体系已彻底崩溃。包括酶在内的所有蛋白质,在细胞内合成时都需要保持精准的三维结构才能发挥正常的功能,基因突变则会导致个别蛋白因错误折叠而聚集。出现这种情况时,细胞会通过泛素这一分子标记物,将结构异常的蛋白标记出来并清除掉。但如果清除体系的负荷过重,垃圾就会逐渐堆积。在某些家族性 ALS 患者的运动神经元中,就能够发现大量泛素标记的 SOD1 蛋白聚集。
ALS 研究领域最重要的里程碑出现在 2006 年,科学家将目光转移到不携带SOD1突变的 ALS 患者身上。他们发现了另一种被称为TDP-43的蛋白。这种蛋白聚集在几乎每一位患者的运动神经元内。TDP-43 蛋白的功能是调节信使 RNA 的活性,而信使 RNA 既是基因信息的复制者,又是编码合成蛋白质的模板。TDP-43 与信使 RNA 结合,指导后者在细胞核内的转录过程,随后将信使 RNA 运送到细胞内的相关区域,在 RNA 翻译成蛋白质的过程中发挥重要作用。然而,在 ALS 患者体内,TDP-43 不知为何离开了细胞核。它们聚集在细胞质中,有时还会吸引更多的这类蛋白进入细胞质。科学家仍在探索,这一过程中的 TDP-43 究竟是导致了功能缺失(因其离开细胞核)还是毒性功能获得(因其在细胞质中聚集),还是两者兼而有之。
科学家发现大多数患者体内都会出现 TDP-43 的聚集后,他们便着手研究这种蛋白的基因TARDBP,并在一些遗传家系中发现了罕见突变。这一重要突破从理论上确定了 RNA 结合蛋白的这一行为可能导致 ALS。随后,更多参与 RNA 调节的蛋白被确定为 ALS 致病因素,预计还会有更多的发现。21 世纪头十年,ALS 的遗传学发现呈现出井喷之势,每年都约有1~2 个疾病基因被确认,但最振奋人心的发现此时还仍未到来。
重复序列
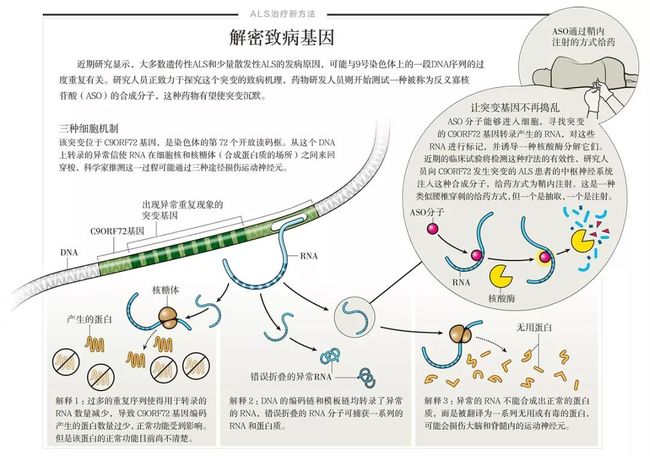
这一发现源于对遗传家系的研究。2011 年,两个研究团队分别报道了同一个特殊的突变基因,该基因的名称也同样特殊——C9ORF72。这是指 9 号染色体上第 72 个开放读码框(open reading frame,DNA 序列中可编码蛋白质的一段无终止密码子打断的碱基序列)。在健康人群中,C9ORF72所包含的一段 DNA 序列 GGGGCC 的重复次数为2~23 次,但在C9ORF72发生突变的人群中,这个片段的重复次数可达数百次甚至上千次。
随后的研究显示,这些过度重复的序列可以解释 40%~50% 的家族性 ALS 病例和5%~10% 的散发性病例。更为有趣的是,这一突变的发现使 ALS 和另一种疾病——一种名为额颞叶变性(frontotemporal degeneration, FTD)的痴呆症,建立起了遗传学上的联系。FTD 表现为显著的人格改变和决策混乱。C9ORF72突变可引起 ALS 或 FTD,甚至是二者相结合的 ALS-FTD。在C9ORF72突变患者的神经元中也可以发现 TDP-43 蛋白的聚集,这两种疾病因此建立起了另外一种联系。这种关联性意味着,ALS 和 FTD 可能是相关疾病谱系的一部分,但是同一个基因的突变为何会导致如此不同的症状仍不得而知。
研究人员提出了3 种细胞机制来解释这个神秘基因的突变是如何导致 ALS 的。第一种解释是,DNA 重复片段会干扰信使 RNA,使其无法完成遗传密码的正常转录和翻译,影响了蛋白的合成。虽然这些蛋白的确切功能尚不清楚,但这无疑会导致其功能的降低;第二种解释是,重复序列可能会引起 RNA 的聚集。它们在神经元的细胞核内形成聚集物,捕获 RNA 结合蛋白(RNA-binding protein),从而使其无法发挥正常功能,导致了毒性功能获得;第三种解释是,当一个人的C9ORF72基因发生突变,扩增的重复序列被翻译为易在核内聚集的异常蛋白,这种分子生物学改变最终导致了毒性功能获得。
迄今为止,已有的证据更支持“C9ORF72突变引起 ALS 是毒性功能获得所致”这样的推断,但尚不清楚的是,RNA 聚集和蛋白聚集谁是更关键的致病因素。不过这也不要紧,正在研发的治疗策略将同时阻断突变基因产生 RNA 和蛋白质的能力。
反义药物
基因沉默技术是治疗神经退行性疾病最有前景的技术之一,这项技术使用了合成的反义寡核苷酸(antisense oligonucleotide,ASO)。
ASO 分子可以识别特定基因的信使 RNA,并与之结合。ASO 与 RNA 结合后,会激活一种核酸酶,攻击 RNA-ASO 复合体。实际上,ASO 可以选择性地破坏任何突变基因的 RNA。在针对 C9ORF72 突变的啮齿动物的研究中,科学家合成了反义分子(antisense molecule),用它来破坏运动神经元中 RNA 聚集而成的团块。结果发现,这种反义分子不仅可以破坏 RNA 团块,也能破坏异常蛋白的团块,甚至可以避免新的蛋白聚集体的形成。
靶向作用于C9ORF72基因的反义药物(antisense drug)正在进行临床试验。研究人员也为 SOD1 突变导致的家族性 ALS 患者设计了反义药物,这项研究的早期临床试验显示鞘注给药是安全的(鞘注给药是指,通过腰椎穿刺,直接向患者脑脊液给药的一种治疗手段),药物可以通过脑脊液的流动分布在脑周围并进入运动神经元。
ASO 治疗另一种神经退行性疾病——脊髓性肌萎缩症的成功,让研究人员稍微乐观了一些。这种遗传性运动神经元疾病出现在婴幼儿中,与 ALS 非常相似,患儿很少能够活过 3 岁。在近期的两项临床试验中,研究人员利用反义药物纠正基因缺陷所导致的信使 RNA 异常,结果惊喜地发现患儿的运动能力显著改善。FDA 于是对这些试验进行快速跟踪,并于 2016 年 12 月正式批准了该药物的上市申请。
寻找突变基因
研究有明确遗传规律的家族性 ALS,为我们更好地理解这类疾病的生物学机制打下了基础。但这类病例毕竟只占少数,目前最大的挑战是研究散发性 ALS 患者,确定是哪些突变,让这些患者的患病风险升高了。目前全世界的科研人员都在积极收集 ALS 患者的 DNA 样本,对海量的基因组数据进行分析。
为了加快这项工作,遗传学家开发了一种微芯片来协助研究,该方法可以轻易地完成 ALS 患者和健康人群的基因组比对,在全基因组关联分析(genome-wide association studies, GWAS)的研究中发挥了重要作用。芯片主要分析的是基因组中包含单核苷酸多态性(single nucleotide polymorphisms,SNP)变异的区域,这些区域的 DNA 信息或核苷酸在个体间的差异很大。虽然 GWAS 是相关性研究,并不能确定是什么导致了 ALS,但它可以发现可疑的差异,以进行下一步的观察。近来多项国际性的 GWAS 研究比对了超过 10 000 例 ALS 患者和超过 20 000 例正常人,在基因组层面发现了很多差异,这些发现目前都进入了新的研究阶段。新技术也使收集遗传数据变得更加简单,一天之内完成一个人的全基因组测序已成为现实,而且花费不会超过 1000 美元。如果只测定所有外显子(基因组中编码蛋白的部分)的序列,则会更加便宜快捷。
一旦列出了与 ALS 易感性相关的基因突变的黑名单,研究人员就可以探索 ALS 相关遗传突变为什么能够增加患病风险。这些探索包括:多个基因如何相互作用?某些形式的 ALS 是否存在多个突变基因?环境因素是如何诱发某些患者的疾病的?
一项新的研究显示,部分 ALS 甚至可能与一种逆转录病毒有关。这种病毒的 DNA 序列长期潜伏在患者的基因组内,通常处于休眠状态,一旦“苏醒”,病毒会在大脑内的神经元间传播,损害神经元,诱发疾病。
生物标记物
越来越多的研究显示,导致 ALS 的真凶不仅仅是运动神经元的死亡,胶质细胞在其中也起到了重要作用。
胶质细胞在脑内和中枢神经系统中数量众多,甚至超过了神经元。它们可以发挥多种功能:有的为神经元提供物理上的支撑,有的可调节脑内环境,特别是神经元和突触周围的液体。近期关于SOD1突变小鼠的研究又有了惊人的发现:尽管运动神经元中存在毒性 SOD1 蛋白,但只要阻断胶质细胞中突变基因的合成,就可以延长小鼠的生存期。运动神经元似乎是疾病的缘起,而前者与胶质细胞之间的信号传导,则促进了疾病的发展。胶质细胞可能也会通过产生毒性因子加剧 ALS,但科学家尚不清楚这种因子是什么,也不知道它们是如何发挥作用的。一旦这种(或这些)因子被探明,我们就可以阻止其产生,或者阻止它们向运动神经元传递异常信号,这样就能延缓或治愈 ALS 了。
在破译 ALS 成因的研究中,科研人员也一直在寻找能够帮助医生评价疾病进展的生物标记物。比如,目前已经有研究试图在易获取的体液(如血液或脑脊液)中检测C9ORF72基因编码产生的异常重复蛋白。2017 年,本文作者彼得鲁切利曾发表文章报道称,他在 ALS、ALS-FTD 患者以及无症状的突变基因携带者的脑脊液中,检测到了这些异常蛋白。这些检测手段将有助于疾病的早期诊断。这个领域的其他研究则着眼于开发影像技术,以便在 ALS 患者脑内的 TDP-43 蛋白团块攻击运动神经元之前及时检测到它们。所有这些生物标记物都可以作为评价临床试验有效性的标准。
遗传学和基因组学的快速发展以及新的生物标记物的开发,使 ALS 研究进入了精准医疗的时代。在不远的未来,患者将依据 ALS 类型分组,接受特定的治疗或预防。
社交媒体的力量
过去十年,ALS 研究领域的大多数进展要归功于患者的配合,他们自愿为大规模的基因组研究贡献时间和 DNA。ALS 患者和他们的家人也通过社交媒体提高了公众对该病的认知;他们还募集资金,支持科学研究,为患者服务。
2014 年,“ALS 冰桶挑战”掀起互联网风暴。2012 年,波士顿学院棒球队前队长皮特·弗拉泰斯(Pete Frates)被诊断为 ALS,之后他在 Facebook 上发布视频向他的朋友们发出挑战——把冰水浇在头上,为 ALS 协会筹集资金。此举引发了巨大的轰动并得到大量名人的响应,包括马克·扎克伯格(Mark Zuckerberg)、比尔·盖茨(Bill Gates)、奥普拉·温弗里(Oprah Winfrey)、莱昂纳多·迪卡普里奥(Leonardo DiCaprio)和勒布朗·詹姆斯(LeBron James)在内的众多知名人士都参加了挑战。短短 8 周时间,Facebook 用户就发布了超过 1700 万条挑战视频。支持者共捐出超过 115 000 000 美元(根据《波士顿环球报》的数据,冰桶活动募集的经费达到 1.6 亿~2.2 亿美元),其中 67% 用于科研,20% 用于患者和社会服务,9% 用于公众及专业教育。
ALS 是一种残酷无情的疾病。卢·格里克曾在纽约扬基体育场发表振奋人心的退役演讲,他把自己称为“地球上最幸运的人”。而在这场演讲和他患病的消息传出之前,大多数患者都只能默默承受。
现在公众意识的日益提高,源自弗拉泰斯这样的人的努力。他帮助发起的社会媒体行动极大地推动了 ALS 协会的发展,帮助这个机构把年度科研预算翻了三倍。我们对 ALS 生物学机制的认知会持续爆发式地增长,这将有助于科学家铺设对付致病基因的天罗地网,并在此基础上形成更好的治疗方案,最终有效控制 ALS 这个隐形杀手。科学家们对此非常乐观。
译者介绍:
刘晓鲁是北京大学第三医院神经内科的主治医师。
樊东升是北京大学第三医院神经内科主任,主要研究领域为神经退行性疾病及脑血管疾病。