高中化学必修二的定位是化学中的一些常识,所以内容比较驳杂,广而不深,称作选修三、四、五的合体简易版教材,需要记忆的内容非常多,同时必修二的基础弱不扎实,可能导致选修三、四、五听课的时候脱节。
今天对高中化学必修二进行知识点总结及易错警示整理。
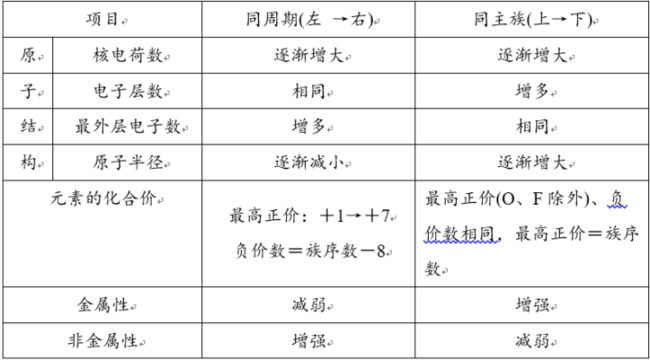
元素周期表中元素及其单质和化合物性质的变化规律
元素的金属性、非金属性强弱判断规律
(1)金属性强弱的判断依据
①元素的单质与水或酸置换出氢气的反应越容易进行,则其金属性越强。
②元素的最高价氧化物的水化物的碱性越强,则其金属性越强。
③金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,则A的金属性强于B。
④在金属活动性顺序表中,前面的金属性强于后面的。
⑤金属阳离子的氧化性越强,则其单质的还原性越弱,元素的金属性越弱(注:Fe的阳离子仅指Fe2+)。
(2)非金属性强弱的判断依据
①非金属元素的单质与氢气化合生成气态氢化物的反应越容易进行,则其非金属性越强。
②非金属元素气态氢化物的稳定性越强,则元素的非金属性越强。
③元素的最高价氧化物的水化物的酸性越强,则其非金属性越强。
④非金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,并且A体现出氧化性,则A的非金属性强于B。
⑤非金属阴离子的还原性越强,则其单质的氧化性越弱,元素的非金属性越弱。
粒子半径大小的比较——“四同”规律
1.同周期——“序大径小”
(1)规律:同周期,从左往右,原子半径逐渐减小。
(2)举例:第三周期中:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
2.同主族——“序大径大”
(1)规律:同主族,从上到下,原子(或离子)半径逐渐增大。
(2)举例:碱金属:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs),r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。
3.同元素
(1)同种元素的原子和离子半径比较——“阴大阳小”。
某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。
如:r(Na+)<r(Na);r(Cl-)>r(Cl)。
(2)同种元素不同价态的阳离子半径比较规律——“数大径小”。
带电荷数越多,粒子半径越小。
如:r(Fe3+)<r(Fe2+)<r(Fe)。
4.同结构——“序大径小”
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。
(2)举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
特别提醒 所带电荷、电子层均不同的离子可选一种离子参照比较。例:比较r(Mg2+)与r(K+)可选r(Na+)为参照,可知r(K+)>r(Na+)>r(Mg2+)。
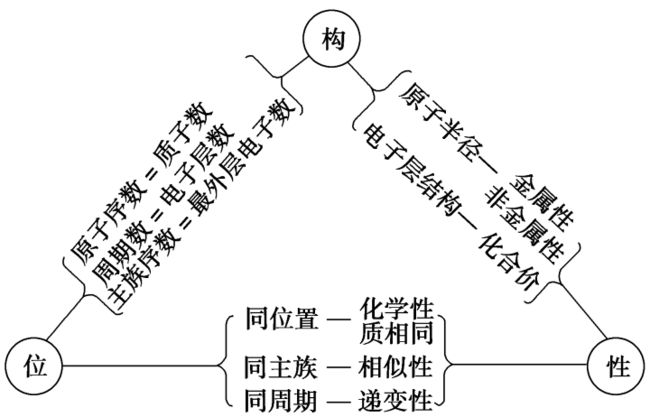
同一元素的“位、构、性”关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
即:元素的原子结构/元素在周期表中的位置/元素的主要性质。
1.结构与位置互推是解题的基础
(1)掌握四个关系式。
①电子层数=周期数。
②质子数=原子序数。
③主族元素原子最外层电子数=主族序数。
④主族元素的最高正价=族序数,
最低负价=主族序数-8。
(2)熟练掌握周期表中的一些特殊规律。
①各周期元素种类数(分别为2、8、8、18、18、32、26)。
②稀有气体元素原子序数(分别为2、10、18、36、54、86)和所在周期(分别在一到六周期)。
③同族上下相邻元素原子序数的关系(相差2、8、18、32等各种情况)。
④同周期ⅡA族与ⅢA族元素原子序数差值(有1、11、25等情况)。
2.性质与位置互推是解题的关键
熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:
①原子半径。
②元素的主要化合价。
③元素的金属性、非金属性。
④单质的氧化性、还原性。
⑤气态氢化物的稳定性。
⑥最高价氧化物对应水化物的酸碱性。
⑦金属从H2O或酸中置换H2的难易程度
3.结构和性质的互推是解题的要素
(1)电子层数和最外层电子数决定元素原子的金属性和非金属性强弱。
(2)同主族元素最外层电子数相同,化学性质相似。
(3)正确推断原子半径和离子半径的大小及结构特点。
(4)判断元素金属性和非金属性强弱。
易错点提示
(1)“三个不一定”。
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
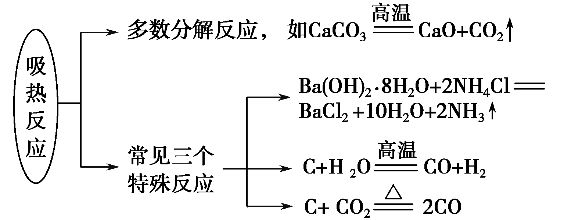
③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化,如NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。
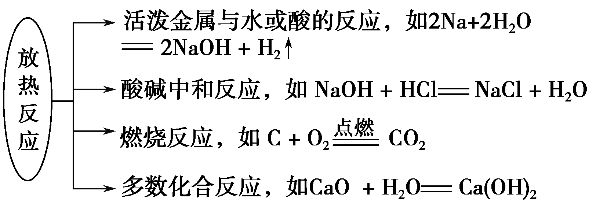
2.常见的放热反应和吸热反应
原电池原理的应用
(1)比较金属活动性
作负极的金属活动性强,作正极的金属活动性弱。
(2)改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
(3)设计原电池
如:把Fe+2Fe3+===3Fe2+设计成原电池,可用Fe作负极,铜(或石墨)作正极,FeCl3溶液作电解质溶液。
(4)保护金属设备
如:船体是钢铁材料,在海水中易被腐蚀,在船体外壳焊接上比铁活泼的金属(如Zn),则构成以Zn、Fe为电极的原电池,Zn被消耗掉而Fe得到保护。
常见的燃料电池
常见的燃料电池有氢氧燃料电池、甲烷燃料电池、甲醇燃料电池等。燃料电池的正极反应物一般为氧气。电解质不同,电极反应就不同,如氢氧燃料电池以碱为电解质,其放电原理为:
负极(H2)反应式:2H2-4e-+4OH-===4H2O(氧化反应)
正极(O2)反应式:O2+2H2O+4e-===4OH-(还原反应)
电池总反应式:2H2+O2===2H2O
氢氧燃料电池以酸为电解质,其放电原理为:
负极(H2)反应式:2H2-4e-===4H+(氧化反应)
正极(O2)反应式:O2+4H++4e-===2H2O(还原反应)
电池总反应式:2H2+O2===2H2O
化学反应速率影响因素注意点
(1)主要因素(内因)
不同的化学反应,具有不同的反应速率,因此,参加反应的物质的性质是决定化学反应速率的主要因素。
(2)外界因素(外因)
①温度:当其他条件不变时,升高温度,可以增大化学反应速率;降低温度,可以减小化学反应速率。
②催化剂:当其他条件不变时,使用适当的催化剂通常能极大地加快化学反应速率。
③浓度:当其他条件不变时,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。
④压强:对于有气体参加的反应,当其他条件不变时,增大气体的压强,可以增大化学反应速率;减小气体的压强,可以减小化学反应速率。
⑤固体表面积:固体颗粒越小,其单位质量的表面积越大,与其他反应物的接触面积越大,化学反应速率越大。
⑥反应物状态:一般来说,配成溶液或反应物是气体,都能增大反应物之间的接触面积,有利于增大反应速率。
⑦形成原电池,可以增大氧化还原反应的反应速率。
化学平衡状态的判断
1.直接标志
(1)v(正)=v(逆)。
①同一种物质的生成速率等于消耗速率
②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比
③在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比
(2)各组分的浓度保持一定
①各组分的浓度不随时间的改变而改变
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变
2.间接标志
(1)反应体系中的总压强不随时间的改变而变化(适用于反应前后气体体积不等的反应)。
(2)混合气体的密度不随时间的改变而变化(适用于反应前后气体体积不等且无固体、液体参与或生成的反应)。
(3)对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
(4)全是气体参加的反应前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(5)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
甲烷发生取代反应的有关规律
(1)反应条件和反应物
反应条件为光照,反应物为卤素单质。例如甲烷与氯水、溴水不反应,但可以与氯气、溴蒸气发生取代反应。
(2)反应产物
虽然反应物的比例、反应的时间长短等因素会造成各种产物的比例不同,反应的产物都是CH3Cl、CH2Cl2、CHCl3和CCl4四种有机物与氯化氢形成的混合物。
(3)物质的量的关系
CH4与Cl2发生取代反应时,每1 mol H原子被取代,消耗1 mol Cl2分子,同时生成1 mol的HCl分子。
(4)注意:
①有机反应比较复杂,常伴随很多副反应发生,因此有机反应方程式常用“―→”。
②CH4与Cl2的反应逐步进行,应分步书写。
③当n(CH4)∶n(Cl2)=1∶1时,反应并不只发生CH4+Cl2CH3Cl+HCl,其他反应仍发生。
解题方法归纳
(1)甲烷的卤代反应的产物是混合物。
(2)甲烷等有机物与氯气发生取代反应时,取代的位置和个数是难以控制的,因此制备卤代烃一般不采用取代反应。
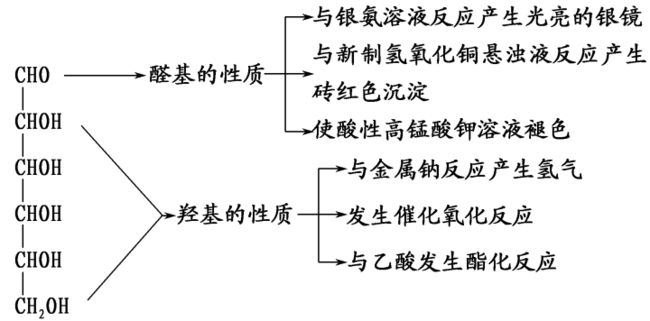
葡萄糖的化学性质
酯与油脂的区别
(1)酯是无机含氧酸或有机羧酸与醇通过酯化反应生成的一类有机物,而“油脂”是高级脂肪酸与丙三醇形成的酯,故“酯”中包含“脂”,注意两字的书写,“油脂”不能写为“油酯”。
(2)“油”和“脂”都是高级脂肪酸甘油酯。“油”一般不饱和程度较高,熔点较低,室温下为液态;“脂”一般饱和程度较高,熔点较高,室温下为固态,又称为“脂肪”。油通过氢化可以转化为脂肪。另外,油脂是混合物。
蛋白质的检验
(1)有些蛋白质能与浓硝酸发生颜色反应。此类蛋白质通常含有苯环。
(2)灼烧蛋白质固体时产生烧焦羽毛的气味,原因是分子中含有N、S等元素。
我是点心优课化学于汐老师,毕业于中山大学化学系,全国前五高中任教17年,曾任化学教研组长、竞赛教练。
更多高中化学知识点总结、高考必杀技请关注公号ID:化学点心优课服务号。