“病毒”这个名字听起来就很不友好,从普通感冒到恶性肿瘤,人类的多种疾病中都能找到它们的身影。流感病毒在历史上累计导致数以亿计的人死亡;乙型肝炎病毒和丙型肝炎病毒目前正侵蚀着超过5亿人的肝脏;上千万人的免疫系统受到人类免疫缺陷病毒(HIV)的攻击;轮状病毒每年导致几十万婴幼儿死亡。除此之外,人乳头瘤病毒(HPV),日本脑炎病毒,汉坦病毒,狂犬病病毒也在时刻在威胁着人类的生命。
不过,就在医生们绞尽脑汁寻找抗病毒药物的时候,一些科学家却在琢磨如何“驯服”病毒帮助人类治疗疾病,他们灵感来源于近一百年前的偶然发现。
被称为细菌学之父的法国科学家路易斯·巴斯德在1885年发明了狂犬病疫苗,这是一种减毒活疫苗,也就是通过特殊方法处理,降低了狂犬病病毒对狗和人的感染性。巴斯德用他的狂犬病疫苗成功的救治了两名被狂犬咬伤的小男孩,由此拉开了现代免疫学的序幕。
据20世纪初的病历记载,一位患有宫颈癌的妇女被狗咬伤后向医生求助,医生按照标准流程为她接种了狂犬病疫苗,而令医生惊奇的是,这位癌症病人在接种疫苗后的一段时间里,癌组织竟然减小了许多。与此同时,一名意大利的医生在一位颈部肿瘤患者身上也观察到了同样的现象。这些案例不禁让科学家们开始思考,能否用病毒来治疗恶性肿瘤。
恶性肿瘤起始于失控的细胞,这些细胞具有快速和不受限制的分裂能力。快速生长的癌细胞除了会导致人体组织器官受到阻塞和挤压,还会破坏所在器官和邻近器官的功能,并导致疼痛,感染,坏死和出血。而最让医生头疼的是,肿瘤细胞宛如撒了缰的野马,能够在体内四处乱窜,而不论肿瘤细胞转移到哪里,带来的伤害都是巨大的。
由于快速的生长和转移,恶性肿瘤的治疗一直以来都很棘手。外科手术治疗对于体积较小,未发生广泛性转移的原发灶可以达到彻底治愈的效果,而对于体积较大并发生转移的恶性肿瘤,则需要依靠化学治疗和放射治疗来帮忙。化学治疗和放射治疗的原理差别很大,不过目的都是杀死快速分裂的肿瘤细胞,但由于靶向性差,这两种治疗方法对于人体正常细胞的误伤很大,也会给病人带来极大的痛苦和严重的后遗症。所以,如何提高抗肿瘤治疗的靶向性,将是未来肿瘤治疗的核心问题。
在首次发现减毒狂犬病病毒能够抑制肿瘤细胞后,许多实验室都开始了利用病毒治疗恶性肿瘤的研究。然而,由于分子生物学技术还未被建立起来,科学家们只能够利用野生型或者经过减毒处理后的病毒毒株进行试验。1956年,美国国立癌症研究所的科学家采用不同血清型的野生型腺病毒对一些宫颈癌患进行治疗,结果显示治疗组有半数以上患者的肿瘤缩小。另有研究也发现水痘病毒和麻疹病毒对于白血病和一些淋巴瘤具有抑制作用。
然而,无论使用野生型病毒还是减毒毒株,都存在很大的风险。比如,有些病毒本身就具有致癌的风险;有些病毒会导致具有遗传特质的个体出现严重的急性反应;有些减毒病毒也存在通过突变回复毒力的可能性。而更让科学家头疼的是,给病人接种病毒会激活宿主的免疫反应,还没等病毒把肿瘤细胞杀死,病毒自己就先被清除掉了。正因为如此,要想使用病毒来治疗人类疾病,必须要对病毒进行适当的改造。
1953年,沃森和克里克发表了他们的DNA双螺旋结构,以此为基础的分子生物学技术开始进入快速发展时期,分子克隆和基因工程等技术的建立使得科学家在分子水平上操纵基因成为可能。搭着分子生物学技术的春风,病毒学家们也开始跃跃欲试,尝试用各种方法改造病毒。如果把病毒看做生物,那它将是世界上最简单的生物类型,典型的病毒只有几个到十几个基因,而相比之下,细胞生物的基因数量一般都在成千上万个。简单的基因构成,也使得病毒成为最容易进行基因操作的对象之一。
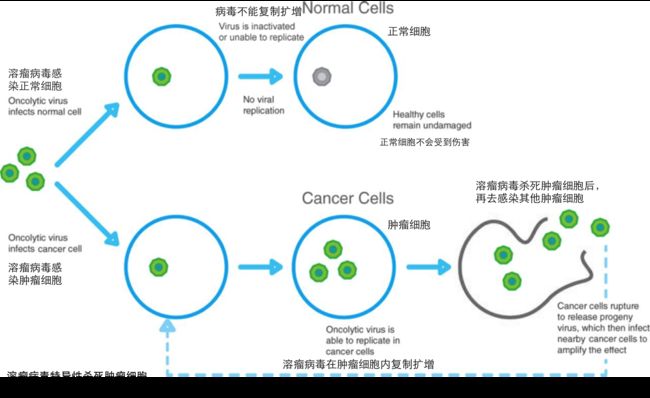
现在正在研究的抗肿瘤病毒主要有两大类,一类是天然对于肿瘤细胞具有特异性感染或杀伤能力的病毒,比如呼肠孤病毒,细小病毒和新城疫病毒;另一类是经过人为改造过,对于肿瘤细胞具有特异杀伤能力的病毒,比如甲型流感病毒,腺病毒,麻疹病毒和单纯疱疹病毒。这两类病毒现在已经成为科学家手中抗击肿瘤的利器,并且被赋予了一个振奋人心的名字——溶瘤病毒。
科学家们使用的天然溶瘤病毒,往往不以人类为自然宿主,对人类细胞感染能力较弱,这在一定程度上保证了安全性。然而,天然溶瘤病毒的可控性差,对于肿瘤细胞的杀伤能力有限,而且容易激活宿主免疫系统而被清除掉,所以在应用上具有一定的局限性。而经过人为改造的溶瘤病毒在近年来越来越受到科学家的青睐,并且已经在临床试验中取得不错的效果。
对于溶瘤病毒的改造过程非常复杂,需要进行大量的实验验证,不过总体上的思路都是一致的,那就是专化,强化和弱化。
科学家选择利用病毒来治疗恶性肿瘤,首先看中的是病毒感染细胞的特异性。病毒感染细胞的特异性是由病毒表面蛋白质和宿主细胞表面受体相互作用而决定的,不同病毒对于宿主细胞表面的蛋白质需求不同,所以特定的病毒往往只能感染特定种类的细胞。科学家们通过改造溶瘤病毒表面的蛋白质,使得它只能够认识肿瘤细胞表面特异的受体,这样就可以最大程度的降低误伤正常细胞的概率。为了做到双重保险,科学家们给溶瘤病毒加上了肿瘤细胞特异的启动子,也就是即便它们“失误”而感染了正常细胞,也不能够起始自己基因组的复制扩增,这样就不会对正常细胞造成伤害。正是由于进行了严格的“专化”改造,使得溶瘤病毒具有了传统放化疗所不可比拟的靶向性优势。
溶瘤病毒的关键在于“溶瘤”,然而,并不是所有的病毒在感染后都会导致宿主细胞死亡。为了达到目的,科学家们往往选择能够特异的在肿瘤细胞中大量复制并导致肿瘤细胞死亡的病毒进行研究。与此同时,科学家还会通过各种方法进一步强化溶瘤病毒对于肿瘤细胞的杀伤能力。比如,通过对病毒基因组进行重组,科学家们可以将多种抗肿瘤策略整合到同一个溶瘤病毒中,这就将溶瘤病毒变成了“散弹枪”,使得一种病毒就能达到多角度全方位歼灭肿瘤细胞的效果。
为了防止被宿主强大的免疫系统清除掉,科学家们还会通过采取一定的方法改变溶瘤病毒的“容貌”来帮助它们逃过免疫系统的识别,这样做的目的是让溶瘤病毒能够发挥更加持久的抗肿瘤作用。另外,在使用溶瘤病毒的时候,还可以通过免疫抑制药物对宿主进行暂时的免疫抑制或者通过其他方法来弱化病毒激发的宿主免疫反应。
通过以上策略的改造和优化,科学家们已经制造出了许多高效而安全的溶瘤病毒。2005年11月,一个由腺病毒改造而来的溶瘤病毒H101已经经过卫生部门的审批,开始投入临床用于治疗难治性晚期鼻咽癌。还有相当数量非常具有潜力的溶瘤病毒正在进行临床前或者临床试验,并会在不久的将来走上临床,帮助人类抗击肿瘤。
作为一种新兴抗肿瘤治疗药物,溶瘤病毒仍然存在很多显而易见的问题,还无法在短时间内完全取代传统的放化疗法。然而,对肿瘤细胞杀伤效率高,靶向性好,安全性高,副作用小和成本低廉将会使得溶瘤病毒成为未来最具有潜力和应用前景的恶性肿瘤治疗手段之一。
(本文首发于2014年第三期《飞碟探索》)