第二节原子光谱和分子光谱
光谱按产生的基本粒子的不同可以分为
原子光谱
分子光谱
由于原子和分子的结 构不同,产生的光谱特征亦不同。
原子光谱
我们把原子核外电子在不同能级间跃迁而产生的光谱称之为原子光谱 , 它包括
原子发射光谱
原子吸收光谱
原子荧光光谱
X荧光分析
从经 典物理学得知,原子能级较为简单,电子在原子能级间的跃迁有两种类型,一种是
原子外层价电子的跃迁
基于这种跃迁而建立
原子吸收
原子发射
原子荧光
等光谱分析法。
第二种类型是基于电子在
原子内层跃迁
而建立的
x荧光分析法
本书主要讨论原子外层价电子的跃迁,也即讨论原子发射光谱、原子吸收光谱和原子荧光光谱。
电子的运动状态
描述核外电子运动状态用以下的四个方面来描述:
电子层
电子亚层和电子云的形状
电子云的伸展方向
电子的自旋
应与量子力学四个量子数(n, l, m, ms)相对应。
(1)主量子数(n)
—描述各(电子层)能量的高低和离核的远近.
原子核外电子按能级的高低分层分布,这种不同能级的层次习惯上称为电子层.
用统计观点来说,电子层是按电子出现几率较大的区域离核的远近来划分的.
主量子数的取值范围:
n=1,2,3,4,5,6……(除零以外的正整数).
在光谱学上另用一套拉丁字母表示电子层,其对应关系为:
主量子数(n) 1 2 3 4 5 6……
电子层 K L M N O P……
(2)副(角)量子数(l)
某一电子层内还存在着能量差别很小的若干个亚层,用 l 来描述.
副量子数的取值范围:
l=0,1,2……(n-1)的正整数.
L 的每一个数值表示一个亚层,也表示一种原子轨道或电子云的形状.
l与光谱学规定的亚层符号之间的对应关系为:
副量子数(l) 0 1 2 3 4 5……
亚层符号 s p d f g h……
(3)磁量子数(m)
同一亚层中有时还包含着若干个空间伸展方向不同的原子轨道.磁量子数用来描述原子轨道或电子云在空间的伸展方向.
磁量子数的取值范围:
m=0,±1,±2……±l的整数.
如:l=1,m=0,±1;表示p亚层有三个分别以y、z、x轴为对称轴的py、pz、px原子轨道,三个轨道的伸展方向互相垂直.
(4)自旋量子数(ms):
电子除绕核运动外,还有绕自身的轴旋转的运动,称自旋.
ms=+1/2和-1/2.
其中每一个数值表示电子的一种自旋方向,即顺时针和逆时针方向.
研究表明:同一原子中,各个电子的四个量子数不可能完全相同,即不可能有运动状态完全相同的电子.
由此可知:每一个轨道只能容纳两个自旋方向相反的电子.
原子的能态
原子最外层只有一个电子时,其能级可由四个量子数决定:
主量子数n
角量子数 l
磁量子数m
自旋量子数ms
对于具有多个价电子的原子,由于原子内各原子轨道和 电子自旋产生的磁场引起轨道磁矩和自旋磁矩间相互作用,各个电子运动状态的简单加 和不足以表达原子整体的运动状态。所以,必须使用另一套量子数
n, l, s, j
来表述 原子的整体运动状态,它可以与光谱实验观察别的结果直接联系起来。
主M子数n
角量子数l
总自旋量子数s
总内量子数j
原子光谱的产生
当原子未受外界能量作用的情况下,原子外层价电子一般都处于能级中最低的能量 状态,该能量状态称为原子基态,对应的能级称为原子基态能级。
按一定的量子规则, 当原子接受能量(例如,接受一束光的照射)后,电子跃迁到更高能童状态上,此能M 状态称为原子激发态,对应的能级称为原子激发态能级。
原子基态与原子激发态的能量 差一般为AE=1〜20eV,与紫外光或可见光的光子能量相对应。
原子对光的吸收和发射过程实际上是一个量子化过程。当原子接受到光子的相应能 量后,电子由原子基态跃迁到原子激发态。这个光子的能E光等于电子跃迁前处于某 能级能E1, 与跃迁后所处能级能量E2的差值AE。
吸收光谱分析时,E2>E1
发射光 谱分析时E2
因此,在光谱分析中,负载分析信息的分析光(即原子吸收或原子 发射)光子的能量E,负载了原子中这两个能级的能量之间能量差的特征信息。
跃迁是在符合选择定则的某两个能级间才能发生,它与某原子的本性有关,是某原 子的性质特征所决定的,因此利用原子光谱有可能作为定性分析的依据。
将原子对光吸 收或发射的量子化能级间跃迁过程中分析光能量强度和相应波长进行测量和记录就可得 到原子的吸收或发射光谱。
由于能级是分裂的、不连续的、量子化的,因此,理论上光 谱中各波长成分也是不连续的,每种波长成分只占据一个位置,形成一条谱带。每条谱 带相应于一种波长或一种能童的光子,对应于原子从一个能级跃迁至另一能级。
原子基 态与不同激发态之间的能量间距相差较大,是远远大于宽度约lXl(r3nm数量级的谱 线,因此原子光谱的特征是线状光谱
分子光谱
分子光谱的产生
分子内部运动可分为
价电子运动
分子内原子在其平衡位贯附近的振动
分子本身绕其重心的转动
因此,分子其有
电子能级
振动能级
转动能级
在辐射能作用下, 分子内能级间的跃迁产生的光谱称为分子光谱。
分子光谱则是由于
分子中电子能级
分子的振动
分子的转动能级
的变化而产生的光谱。属于分子光谱这类分析方法的有
紫外-可见分光光度分析法(UV-VIS)
红外光谱分析法(IR)
分子荧光分析法(MFS)
分子磷光分析法(MPS)
由于涉及的能级变化比较复杂,分子光谱为复杂的带光谱,带光谱是由许多
量子化的振动能级叠加在分子的基态电子能级上而形成的
它们 是由一系列靠得很近的线光谱组成,因使用的仪器不能分辨完全而呈现出带光谱。
(1) 线光谱
由若干条强度不同的谱线和暗区相间而成的光谱。
(2) 带状光谱
由几个光带和暗区相间而成的光谱。分子振动能级发生跃迁时,得 到的不是一条谱线,而是一组组密集的谱线、当仪器分辨率不高时,看到的是很宽的 谱带。
(3) 连续光谱
在一定范围内,各种波长的光都有,连续不断,无明显的谱线和 谱带。
不同分子能级结构的特征主要表现在能级结构层次的能量间距。
若以Ee,Ev,Er分别表示
电子能级
振动能级
转动能级
的能量值
价电子相邻电子能级间的能量差值较大,AE=l〜20eV,与紫外-可见光的光子能量相适应。
相邻振动能级间的能量差值比电子能级间的能量差值小,AE=0.05〜leV,与中红外区的光子能量相适应。
相邻转动能级间的能量差值最小,AE<0. 05eV,与远红外区的光子能量相适应。
分子在 每个电子能级上叠加了许多的振动能级,在振动能级上又叠加了许多转动能级。
不同的 分子,其电子、振动和转动能级的数it和能量值都是不相同的,与其分子本身的特征和 性质有关。
当分子未受外界能量作用的情况下,分子外层价电子一般都处于能级中最低的能童 状态,这时分子所处的能量状态称为分子基态。
按照一定的量子规则,当分子接受能量 (例如,接受一束光的照射)后,电子就会跃迁到更高的能量状态上,这时候分子的能 量状态称为分子激发态,对应的能级称为分子激发态能级。
与原子对光的吸收和发射过 程一样,分子对光的吸收和发射过程实际上也是量子化过程。当分子接受到光子的相应 能量后,电子由分子基态跃迁到分子激发态。
这个光子的能量E光等于电子跃迁前处于 某能级能量E1与跃迁后所处能级能量E2的差值AE。
吸收光谱分析时,E2>E1
发射光谱分析时,E2
因此,在光谱分析中,负载分析信息的分析光(即分子吸收或分 子发射)光子的能量E,负载了分子中这两个能级的能層:间距的特征信息。
跃迁是在符合选择定则的某两个能级间才能发生,它与某分子的本性有关,是某分 子的性质特征所决定,因此,利用分子光谱有可能作为定性分析的依据。
分子中的能量
分子中的能量主要由六部分组成,即
E=Ee+Ev+Er+En+Et-Ei
En一原子的核能;
Et一分子的平动能;
Ee一电子运动能;
Ev一原子间相对振动能;
Er一分子转动能;
Ei一基团间的内旋能。
在一般化学反应和一般化学实验条件下,En不发生变比,分子的平动能Et,和基团间的内旋能Ei较小,因此当分子能级发生跃迂时,能量的改变为:
E=Ee+Ev+Er
所以,分子产生跃迁所吸收能量的辐射频率:v=AEe/h+AEv/h + AEr/h
其中式中h为普朗克恒量。由此可知分子能级的变化可包括
电子能级的变化
振动能级的变化
转动能级的变化
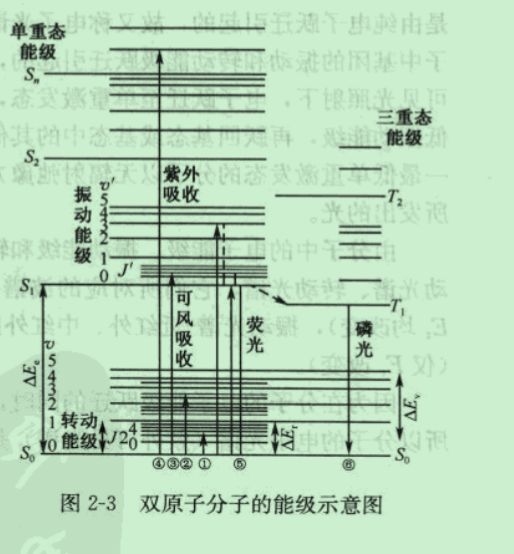
双原子分子能级图
分子中价电子位于自旋成对的单重基态S0。分子轨道上,当电子被激发到高能级上 时,若激发态与基态中的电子自旋方向相反,称为
单重激发态
以s,、s2、…表示, 反之,称为
三重激发态
以T1、T2、…表示
单重态分子具有抗磁性,三重态分子具 有顺磁性,跃迁致单重激发态的概率大,寿命长。
图为一双原子的能级示意图。
分子和原子一样有它的特征分子能级。在分子各能级中跃迁所获得的光谱,反映的信息是各不相同的。
电子光谱在紫外-可见波 区,故也称为紫外-可见光谱,反映了价电子 能量状况等信息,可给出物质的化学性质的信 息,主要用于定量测定,也可作为定性的 佐证。
振动光谱在红外波区,故也称红外光谱, 反映了分子中价键特性等结构信息,主要用于 定性分析,特别是分子特征基团的定性,定讲 结果的准确度和精度往往不如紫外-可见分光 光度分析法。
转动光谱在远红外波区,远红外 光谱反映了分子大小、键长度、折合质量等分 子特性的信息。
分子在辐射能的作用下总的内能变化为
E=Ee+Ev+Er
AEv—振动能级跃迁听引起的内能变化;
AEr——转动能级跃迁所引起的内能变化。
在光学光谱分析法中,通过所谓的原子化过程,将试样中的元素转化为气态原子或 简单离子,然后测定蒸气中原子
紫外可见吸收
发射
或荧光光谱。
在原子质谱法 中,也要将试样原子化,不过气态原子需要进一步转变为正离子,再按照它们的质荷比 不同进行分离,最后通过计算被分离的离子获得定量数据。
在X射线光谱法中,由于 大多数元素的X射线光谱在很大程度上与它们在试样中处于怎样的化学状态无关,故 不需要通过原于化,即能直接测定试样的荧光、吸收或发射光谱。
跃迁类型与分子光谱
分子光谱复杂,电子跃迁时带有振动和转动能级跃迁,分子的紫外-可见吸收光谱 是由纯电子跃迁引起的,故又称电子光谱,谱带比较宽,分子的红外吸收光谱是由于分 子中基团的振动和转动能级跃迁引起的,故也称振转光谱。分子的荧光光谱是在紫外或 可见光照射下,电子跃迁至单重激发态,并以无辐射弛豫方式回到第一单重激发态的最 低振动能级,再跃回基态或基态中的其他振动能级所发出的光。分子的磷光是指处于第 一最低单重激发态的分子以无辐射弛豫方式回到第一最低三重激发态,再跃迁回到基态 所发出的光。
由分子中的电子能级、振动能级和转动能级跃所产生的光谱分别称为电子光谱、振 动光谱、转动光谱,它们所对应的波谱区范围如下:电子光谱-紫外可见区(Ee、Ev、 均改变),振动光谱-近红外、中红外区(Ev、改变),转动光谱-远红外、微波区 (仅改变)。
因为在分子的电子能级跃迁的同时,总伴随着分子的振动能级和转动能级的跃迁, 所以分子的电子光谱(紫外可见光谱)是由许多线光谱聚集的谱带组成的。
因此,在光谱分析中,负载分析信息的分析光(即原子吸收或原子 发射)光子的能量E,负载了原子中这两个能级的能量之间能量差的特征信息。
跃迁是在符合选择定则的某两个能级间才能发生,它与某原子的本性有关,是某原 子的性质特征所决定的,因此利用原子光谱有可能作为定性分析的依据。
将原子对光吸 收或发射的量子化能级间跃迁过程中分析光能量强度和相应波长进行测量和记录就可得 到原子的吸收或发射光谱。
由于能级是分裂的、不连续的、量子化的,因此,理论上光 谱中各波长成分也是不连续的,每种波长成分只占据一个位置,形成一条谱带。每条谱 带相应于一种波长或一种能童的光子,对应于原子从一个能级跃迁至另一能级。
原子基 态与不同激发态之间的能量间距相差较大,是远远大于宽度约lXl(r3nm数量级的谱 线,因此原子光谱的特征是线状光谱
分子光谱
分子光谱的产生
分子内部运动可分为
价电子运动
分子内原子在其平衡位贯附近的振动
分子本身绕其重心的转动
因此,分子其有
电子能级
振动能级
转动能级
在辐射能作用下, 分子内能级间的跃迁产生的光谱称为分子光谱。
分子光谱则是由于
分子中电子能级
分子的振动
分子的转动能级
的变化而产生的光谱。属于分子光谱这类分析方法的有
紫外-可见分光光度分析法(UV-VIS)
红外光谱分析法(IR)
分子荧光分析法(MFS)
分子磷光分析法(MPS)
由于涉及的能级变化比较复杂,分子光谱为复杂的带光谱,带光谱是由许多
量子化的振动能级叠加在分子的基态电子能级上而形成的
它们 是由一系列靠得很近的线光谱组成,因使用的仪器不能分辨完全而呈现出带光谱。
(1) 线光谱
由若干条强度不同的谱线和暗区相间而成的光谱。
(2) 带状光谱
由几个光带和暗区相间而成的光谱。分子振动能级发生跃迁时,得 到的不是一条谱线,而是一组组密集的谱线、当仪器分辨率不高时,看到的是很宽的 谱带。
(3) 连续光谱
在一定范围内,各种波长的光都有,连续不断,无明显的谱线和 谱带。
不同分子能级结构的特征主要表现在能级结构层次的能量间距。
若以Ee,Ev,Er分别表示
电子能级
振动能级
转动能级
的能量值
价电子相邻电子能级间的能量差值较大,AE=l〜20eV,与紫外-可见光的光子能量相适应。
相邻振动能级间的能量差值比电子能级间的能量差值小,AE=0.05〜leV,与中红外区的光子能量相适应。
相邻转动能级间的能量差值最小,AE<0. 05eV,与远红外区的光子能量相适应。
分子在 每个电子能级上叠加了许多的振动能级,在振动能级上又叠加了许多转动能级。
不同的 分子,其电子、振动和转动能级的数it和能量值都是不相同的,与其分子本身的特征和 性质有关。
当分子未受外界能量作用的情况下,分子外层价电子一般都处于能级中最低的能童 状态,这时分子所处的能量状态称为分子基态。
按照一定的量子规则,当分子接受能量 (例如,接受一束光的照射)后,电子就会跃迁到更高的能量状态上,这时候分子的能 量状态称为分子激发态,对应的能级称为分子激发态能级。
与原子对光的吸收和发射过 程一样,分子对光的吸收和发射过程实际上也是量子化过程。当分子接受到光子的相应 能量后,电子由分子基态跃迁到分子激发态。
这个光子的能量E光等于电子跃迁前处于 某能级能量E1与跃迁后所处能级能量E2的差值AE。
吸收光谱分析时,E2>E1
发射光谱分析时,E2
因此,在光谱分析中,负载分析信息的分析光(即分子吸收或分 子发射)光子的能量E,负载了分子中这两个能级的能層:间距的特征信息。
跃迁是在符合选择定则的某两个能级间才能发生,它与某分子的本性有关,是某分 子的性质特征所决定,因此,利用分子光谱有可能作为定性分析的依据。
分子中的能量
分子中的能量主要由六部分组成,即
E=Ee+Ev+Er+En+Et-Ei
En一原子的核能;
Et一分子的平动能;
Ee一电子运动能;
Ev一原子间相对振动能;
Er一分子转动能;
Ei一基团间的内旋能。
在一般化学反应和一般化学实验条件下,En不发生变比,分子的平动能Et,和基团间的内旋能Ei较小,因此当分子能级发生跃迂时,能量的改变为:
E=Ee+Ev+Er
所以,分子产生跃迁所吸收能量的辐射频率:v=AEe/h+AEv/h + AEr/h
其中式中h为普朗克恒量。由此可知分子能级的变化可包括
电子能级的变化
振动能级的变化
转动能级的变化
双原子分子能级图
分子中价电子位于自旋成对的单重基态S0。分子轨道上,当电子被激发到高能级上 时,若激发态与基态中的电子自旋方向相反,称为
单重激发态
以s,、s2、…表示, 反之,称为
三重激发态
以T1、T2、…表示
单重态分子具有抗磁性,三重态分子具 有顺磁性,跃迁致单重激发态的概率大,寿命长。
图为一双原子的能级示意图。
分子和原子一样有它的特征分子能级。在分子各能级中跃迁所获得的光谱,反映的信息是各不相同的。
电子光谱在紫外-可见波 区,故也称为紫外-可见光谱,反映了价电子 能量状况等信息,可给出物质的化学性质的信 息,主要用于定量测定,也可作为定性的 佐证。
振动光谱在红外波区,故也称红外光谱, 反映了分子中价键特性等结构信息,主要用于 定性分析,特别是分子特征基团的定性,定讲 结果的准确度和精度往往不如紫外-可见分光 光度分析法。
转动光谱在远红外波区,远红外 光谱反映了分子大小、键长度、折合质量等分 子特性的信息。
分子在辐射能的作用下总的内能变化为
E=Ee+Ev+Er
AEv—振动能级跃迁听引起的内能变化;
AEr——转动能级跃迁所引起的内能变化。
在光学光谱分析法中,通过所谓的原子化过程,将试样中的元素转化为气态原子或 简单离子,然后测定蒸气中原子
紫外可见吸收
发射
或荧光光谱。
在原子质谱法 中,也要将试样原子化,不过气态原子需要进一步转变为正离子,再按照它们的质荷比 不同进行分离,最后通过计算被分离的离子获得定量数据。
在X射线光谱法中,由于 大多数元素的X射线光谱在很大程度上与它们在试样中处于怎样的化学状态无关,故 不需要通过原于化,即能直接测定试样的荧光、吸收或发射光谱。
跃迁类型与分子光谱
分子光谱复杂,电子跃迁时带有振动和转动能级跃迁,分子的紫外-可见吸收光谱 是由纯电子跃迁引起的,故又称电子光谱,谱带比较宽,分子的红外吸收光谱是由于分 子中基团的振动和转动能级跃迁引起的,故也称振转光谱。分子的荧光光谱是在紫外或 可见光照射下,电子跃迁至单重激发态,并以无辐射弛豫方式回到第一单重激发态的最 低振动能级,再跃回基态或基态中的其他振动能级所发出的光。分子的磷光是指处于第 一最低单重激发态的分子以无辐射弛豫方式回到第一最低三重激发态,再跃迁回到基态 所发出的光。
由分子中的电子能级、振动能级和转动能级跃所产生的光谱分别称为电子光谱、振 动光谱、转动光谱,它们所对应的波谱区范围如下:电子光谱-紫外可见区(Ee、Ev、 均改变),振动光谱-近红外、中红外区(Ev、改变),转动光谱-远红外、微波区 (仅改变)。
因为在分子的电子能级跃迁的同时,总伴随着分子的振动能级和转动能级的跃迁, 所以分子的电子光谱(紫外可见光谱)是由许多线光谱聚集的谱带组成的。
因此,在光谱分析中,负载分析信息的分析光(即分子吸收或分 子发射)光子的能量E,负载了分子中这两个能级的能層:间距的特征信息。
跃迁是在符合选择定则的某两个能级间才能发生,它与某分子的本性有关,是某分 子的性质特征所决定,因此,利用分子光谱有可能作为定性分析的依据。
分子中的能量
分子中的能量主要由六部分组成,即
E=Ee+Ev+Er+En+Et-Ei
En一原子的核能;
Et一分子的平动能;
Ee一电子运动能;
Ev一原子间相对振动能;
Er一分子转动能;
Ei一基团间的内旋能。
在一般化学反应和一般化学实验条件下,En不发生变比,分子的平动能Et,和基团间的内旋能Ei较小,因此当分子能级发生跃迂时,能量的改变为:
E=Ee+Ev+Er
所以,分子产生跃迁所吸收能量的辐射频率:v=AEe/h+AEv/h + AEr/h
其中式中h为普朗克恒量。由此可知分子能级的变化可包括
电子能级的变化
振动能级的变化
转动能级的变化
双原子分子能级图
分子中价电子位于自旋成对的单重基态S0。分子轨道上,当电子被激发到高能级上 时,若激发态与基态中的电子自旋方向相反,称为
单重激发态
以s,、s2、…表示, 反之,称为
三重激发态
以T1、T2、…表示
单重态分子具有抗磁性,三重态分子具 有顺磁性,跃迁致单重激发态的概率大,寿命长。
图为一双原子的能级示意图。
分子和原子一样有它的特征分子能级。在分子各能级中跃迁所获得的光谱,反映的信息是各不相同的。
电子光谱在紫外-可见波 区,故也称为紫外-可见光谱,反映了价电子 能量状况等信息,可给出物质的化学性质的信 息,主要用于定量测定,也可作为定性的 佐证。
振动光谱在红外波区,故也称红外光谱, 反映了分子中价键特性等结构信息,主要用于 定性分析,特别是分子特征基团的定性,定讲 结果的准确度和精度往往不如紫外-可见分光 光度分析法。
转动光谱在远红外波区,远红外 光谱反映了分子大小、键长度、折合质量等分 子特性的信息。
分子在辐射能的作用下总的内能变化为
E=Ee+Ev+Er
AEv—振动能级跃迁听引起的内能变化;
AEr——转动能级跃迁所引起的内能变化。
在光学光谱分析法中,通过所谓的原子化过程,将试样中的元素转化为气态原子或 简单离子,然后测定蒸气中原子
紫外可见吸收
发射
或荧光光谱。
在原子质谱法 中,也要将试样原子化,不过气态原子需要进一步转变为正离子,再按照它们的质荷比 不同进行分离,最后通过计算被分离的离子获得定量数据。
在X射线光谱法中,由于 大多数元素的X射线光谱在很大程度上与它们在试样中处于怎样的化学状态无关,故 不需要通过原于化,即能直接测定试样的荧光、吸收或发射光谱。
跃迁类型与分子光谱
分子光谱复杂,电子跃迁时带有振动和转动能级跃迁,分子的紫外-可见吸收光谱 是由纯电子跃迁引起的,故又称电子光谱,谱带比较宽,分子的红外吸收光谱是由于分 子中基团的振动和转动能级跃迁引起的,故也称振转光谱。分子的荧光光谱是在紫外或 可见光照射下,电子跃迁至单重激发态,并以无辐射弛豫方式回到第一单重激发态的最 低振动能级,再跃回基态或基态中的其他振动能级所发出的光。分子的磷光是指处于第 一最低单重激发态的分子以无辐射弛豫方式回到第一最低三重激发态,再跃迁回到基态 所发出的光。
由分子中的电子能级、振动能级和转动能级跃所产生的光谱分别称为电子光谱、振 动光谱、转动光谱,它们所对应的波谱区范围如下:电子光谱-紫外可见区(Ee、Ev、 均改变),振动光谱-近红外、中红外区(Ev、改变),转动光谱-远红外、微波区 (仅改变)。
因为在分子的电子能级跃迁的同时,总伴随着分子的振动能级和转动能级的跃迁, 所以分子的电子光谱(紫外可见光谱)是由许多线光谱聚集的谱带组成的。