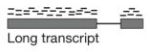
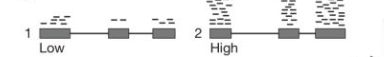
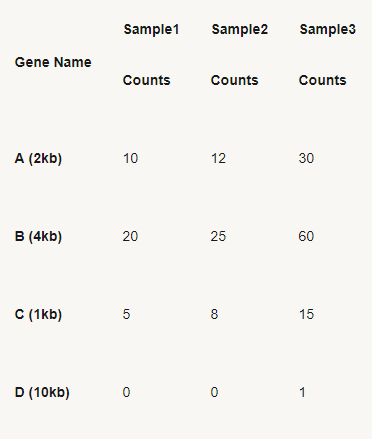
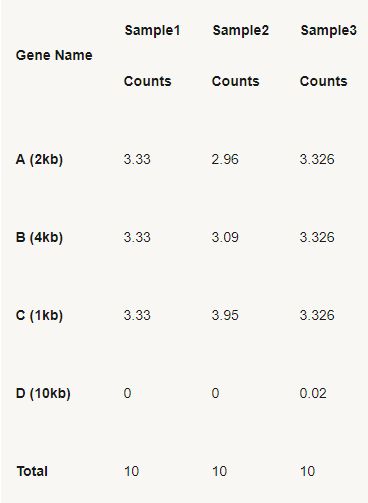
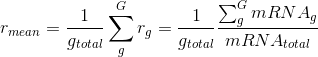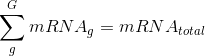- #爱思沐正向养育90天父母成长营day20#
ZY的简书
#爱思沐正向养育90天父母成长营day20#2019/11/15周五事件记录昨晚妹妹说要泡泡浴,我就给她准备了。怕她凉,水放得温度稍微高一点。她一下水就说太烫,我加了两次冷水,她还是觉得太烫。我用手试温度,觉得不烫了,要她坐下去。没一会她就受不了,说太烫了屁屁都痛了,不泡要起来。我觉得她太矫情,放了那么久的水,却几乎没咋泡。穿衣服时她还在说烫,后来仔细一看皮肤有点儿红,想想她是比较敏感的,包括对水
- 坐问圣函
圣函
图片发自App我独自坐在石台上,对圣函问:如果给予你后悔的机会,你可以回到过去,并改变你某一点的人生轨迹。如今你思念的亲人,你可以选择用更多的时间去陪伴;你所做错过的事情,你可以回去更改;在恰当的时间却没勇气说出的那句话,你可以鼓起勇气去对那个人说;你回首往事时对曾经自己的建议,你可以回去亲自践行......你愿意吗?圣函回答:我不愿意。由于生活种种经历的巧合,让我拥有了如今的思想,我便感谢任何一
- 学点心理学,生活更健康
上山打老虎_9cc7
心理学为我种下了一颗生命力的种子,那种感觉像有一颗绿色的种子在思想中疯狂地生长,长出枝干,长出绿叶,周围水气弥漫,给荒漠的心灵带来了水源和野性,原来光秃秃的山峦被一个个巨大的绿色触须拦腰穿过,暴风雨后,生机勃勃。这是学习《武志红的心理学课》后,我闭上眼睛脑中想到的画面。直观而震撼,心理学给了我很多地道、刁钻的角度来看待自己、看待生活、看待关系。我知道了过去我性格形成的原因,也知道了我那“含蓄”表达
- 拼多多超级神券领取入口,千万神券活动地址已更新!
小小编007
拼多多超级神券是给第三方返利平台的推广活动,消费者在返利app上可以领取拼多多超级千万神券,也可以分享这些神券赚钱。消费者自己是无法在拼多多app找到千万神券领取入口的,只能借助第三方返利软件。如上图所示,不仅领完神券后价格便宜,还有高达10%左右的返利可拿。如果遇到每个月的收益翻倍周,就是20%的返利了。拼多多第三方返利软件选择哪个好?小编推荐:果冻宝盒首先:果冻宝盒是一个综合导购返利软件app
- FATAL ERROR: Reached heap limit Allocation failed - JavaScript heap out of memory node编译时的内存溢出
周不凢
nodenode.js
报错:FATALERROR:ReachedheaplimitAllocationfailed-JavaScriptheapoutofmemory原因:node编译时的内存溢出,因为打包文件过大,刚好超过内存的限制大小造成编译中断。解决方法1:通过package.json中的"build"加大内存增加--max_old_space_size参"scripts":{"dev":"nodebuild/d
- 2021,致自己!!(是不是说出了你的心声)
爱阅读的花宝
又一年快要结束了,回头看,自己也没有活成自己想要的样子,生活依旧艰难。道理是明白了很多,却从来没有向谁说起过,理清思维,还是觉得自己一无所获。2021年,能活下来,已经很不容易,经济沦陷的时候,自己还能活着,没有委屈自己,已是难得。这一年,我一直苟活着,不为谁活,因为我知道,无论我活得再糟糕,别人都认为是应该。别人活得再努力,再不济,也没有人能为你活?这一年,我一直在思考,我该在乎什么?最后自己明
- 如何从热恋走向婚姻结婚,并一直幸福?
有才有闲
↑推荐阅读↑如何在荷尔蒙降低后还能保持甜蜜?爱情中的甜言蜜语和承诺,能不能在婚姻中兑现和延续,取决于双方会不会经营婚姻。只要会经营,还有可能超额完成任务。当然,还有个前提是双方都愿意并且会经营婚姻。(提示:婚姻经营是一门需要学习的学问)这里需要提到在一段关系中我们常说的四个时期:相爱期:大家用尽各种方法得到对方。热恋期:荷尔蒙爆发,粘在一起,什么都没法分开,越反对反而粘的越紧。磨合期:大多数人进入
- Redux-thunk:10行代码重构异步控制权
止观止
#React核心原理深度剖析reactreduxreact-thunk状态管理前端
redux-thunk作为Redux生态中最精简的异步处理中间件,其核心价值源于对“函数型Action”的设计突破。这种范式通过将传统的静态Action对象转化为动态可执行函数,为Redux的单向数据流注入了异步控制能力,成为中小型项目异步管理的首选方案。⚙️一、核心设计:函数型Action(ActionasFunction)传统ReduxAction本质是携带{type,payload}的静态数
- 第一次和家长吵架
微笑向暖f
现在还在想自己做的是否正确?对待学生以及家长该有个什么样的度!一个独生子女,只能看到别人的错误,却找不到自己的原因,或者嘴上说着是自己不对,一句带过之后说的全是别人的不对,孩子是这样,母亲是这样,这样的孩子还有救吗?本身出于好心,孩子哭着说要来我们这个班,心软,就同意了,今天和家长吵完,又感觉孩子还是孩子,还想让她好,家长又说好话,也就原谅了。可是,我这样会不会让那些不明事理的家长以为是我的软弱,
- 深度对比:innerHTML vs 虚拟DOM——原理、性能与应用全解析
止观止
前端前端框架前端html5javascriptreactjsxss
引言在现代Web开发中,高效操作DOM(文档对象模型)是构建高性能应用的关键。传统方法如innerHTML和新兴的虚拟DOM(VirtualDOM)技术代表了两种截然不同的DOM更新策略。innerHTML作为浏览器原生API,直接操纵HTML字符串;虚拟DOM则是通过JavaScript对象树进行优化更新,广泛应用于React、Vue等框架。本文深入对比两者的核心原理、技术细节、应用场景及优劣,
- React响应式组件范式:从类组件到Hooks
止观止
#React核心原理深度剖析react.jsjavascriptecmascript
引言在UI开发中,"状态变化自动触发UI更新"的响应式机制是构建动态界面的核心。React通过独特的单向数据流和虚拟DOM(VirtualDOM)实现这一目标,但类组件(ClassComponents)与Hooks分别代表了两种截然不同的实现范式:类组件时代:以生命周期方法作为响应式调度器,需手动管理状态与副作用(SideEffects)的同步Hooks时代:以状态为驱动核心,通过声明式副作用(D
- 房价不降降首付,多城调整公积金贷款额度,房地产真的不能倒?
李云飞
作者:李云飞|来源:原创一位久经商场的创业老司机,关注我,每天分享一点财富干货,让你的人生少走弯路。我们刚迈进2022年,多个城市就先后发布了公积金贷款新政策,明确放宽了公积金贷款要求。比如某些城市就通告,缴存职工家庭购买第二套住房或申请第二次住房公积金贷款的,最低首付款比例由原来60%下调到40%。还有些城市通告,首套房首付款比例不得低于住房价值的20%,二套房首付款比例不得低于住房价值的40%
- InnoDB引擎B+树索引使用和新特性
蜜獾互联网
MySqlb树数据结构
B+树索引的管理我们在InnoDB引擎中常用的索引基本都是B+树索引。创建和删除索引它的创建和删除有两种方法:#方式一:altertable,此时index和key均可以,如果要求所有值均不重复,加上uniquealtertabletbl_nameadd[unique]index|keyindex_name(index_col_name,...);altertabletbl_namedropind
- 娶个比自己小十几岁的媳妇是什么感受?三个过来人说出心里话!
喵咪说情
都说“男人四十一枝花,女人四十豆腐渣!”很多的男人哪怕到了40岁,只要保养的好。看上去还显得更有魅力,成熟稳重,更吸引小女孩的眼光。于是,很多男人即使四五十岁了,也还是能娶到20多岁的女孩子。过上让人羡慕的老夫少妻生活。那么,到底娶个比自己小十几二十岁的男人们,婚后的日子过得怎么样呢?他们幸福吗?还是也有不如意的地方,看看过来人的经历吧!1.很累,但是依然觉得幸福!徐先生表示自己妻子比他小20岁。
- 每个人生命中都会有过客离去,而我还要暗自欢喜
夏观龄
有没有什么时候看见街上的人欢欢喜喜,你会不会感到有些孤独,看着他人的热闹,独尝失落的滋味,心有时像被微微的凉风拂过,没来由的,你会有些不自在,也会有些消极也许不止我一个人会有这样的感受,但是我在上大学的时候,真真实实的,会有这样的感受后来,我不想沉溺于情绪低落的苦海,我既觉得自己无聊又幼稚,可又常常的难以自拔于是,我想要打破这种生活状态,我会和三四年没有联系过的朋友联系,会和老朋友诉苦,甚至和陌生
- 易效能亲子时间管理践行第9天
彼岸花践行日记
高效率慢生活就寝10:00早起6:30要有多自律就有多自由今日早起外面雾气漫天图片发自App第一个30天目标:孩子第一个30天目标:学会看清单妈妈第一个30天目标:每天写【今日青蛙】♀️早起写♀️参加天使班入门营毕业班会周打卡记录显示的起床时间比之前要早这个点早起时间还是不够用【健康】一杯五谷粉【学习】樊登读书会听书图片发自App【小确幸】由于开学初期较忙,新生还没有开始报名入园,只能先把宝贝
- 工具篇:(八)MacOS 上使用 Docker 容器化 Node.js 应用的完整指南
全栈探索者chen
工具macosdockermacosdockernode.js程序人生容器
MacOS上使用Docker容器化Node.js应用的完整指南在现代应用开发中,Docker已成为一种流行的工具,它使得开发、测试和部署应用程序变得更加高效和灵活。本文将详细介绍如何在MacOS上安装Docker,并演示如何将Node.js应用容器化、构建Docker镜像以及管理容器。一、安装Docker下载DockerDesktop前往Docker官方网站下载适用于MacOS的DockerDes
- C 语言字符大小写互转:tolower / toupper 详解与实战
BabyZZの秘密日记
C语言c语言开发语言
个人主页:BabyZZの秘密日记收入专栏:C语言文章目入一、函数原型二、实现原理(glibc2.39源码节选)三、常见陷阱与最佳实践四、完整示例:大小写不敏感查找子串五、性能扩展:批量转换的SIMD思路六、小结在文本处理、协议解析、命令行解析等场景中,“大小写不敏感”是十分常见的需求。C标准库提供了两个最常用的工具函数:inttolower(intc);——大写→小写inttoupper(intc
- 你想上九天揽月为女儿摘星星?还是愿陪在女儿身边看星星?在线留言。
石头老师333
经过6个月、183天、4392分的日夜思念。那个为女儿摘星星的妈妈回来了。王亚平的女儿五岁。我们都知道的,五岁的孩子正是最为黏妈妈的时候。我难以想象在夜半无人时,亚平的五岁孩子仰望漫天繁星,想念着妈妈,一颗一颗的看着星星,数着星星,想象着妈妈在哪个星星旁?在寻找妈妈的踪影和等待妈妈归来拥抱自己的孤单里入眠。我也难以想象在漫天星河里,做完一天工作之后的王亚平化身为02号,遥望地球,思念五岁女儿时的所
- 6月25日(第38天)三省吾身
快乐姐星球
一.观人善(阳红梅老师)工作认真负责,性格直爽,有啥说啥,没心计,每天阳光灿烂,与人为善,对孩子很用心,很随和,很乐意助人二.察己过:天热心情烦躁三.日行一善:给朋友分享学校四.为学日益:学习临终安宁缓和医疗课程五.为道日损:天热对学生多一点耐心六.感恩:感恩秀田的自然万物,感恩学校的学生让我有机会种福田,感恩梁老师做了好吃的凉粉
- 拆分
凤晴天
举个例子来说明:银行贷给A企业一年期贷款1000万,而A企业暂时只使用100万,其他钱照样存银行,银行就可以将剩下的钱,再贷给其他企业,其他企业又只用100万元,其他钱再存银行,如此贷存贷存循环下去,就会产生神奇的货币乘法效应,这就是货币创造。这个道理和楼市是一样的。比如我买了一套100万的房屋,我明明有100万现金,但是我不用,我只拿出20万付首付,剩下的钱存银行。然后我去银行贷款80万,用来买
- 《历史》与《春秋》札记(二十五)
刘子曰_b08e
十年春王正月,庚申,曹伯終生卒。夏五月,葬曹桓公。秋,公會衛侯於桃丘,弗遇。冬十有二月丙午,齊侯、衛侯、鄭伯來戰於郎。鲁桓公十年春季周王历正月,庚申这一天,曹国君终生死了。这里用了周王历,不知何意?夏季五月,曹国安葬国君终生,谥号曹桓公。秋季,鲁桓公想在桃丘和卫国国君会面,没有遇见卫君。冬季十二月丙午这天,齐国君、卫国君、郑国国君带着军队在郎这个地方跟鲁国交战。这是因为鲁桓公不守礼法得罪了郑国国君
- 行舟乐评:中国摇滚史上10位杰出摇滚女声(三)
行舟乐评
行舟:中国90后学院派欧美音乐乐评人对于“中国摇滚史上10位杰出摇滚女生”的话题,我们今天继续进行,而我们今天要说一说:冷酷了一个时代的-肖楠&将北京朋克摇滚乐推向世界的旗手-王悦(GiaWang)。1、肖楠-中国第一支女子乐队“眼镜蛇”主唱肖楠在2016年更名为肖樱竺。曾是八十年代文工团里一员,本可以安稳地活在体制内波澜不惊,却与眼镜蛇乐队里其它的成员,因共同的爱好组建了中国第一支女子摇滚乐队。
- 瞎记吧~
Limbes
#我们在上个单元讲到的大马哈鱼从河口一直游到河的源头的过程,可以说干难万险,而且随时可能丧命,那它到底为了什么?真的值得吗?以旁观者的角度来看,大马哈鱼的这些勇敢、可歌可泣的行为,其实没有属于个体的愿望和利益,它是在预装的程序驱使下在做所有这些事情。大马哈鱼洄游的过程,其实是一场没有赢家的戏剧:只要大马哈鱼进到河口,就意味着它们都要死去,只不过死去时间的早晚不同而已。除了最早被淘汰的一批,在洄游的
- 复刻名牌包包多少钱,复刻名牌女包什么价格
桃朵桃朵
在当今社会,复刻名牌包包已经成为一种时尚和品味的象征。越来越多的人开始关注复刻名牌包包的价格,尤其是复刻名牌女包的价格。那么,复刻名牌包包多少钱呢?复刻名牌女包又是什么价格呢?微信:14527486(下单赠送精美礼品)首先,我们需要了解什么是复刻名牌包包。复刻是指重新制造或复制某种品牌或款式的商品,而名牌则是指具有一定知名度和声誉的品牌。因此,复刻名牌包包就是指复制某种知名品牌包包的款式和设计,但
- 《麋鹿拾盐》
大魔魔
图片发自App湿地,麋鹿从草间泥土里生长任秋草秋黄,黄昏里昏黄模样而你,一只麋鹿——一方盐场收集,秋去冬又来的茫茫里任白雪茫茫,覆盖重重脚印而我,绿水瀛洲,拂袖而长廊只窃取一瓢绿水,浇长樱花入睡再取一撮盐入味,樱木长根久违而之后,折一朵樱花,牵引你回家等你,麋鹿已留长了头发等了泪目了花,花又非花湿泥,只有嫩草还在发芽终于,掩盖了我来时的样子抹去了你的痕迹,藏在盐里回忆,鹤啸九天,麋鹿拾盐图片发自A
- 【MySQL】性能优化实战指南:释放数据库潜能的艺术
文章目录MySQL性能优化实战指南:释放数据库潜能的艺术引言为什么需要MySQL性能优化?性能优化基础知识MySQL性能瓶颈分析1.硬件资源瓶颈2.MySQL内部瓶颈优化配置策略大全内存配置优化InnoDB缓冲池配置查询缓存配置连接和线程配置磁盘I/O优化InnoDB存储引擎配置临时表配置独特优化创意配置创意1:分层存储优化创意2:动态配置自适应创意3:负载感知配置高级优化技巧并行处理优化索引和查
- 空指针异常是Java中很常见的异常,如何避免?
破碎的天堂鸟
Java学习java数据库jvm
在Java编程中,空指针异常(NullPointerException)是一种常见的运行时异常,通常发生在尝试访问一个空对象的属性或调用其方法时。为了避免这种异常,可以采取以下几种方法:在使用对象之前,先判断该对象是否为null。例如:if(obj!=null){//对obj进行操作}这种方法是最直接且最常用的方法。Java8引入了Optional类,它提供了一种更优雅的方式来处理可能为空的对象。
- Java:实现朴素模式匹配算法(附带源码)
Katie。
Java算法完整教程算法javapython
1.项目背景详细介绍在文本处理、信息检索和生物序列分析等领域,“字符串模式匹配”是最基础也是最核心的操作之一。朴素模式匹配(NaiveStringMatching)算法,作为最直观的实现方式,通过逐个字符对比,查找模式串在目标文本中出现的位置。虽然现代应用中普遍采用更高效的KMP、Boyer–Moore、Sunday算法等,但理解并掌握朴素算法有助于:打牢基础:从最简单的实现入手,帮助初学者理解匹
- 闺女成长日记3月22日
很爱闺女
今天继续和闺女的磨蹭作斗争,下午闺女回家特别开心的告诉我,今天的作业不多又在学校里做了一些,这次是绝对会一个小时就做完。然后又是吃水果又是上厕所的,你要开始写作业吗?她还在那没吃够又想吃奶糖了,看看家里没有了,想要又不敢说,我借机说写作业认真可以吃糖,这娃娃一听眼睛立马就放光了,开始写的时候已经磨叽了半个小时了,写作业再少时间也不够了又着急出门买糖,写作业马虎的错的太多改了好几次,待写完作业已经六
- 怎么样才能成为专业的程序员?
cocos2d-x小菜
编程PHP
如何要想成为一名专业的程序员?仅仅会写代码是不够的。从团队合作去解决问题到版本控制,你还得具备其他关键技能的工具包。当我们询问相关的专业开发人员,那些必备的关键技能都是什么的时候,下面是我们了解到的情况。
关于如何学习代码,各种声音很多,然后很多人就被误导为成为专业开发人员懂得一门编程语言就够了?!呵呵,就像其他工作一样,光会一个技能那是远远不够的。如果你想要成为
- java web开发 高并发处理
BreakingBad
javaWeb并发开发处理高
java处理高并发高负载类网站中数据库的设计方法(java教程,java处理大量数据,java高负载数据) 一:高并发高负载类网站关注点之数据库 没错,首先是数据库,这是大多数应用所面临的首个SPOF。尤其是Web2.0的应用,数据库的响应是首先要解决的。 一般来说MySQL是最常用的,可能最初是一个mysql主机,当数据增加到100万以上,那么,MySQL的效能急剧下降。常用的优化措施是M-S(
- mysql批量更新
ekian
mysql
mysql更新优化:
一版的更新的话都是采用update set的方式,但是如果需要批量更新的话,只能for循环的执行更新。或者采用executeBatch的方式,执行更新。无论哪种方式,性能都不见得多好。
三千多条的更新,需要3分多钟。
查询了批量更新的优化,有说replace into的方式,即:
replace into tableName(id,status) values
- 微软BI(3)
18289753290
微软BI SSIS
1)
Q:该列违反了完整性约束错误;已获得 OLE DB 记录。源:“Microsoft SQL Server Native Client 11.0” Hresult: 0x80004005 说明:“不能将值 NULL 插入列 'FZCHID',表 'JRB_EnterpriseCredit.dbo.QYFZCH';列不允许有 Null 值。INSERT 失败。”。
A:一般这类问题的存在是
- Java中的List
g21121
java
List是一个有序的 collection(也称为序列)。此接口的用户可以对列表中每个元素的插入位置进行精确地控制。用户可以根据元素的整数索引(在列表中的位置)访问元素,并搜索列表中的元素。
与 set 不同,列表通常允许重复
- 读书笔记
永夜-极光
读书笔记
1. K是一家加工厂,需要采购原材料,有A,B,C,D 4家供应商,其中A给出的价格最低,性价比最高,那么假如你是这家企业的采购经理,你会如何决策?
传统决策: A:100%订单 B,C,D:0%
&nbs
- centos 安装 Codeblocks
随便小屋
codeblocks
1.安装gcc,需要c和c++两部分,默认安装下,CentOS不安装编译器的,在终端输入以下命令即可yum install gccyum install gcc-c++
2.安装gtk2-devel,因为默认已经安装了正式产品需要的支持库,但是没有安装开发所需要的文档.yum install gtk2*
3. 安装wxGTK
yum search w
- 23种设计模式的形象比喻
aijuans
设计模式
1、ABSTRACT FACTORY—追MM少不了请吃饭了,麦当劳的鸡翅和肯德基的鸡翅都是MM爱吃的东西,虽然口味有所不同,但不管你带MM去麦当劳或肯德基,只管向服务员说“来四个鸡翅”就行了。麦当劳和肯德基就是生产鸡翅的Factory 工厂模式:客户类和工厂类分开。消费者任何时候需要某种产品,只需向工厂请求即可。消费者无须修改就可以接纳新产品。缺点是当产品修改时,工厂类也要做相应的修改。如:
- 开发管理 CheckLists
aoyouzi
开发管理 CheckLists
开发管理 CheckLists(23) -使项目组度过完整的生命周期
开发管理 CheckLists(22) -组织项目资源
开发管理 CheckLists(21) -控制项目的范围开发管理 CheckLists(20) -项目利益相关者责任开发管理 CheckLists(19) -选择合适的团队成员开发管理 CheckLists(18) -敏捷开发 Scrum Master 工作开发管理 C
- js实现切换
百合不是茶
JavaScript栏目切换
js主要功能之一就是实现页面的特效,窗体的切换可以减少页面的大小,被门户网站大量应用思路:
1,先将要显示的设置为display:bisible 否则设为none
2,设置栏目的id ,js获取栏目的id,如果id为Null就设置为显示
3,判断js获取的id名字;再设置是否显示
代码实现:
html代码:
<di
- 周鸿祎在360新员工入职培训上的讲话
bijian1013
感悟项目管理人生职场
这篇文章也是最近偶尔看到的,考虑到原博客发布者可能将其删除等原因,也更方便个人查找,特将原文拷贝再发布的。“学东西是为自己的,不要整天以混的姿态来跟公司博弈,就算是混,我觉得你要是能在混的时间里,收获一些别的有利于人生发展的东西,也是不错的,看你怎么把握了”,看了之后,对这句话记忆犹新。 &
- 前端Web开发的页面效果
Bill_chen
htmlWebMicrosoft
1.IE6下png图片的透明显示:
<img src="图片地址" border="0" style="Filter.Alpha(Opacity)=数值(100),style=数值(3)"/>
或在<head></head>间加一段JS代码让透明png图片正常显示。
2.<li>标
- 【JVM五】老年代垃圾回收:并发标记清理GC(CMS GC)
bit1129
垃圾回收
CMS概述
并发标记清理垃圾回收(Concurrent Mark and Sweep GC)算法的主要目标是在GC过程中,减少暂停用户线程的次数以及在不得不暂停用户线程的请夸功能,尽可能短的暂停用户线程的时间。这对于交互式应用,比如web应用来说,是非常重要的。
CMS垃圾回收针对新生代和老年代采用不同的策略。相比同吞吐量垃圾回收,它要复杂的多。吞吐量垃圾回收在执
- Struts2技术总结
白糖_
struts2
必备jar文件
早在struts2.0.*的时候,struts2的必备jar包需要如下几个:
commons-logging-*.jar Apache旗下commons项目的log日志包
freemarker-*.jar
- Jquery easyui layout应用注意事项
bozch
jquery浏览器easyuilayout
在jquery easyui中提供了easyui-layout布局,他的布局比较局限,类似java中GUI的border布局。下面对其使用注意事项作简要介绍:
如果在现有的工程中前台界面均应用了jquery easyui,那么在布局的时候最好应用jquery eaysui的layout布局,否则在表单页面(编辑、查看、添加等等)在不同的浏览器会出
- java-拷贝特殊链表:有一个特殊的链表,其中每个节点不但有指向下一个节点的指针pNext,还有一个指向链表中任意节点的指针pRand,如何拷贝这个特殊链表?
bylijinnan
java
public class CopySpecialLinkedList {
/**
* 题目:有一个特殊的链表,其中每个节点不但有指向下一个节点的指针pNext,还有一个指向链表中任意节点的指针pRand,如何拷贝这个特殊链表?
拷贝pNext指针非常容易,所以题目的难点是如何拷贝pRand指针。
假设原来链表为A1 -> A2 ->... -> An,新拷贝
- color
Chen.H
JavaScripthtmlcss
<!DOCTYPE HTML PUBLIC "-//W3C//DTD HTML 4.01 Transitional//EN" "http://www.w3.org/TR/html4/loose.dtd"> <HTML> <HEAD>&nbs
- [信息与战争]移动通讯与网络
comsci
网络
两个坚持:手机的电池必须可以取下来
光纤不能够入户,只能够到楼宇
建议大家找这本书看看:<&
- oracle flashback query(闪回查询)
daizj
oracleflashback queryflashback table
在Oracle 10g中,Flash back家族分为以下成员:
Flashback Database
Flashback Drop
Flashback Table
Flashback Query(分Flashback Query,Flashback Version Query,Flashback Transaction Query)
下面介绍一下Flashback Drop 和Flas
- zeus持久层DAO单元测试
deng520159
单元测试
zeus代码测试正紧张进行中,但由于工作比较忙,但速度比较慢.现在已经完成读写分离单元测试了,现在把几种情况单元测试的例子发出来,希望有人能进出意见,让它走下去.
本文是zeus的dao单元测试:
1.单元测试直接上代码
package com.dengliang.zeus.webdemo.test;
import org.junit.Test;
import o
- C语言学习三printf函数和scanf函数学习
dcj3sjt126com
cprintfscanflanguage
printf函数
/*
2013年3月10日20:42:32
地点:北京潘家园
功能:
目的:
测试%x %X %#x %#X的用法
*/
# include <stdio.h>
int main(void)
{
printf("哈哈!\n"); // \n表示换行
int i = 10;
printf
- 那你为什么小时候不好好读书?
dcj3sjt126com
life
dady, 我今天捡到了十块钱, 不过我还给那个人了
good girl! 那个人有没有和你讲thank you啊
没有啦....他拉我的耳朵我才把钱还给他的, 他哪里会和我讲thank you
爸爸, 如果地上有一张5块一张10块你拿哪一张呢....
当然是拿十块的咯...
爸爸你很笨的, 你不会两张都拿
爸爸为什么上个月那个人来跟你讨钱, 你告诉他没
- iptables开放端口
Fanyucai
linuxiptables端口
1,找到配置文件
vi /etc/sysconfig/iptables
2,添加端口开放,增加一行,开放18081端口
-A INPUT -m state --state NEW -m tcp -p tcp --dport 18081 -j ACCEPT
3,保存
ESC
:wq!
4,重启服务
service iptables
- Ehcache(05)——缓存的查询
234390216
排序ehcache统计query
缓存的查询
目录
1. 使Cache可查询
1.1 基于Xml配置
1.2 基于代码的配置
2 指定可搜索的属性
2.1 可查询属性类型
2.2 &
- 通过hashset找到数组中重复的元素
jackyrong
hashset
如何在hashset中快速找到重复的元素呢?方法很多,下面是其中一个办法:
int[] array = {1,1,2,3,4,5,6,7,8,8};
Set<Integer> set = new HashSet<Integer>();
for(int i = 0
- 使用ajax和window.history.pushState无刷新改变页面内容和地址栏URL
lanrikey
history
后退时关闭当前页面
<script type="text/javascript">
jQuery(document).ready(function ($) {
if (window.history && window.history.pushState) {
- 应用程序的通信成本
netkiller.github.com
虚拟机应用服务器陈景峰netkillerneo
应用程序的通信成本
什么是通信
一个程序中两个以上功能相互传递信号或数据叫做通信。
什么是成本
这是是指时间成本与空间成本。 时间就是传递数据所花费的时间。空间是指传递过程耗费容量大小。
都有哪些通信方式
全局变量
线程间通信
共享内存
共享文件
管道
Socket
硬件(串口,USB) 等等
全局变量
全局变量是成本最低通信方法,通过设置
- 一维数组与二维数组的声明与定义
恋洁e生
二维数组一维数组定义声明初始化
/** * */ package test20111005; /** * @author FlyingFire * @date:2011-11-18 上午04:33:36 * @author :代码整理 * @introduce :一维数组与二维数组的初始化 *summary: */ public c
- Spring Mybatis独立事务配置
toknowme
mybatis
在项目中有很多地方会使用到独立事务,下面以获取主键为例
(1)修改配置文件spring-mybatis.xml <!-- 开启事务支持 --> <tx:annotation-driven transaction-manager="transactionManager" /> &n
- 更新Anadroid SDK Tooks之后,Eclipse提示No update were found
xp9802
eclipse
使用Android SDK Manager 更新了Anadroid SDK Tooks 之后,
打开eclipse提示 This Android SDK requires Android Developer Toolkit version 23.0.0 or above, 点击Check for Updates
检测一会后提示 No update were found