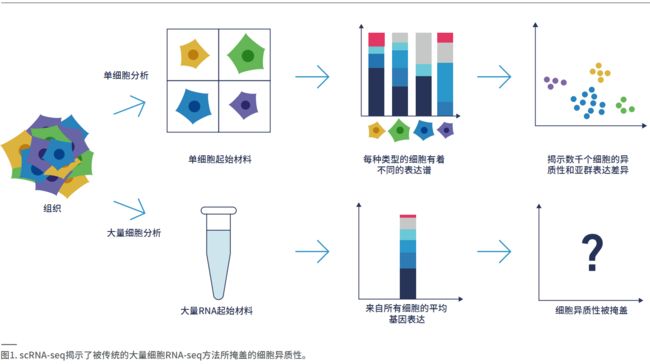
单细胞转录组学是阐明复杂生物系统的一种强大工具,让您能够逐个细胞地研究基因表达动态。通过生成细胞群体的单细胞图谱,单细胞RNA测序(scRNAseq)能够解析复杂样本中不同类型细胞之间的特定差异。单细胞基因表达谱分析带来了疾病发展过程中有关细胞进程的重要见解 。scRNA-seq 技术的进步让研究人员能够获取之前经常会被大量(Bulk)细胞的RNA-seq方法所掩盖的关键数据,如罕见或新的细胞类型,从而在单细胞水平上探索真正的基因表达多样性(图1)。
然而,为了充分利用这种革命性的技术,必须妥善地制备单细胞样本。本文对制备单细胞样本的建议进行了概括,这些样本可用于10x Genomics的单细胞基因表达(Single Cell Gene Expression)或免疫分析(Immune Profiling)解决方案。
scRNA-seq样本制备方案
• 细胞解离操作的技巧
• 移液技术和枪头选择
• 细胞清洗与过滤
• 细胞计数和活力评估
• 样本制备后的保存
首先,建议采用无菌的样品处理,包括使用不含核酸酶的试剂和耗材。为减少对细胞的损伤,移液和离心应保持在最低程度。在给定的离心速度,时间和温度下,细胞浓度和大小直接影响制备的效率。紧密堆积的细胞沉淀可能需要额外的操作,但也因此可能会通过剪切效应损害细胞。当然,在这个时候,离心条件需要调整。
此外,在进行细胞清洗和重悬过程中,使用足够的容积也是避免高浓度导致细胞集聚和结块的途径。悬液需要通过合适的细胞过滤器进行筛选来去除结块和碎片。这里推荐的细胞清洗和重悬液为包含牛血清白蛋白的磷酸盐(不含有钙镁离子)。原代细胞,干细胞和其他一些敏感细胞在清洗和重悬过程中需要更换缓冲液以确保活性。细胞团导致自动细胞计数器低估了单细胞的有效浓度。因此,悬浮液应在制备后尽快处理,最好在30分钟内。
在单细胞准备过程中应尽量减少细胞集聚,死细胞,无细胞的核酸和反转录抑制剂的存在。为了最大限度地减少这些污染,同时最大化不同细胞类型的纯度和无偏差恢复,可能需要条件优化(例如,调整洗涤步骤的数量,洗涤溶液的组成,离心条件和过滤器类型)。
细胞解离操作的技巧
为了获得活力高的细胞并尽量避免细胞死亡和裂解,您需要根据特定的样本类型来优化细胞解离的操作。死细胞会裂解,并向周围环境释放RNA;这种游离RNA会造成检测的背景噪音,并影响单细胞数据的质量。若细胞得到妥善处理,将会对测定产生直接影响,这些测定决定了上样到系统的细胞数量以及回收的细胞数量。遵循下面的指南可提高细胞计数的准确性,并最大限度减少样本之间的差异。
充分了解对于样本类型的限制和要求将有助于产生更加可靠的数据。许多现有的样本制备方案可以解决这些问题,不过或许需要根据您特定的样本类型进行调整。例如,悬浮细胞系、磁珠富集的细胞和流式分选的细胞已经处于悬浮状态,只需要进行清洗和计数,即可用于Chromium单细胞基因表达或免疫分析解决方案。然而,在处理组织时,必须在第一次文库制备之前很好地优化解离方案,以确保达到最佳质量。我们提供了多个示范方案,指导您优化样本制备.
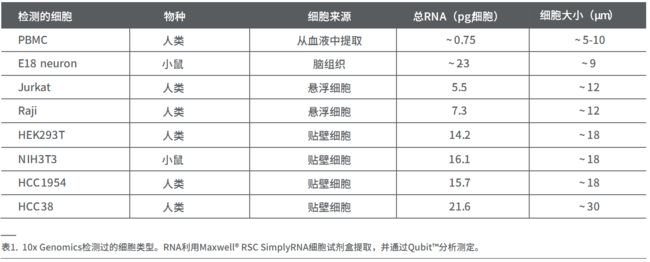
另一个考虑因素是不同类型细胞中的起始RNA含量各异,而RNA起始量的准确测定将影响流程中的一些关键决策,如文库制备时的PCR循环数。例如,人外周血单核细胞(PBMC)中的RNA很少,每个细胞只含有0.75 pg,而HCC38细胞系则富含RNA,每个细胞可达21.6 pg(表1)。
移液技术和枪头选择
在解离组织或处理悬浮状态的细胞时,移液技术是至关重要的。例如,当细胞静置在管中时,它们会开始沉降。从溶液的顶部或底部吸取时,吸到的细胞数量可能有很大差异,尤其是在细胞快速沉降时。因此,在吸取前一刻应当通过移液器充分而轻柔地混合细胞悬液,然后每次从管的中部吸取,通常低于溶液的中间标记。
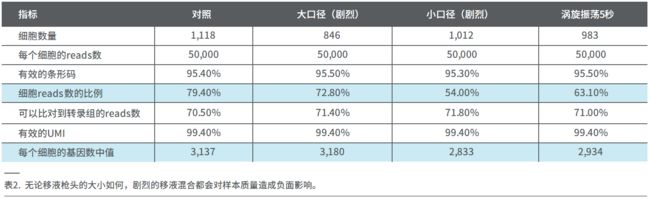
此外,移液时必须轻柔地处理细胞。如处理手法比较剧烈,即便采用大口径的移液吸头,也会对样本质量造成负面影响。表2比较了在HEK293T细胞上开展的四个不同的细胞混合实验得到的单细胞数据的关键指标。剧烈的移液混合和涡旋振荡都会导致细胞过早裂解,从而在周围环境中产生高水平的RNA,引起系统中的背景噪音,并最终降低细胞reads数的比例(以蓝色高亮 显示 ) 。 同样地, 每个细胞的基因数中位值也会因剧烈地细胞处理而减少(表2)。因此,细胞悬液应该通过大口径的移液吸头来轻柔混合。这将有助于获得背景更干净的数据,增加文库的复杂性(即增加每个细胞的基因数中位值),并提高细胞reads数的比例。
细胞清洗与过滤
在处理悬浮细胞系、解离组织或大量细胞时,我们强烈建议您采用彻底的清洗方案,这将影响上样至Chromium Controller后的细胞回收。具体方案可根据样本类型以及scRNA-seq方法而调整。我们提供的scRNA-seq清洗方案需要用到含0.04% BSA的PBS溶液,用于细胞的清洗和重悬。
大的细胞团块或碎片会增加微流体芯片的堵塞风险,并且干扰准确的细胞计数,从而影响细胞回收,特别是在使用自动细胞计数器时。为了避免这一问题,我们建议您将细胞悬液上样到微流体芯片之前,使用孔径为30-40 μm的细胞过滤网。很多过滤网已成功通过测试,可用于我们单细胞基因表达和免疫分析解决方案中的样本。
值得注意的是,每次过滤都会导致细胞悬液体积的减少以及细胞浓度的变化。如果需要过滤,您应当在过滤完成后对单细胞悬液进行重新计数。
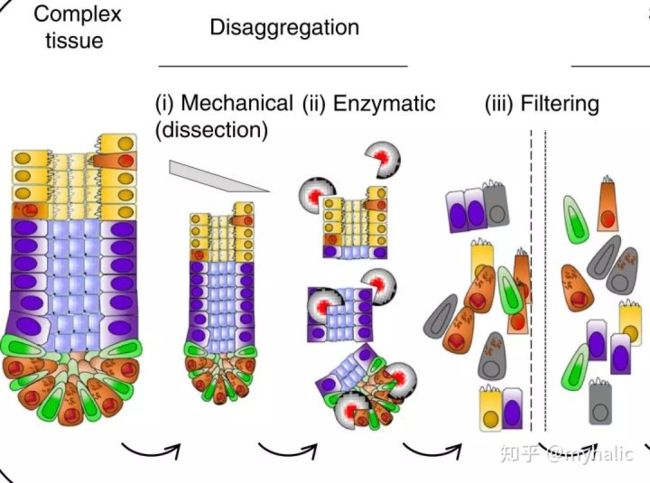
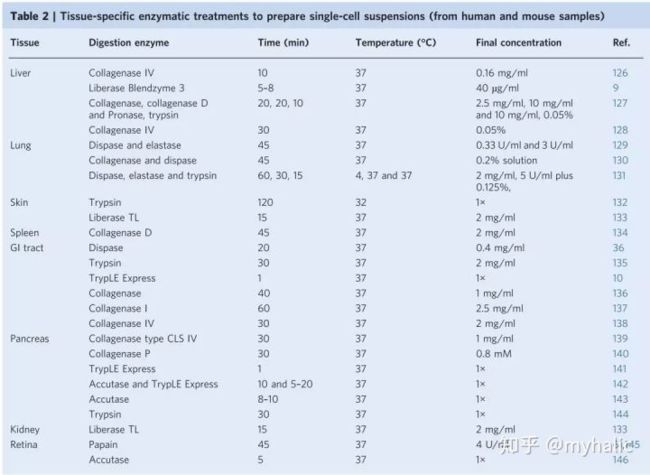
为从悬液中获得单细胞,样本需要通过梯度离心。实体组织需要在一开始进行机械分离或者酶消化处理。首先,组织需要通过物理切割或者刀片切碎,然后通过酶消化来分离细胞。特定的组织消化酶及消化时间见下表。
酶种类包括Accutase, elastase,collagenases,商业化的酶试剂包括TrypLE Express,Liberase Blendzyme 3。细胞裂解后可能会引起细胞聚集,可通过用DNase I处理来降低集聚。最后,悬液通过过滤器进行过滤以达到纯化目的。
值得注意的是,样本准备过程可能会引起细胞中基因表达模式的改变,特别是一些胁迫相关基因的激活。此外,一些敏感的细胞亚型可能在此过程中受到伤害。所以,样本准备过程越短越好。相反,如果消化时间太短,可能细胞分离不完全,需要在后续单细胞分析过程中排除掉这些紧密相连的细胞。
为避免细胞组成背景,可以通过破坏细胞膜,分离细胞核来实现。对细胞核RNA进行测序,也是一种分类细胞类型的好方法,但可能会对每个细胞的整体理解会产生偏差。单细胞核RNA测序已经不同的神经细胞研究中有所运用,因为成人神经组织细胞是高度内联的,无法有效分离。
细胞计数和活力评估
在评估样本质量时,您需要在细胞清洗和过滤之后测定细胞活力,这一点至关重要。测定细胞活力有许多种方法,但我们发现台盼蓝排除法在鉴定活细胞与死细胞的比例时效果很好。最终细胞计数的准确性以及目标回收量和实际回收量之间的一致性,取决于我们了解样本中有多少个细胞。一旦过滤和清洗完成,可采用细胞计数设备(如血球计数器或自动细胞计数仪)进行定量。这些设备不仅能提供准确的细胞计数,还能计算出向微流体芯片上样适量细胞所需的细胞悬液体积。
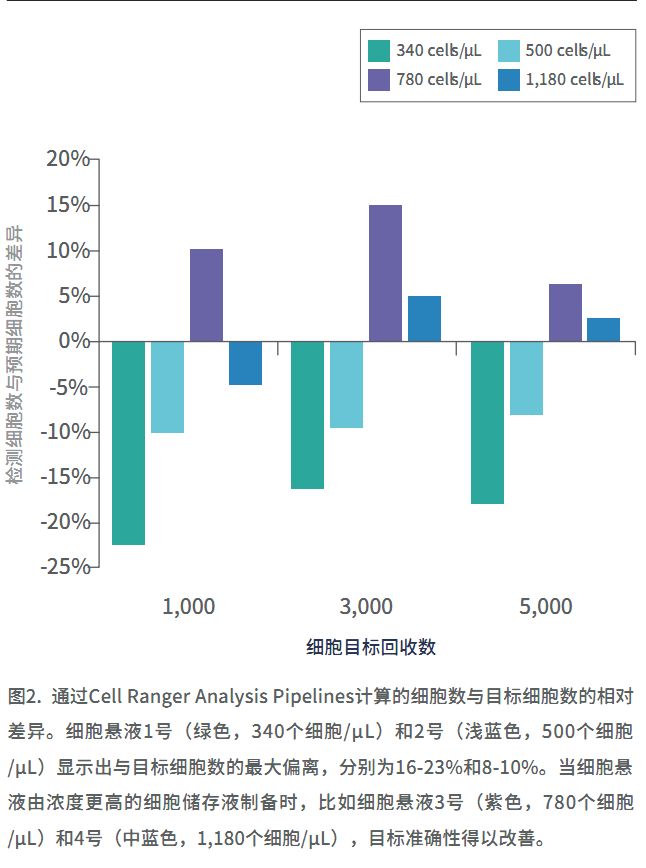
响最终细胞计数准确性的另一个重要因素是细胞储存液的浓度。我们发现,浓度介于700-1,200个细胞/μL的细胞储存液是最佳的,可以让回收细胞的数量达到目标值(图2)。细胞悬液的浓度一旦超出这个最佳范围,将会导致细胞计数不可靠。如果样品在这个范围以外,我们建议相应地调整细胞储存液的浓度。
高比例的死细胞可能会影响目标细胞的回收量,因此对于死细胞比例较高(>30%)的样本,我们建议您参考从单细胞悬液中去除死细胞的示范方案。此方案概括了一些最佳做法,能够降低单细胞悬液中的死细胞比例。
样本制备后的保存
为了最大限度地减少转录组的变化,在对细胞进行清洗和计数后,单细胞悬液应当保存于冰上,直至用于后续的上机和文库制备步骤。在理想状况下,一旦制备好样本,应当在30分钟内将其用于下游步骤。
然而 ,您还有必要了解各类细胞的不同性质,因为这可能会影响细胞应在冰上保存的时间,以及它们在制备后多久便应当被尽快使用。例如,有些细胞(如PBMC)如果在冰上放置一段时间,它们就开始形成团块。这些团块很难解离,增加了堵塞的风险,而且每个团块被当成单细胞计数,又降低了细胞计数的准确性。此外,有些细胞更加粘稠,形成团块的速度更快。对于这些细胞,必须尽量减少制备和使用之间的时间差。
大部分的scRNA-seq都是用新鲜分离细胞进行实验。但是,由于研究和临床实验特殊性,缺少足够的所需基础设施或专用设备,而使得对样本进行快速处理显得非常困难。另外,有些样本需要在多个不同的时间点进行收集,同时为避免技术误差需要样本在同一时间进行单细胞实验过程。因此,有效的样本保存方案是实现样本采样位置和时间与下游实验过程分开的解决方法。
有研究表明,当样本保存在-80℃或者液氮一年,随后解冻,来自细胞系和原代样本的冷冻保存的细胞显示出与新鲜制备的细胞类似的RNA分子的完整性,基因表达谱也没有明显改变。当然,应尽量避免细胞多次冻融。同样,甲醇固定已被确立为基于液滴的单细胞方法的替代性方案,也可避免由于样本处理时间延长而引发的基因表达变异。重要的是,冻存和固定方法都可以实现样本的储存和运输,扩大scRNA-seq方法的应用范围,例如,扩展到临床领域。然而,这两种方法都显示出细胞类型组成的潜在偏差,强烈建议彻底评估未经测试的新细胞类型的保存方法前不易直接使用。对于先前已保存的样品,例如速冻样品,细胞核测序是唯一的scRNA-seq解决方案。这是因为与冷冻保存不同,快速冷冻过程中冰晶的形成破坏了外部细胞膜,但是细胞核保持完整。但是,这也应该优先对RNA完整性进行初始估计,以避免与样品质量相关的偏差。
结语
在制备单细胞悬液时,制定适当的计划来妥善处理样本和制备样本是至关重要的,因为只有考虑到多个因素,才能获得高质量的数据。若有意了解单细胞样本制备的更多指南,您可以参考这些现有的示范方案,这些方案为特定类型的细胞提供了相应的操作指南。对于那些难以分离出完整细胞的细胞类型,细胞核分离也是一个有效的替代方案。我们还提供样本制备后各个步骤的操作指南,包括文库制备、测序,以及数据分析和可视化等步骤。此外,我们的教学视频,特别是第4章到第7章,将带您了解样本制备和文库制备的整个过程。
转载。
http://www.ebiotrade.com/custom/10X/181226/images/%E5%8D%95%E7%BB%86%E8%83%9E%E5%9F%BA%E5%9B%A0%E8%A1%A8%E8%BE%BE%E6%A0%B7%E6%9C%AC%E5%88%B6%E5%A4%87%E6%8C%87%E5%8D%97_2019.pdf
Tutorial: guidelines for the experimental design of single-cell RNA sequencing studies
来自《Nature Protocols》的单细胞转录组研究样本准备指南
https://assets.ctfassets.net/an68im79xiti/4cFfVJH95mgYeSIcEAUE6Y/2699fe2d0bc8c631f00e9020a1927aa8/CG00054_SamplePrepDemonstratedProtocol_-_CultCells_RevB.pdf
https://assets.ctfassets.net/an68im79xiti/2Sd6Fyx0YMqCC4m2uocS2u/025200dffa4a33df7b62e32133d8f72e/CG000126_Guidelines_for_Optimal_Sample_Prep_Flow_Chart_RevA.pdf