100%产生抗体?全美最有希望新冠疫苗遭遇大起大落

 FDA 批准其进入“快速通道”,不过专家对其披露表示质疑。 作者
|光谱
FDA 批准其进入“快速通道”,不过专家对其披露表示质疑。 作者
|光谱
邮箱 |[email protected]
“接受两针疫苗之后,受试者展现比感染恢复者更高的抗体水平。”
“mRNA-1273 疫苗是安全和可耐受的。”
两句话,让总部位于马萨诸塞州剑桥的莫德纳生物科技公司 (Moderna) 的股价暴涨四分之一,连带推动整个美国股市达到最近两个月以来的最高值。
近日,饱受前所未有的大规模呼吸道流行病——新型冠状病毒病 (Covid-19)——折磨超过三个月的人类世界,终于迎来了一条重大利好:
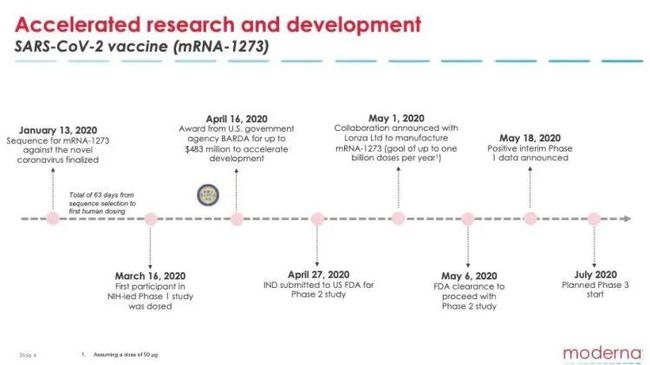
莫德纳针对新冠病毒开发的 mRNA-1273 疫苗,在美国政府主持的临床测试中有着出色的表现:全部45名受试者,在接受第一针疫苗后,开始监测到抗体。
该公司宣称,该疫苗一期人体临床测试取得了成功。它也成为了全美目前进展最快的新冠病毒疫苗。

测试结果:抗体生成效果显著
在接受两针、分别三种不同剂量 mRNA-1273 疫苗注射的受试者身上,研究人员测量到了足够高的抗体水平,能够有效阻碍新冠病毒和人体的结合和进一步的复制:
25、100和250微克三个剂量组的全部45名受试者,在接受第一针疫苗的15天后,成功实现了血清转化,也即能够开始监测到抗体。
接受第二针疫苗的两周(第一针的43天)后,研究人员对受试者产生的抗体对抗原(新冠病毒)的结合程度进行了检测,并发现:
- 低剂量组体内的抗体含量,在第二针后达到了未接受治疗的感染者在恢复期的水平 (convalescent sera);
- 中剂量组体内的抗体含量,超过了感染者恢复期水平。
(研究人员还将人体临床测试的结果和之前在小鼠身上进行的测试进行比对,效果是一致的。)
因此可以说,mRNA-1273 疫苗引发了人体分泌中和抗体 (neutralizing antibodies),并且能够有效和抗原(新冠病毒)实现结合并阻断感染。

此外,对于疫苗的安全性问题,研究人员宣布:mRNA-1273 疫苗总体上是安全和可耐受的 (generally safe and well tolerated)。
目前,研究人员已经发布了低、中剂量组前四名受试者的临床记录:
- 低剂量组无不良反应;
- 中剂量组中,唯一的不良反应发生在其中一名受试者身上,在接种位置周围发生红斑;
- 高剂量组的15名受试者中,有3人发生了第三级不良事件(grade 3 adverse event, 医学上严重但无生命危险的不良反应);
- 没有出现更高等级的不良事件;
-所有不良事件持续时间均很短,并且无需干预即可自愈。
莫德纳公司首席医疗官 Tal Zaks 博士表示,尽管目前发布的数据较为早期,仍然足够证明,即使在25微克的低剂量下,接种 mRNA-1273 疫苗能引发足够量级的免疫反应。
“和之前的小鼠测试结果相结合,现在的数据足以证实我们对 mRNA-1273 疫苗能够抵抗新型冠状病毒病的信念,” Zaks 博士表示。
不过需要提及的是,许多学术界和业界专家指出莫德纳公司的声明存在漏洞,数据披露不完全,值得质疑。本文后面部分将对详细介绍这些质疑。
莫德纳公司还宣布,目前正在按照最快速度推进。预计将在今年七月,在美国卫生及公共服务部的主持下开展第三期临床测试,并且在成功后向美国食药监局申请生物制品许可。同时,该公司还透露已经在扩大产能,帮助尽可能多的人。

原理:“软件安装包”式疫苗
自从2月疫情在中国彻底爆发,并且展示出全世界扩散态势起,全球就已经有多支团队启动新冠疫苗研发。
3月16日,中国工程院院士陈薇少将团队研制的腺病毒载体重组疫苗,在3月16日首批进入临床试验;全部108名受试者4月10日结束医学观察,健康状况良好;508人参与的二期临床试验已于4月12日展开,有望于5月揭盲(宣布双盲测试结果)。
中国有陈薇团队,美国则有莫德纳。
该公司研发的 mRNA-1273 疫苗是全美目前进展最快的新冠病毒疫苗,2月25日在美国华盛顿州展开一期临床测试。该测试在美国国家过敏和传染病研究所(NIAID, 人称“美版钟南山” Dr. Fauci 领导的机构)的主导下进行。前面看到的结果正是来自这一阶段。
顾名思义,mRNA-1273 是一种基于信使RNA的疫苗,采用新型脂质纳米颗粒 (LNP)封装,内含的 mRNA 编码了新冠病毒全长度、预融合稳定的棘突蛋白 (spike protein, S 蛋白)。
在疫情初期,以中国为首的全世界科研工作者通力协作,很快就完成了新冠病毒的基因序列测定。莫德纳公司将病毒棘突蛋白 (spike protein, S 蛋白) 部分的序列,编码到 mRNA 上,封装,制成疫苗(见以下动图):

将疫苗注射到上臂肌肉中,包膜融解,mRNA 被淋巴结上的免疫细胞内吞。遗传物质可以指挥免疫细胞复制生成大量的新冠病毒棘突蛋白,其它健康的免疫细胞接触并带走了这些棘突蛋白,以为自己感染了。进而免疫系统被激活,开始生成抗体(见以下动图):
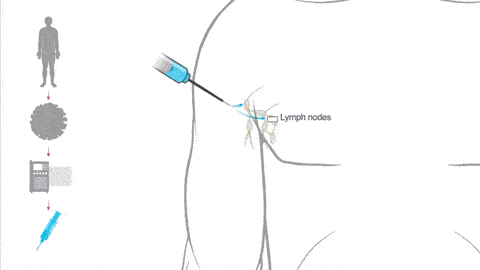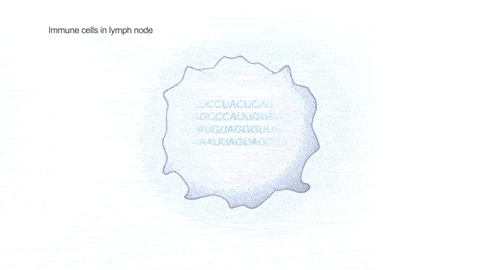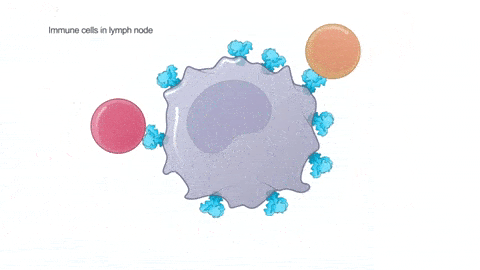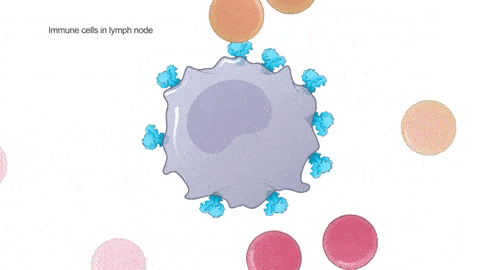
足够多的抗体,能阻断真实的新冠病毒和人体细胞结合,也就使病毒很难到达对人体造成伤害、进一步感染别人的载量。
这套机制巧在模仿了新冠病毒感染的方式,却不会像真的感染那样对肺部造成损伤。疫苗的制备过程中也完全不需要合成完整的病毒,舍弃了繁琐费时的步骤。
作为专精 mRNA 技术的公司,莫德纳常用的一套话术,是把细胞理解为操作系统,把 mRNA 理解为“软件”:
首先从病人身体里提取病毒的信息,然后直接把足够关键的片段信息直接“告诉”给人体,就像“安装包”一样。进而,人体可以自行解包、编译出整个“软件”。
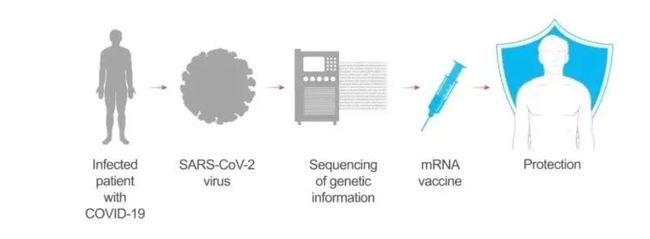
也正是因为 mRNA 的原理更简单、工序更少(技术门槛当然还是很高的),从基因序列测定完成到疫苗准备好进行临床测试,整个过程只用了 42 天。
mRNA 疫苗是一种较新的疫苗制备手段,制造过程相对简单、迅速,在流感等呼吸道流行病领域已经有较多的应用。莫德纳是美国 mRNA 技术的领先公司,此前已经开发了基于 mRNA 的流感疫苗,也在开发其它的 mRNA 药物。

疑问:信息披露不完整
不过,在结果披露后,莫德纳也遭遇了大量的质疑。
美国医药新闻网站 Stat 采访的多名专家称,莫德纳公司在官网披露的声明,其中数据不全信息有限,无法判断疫苗的有效性和安全性。
质疑的焦点在于,本文前面曾提到,莫德纳只宣布疫苗在低和中剂量组的8名受试者身上有效,而每个组的人数是15人。该公司虽然透露了低中高三个整组的不良反应情况,但在疫苗的有效性,也即产生抗体的能力方面,没有透露除了前述8人之外的其它受试者情况。
抗体检测是在第二针的两周后进行的。对此,约翰霍普金斯大学国际卫生系教授安娜·杜尔宾博士接受采访时指出,从莫德纳的声明当中看不出疫苗产生的抗体能够持续多久。
还有一个问题是,许多专家对于该公司感染者恢复期血清抗体水平 (convalescent sera)的定义方式不明。根据过往经验,不同的感染者,恢复期抗体水平差异非常大。
耶鲁大学传染病学荣誉退休教授杰克·罗斯援引一份中国一线医生的论文指出,有的恢复期病人完全检测不到抗体,有的人抗体水平非常高。
至于获得了抗体的感染恢复者事后还能否继续感染,有大量的新闻指出这是一种可能性,不过学界也尚无足够盖棺定论的权威报告。
罗斯猜测,莫德纳现在的数据没有足够代表性,否则他们肯定会发布更多的数据。
“我认为他们在这份声明里没有披露其他的受试者的数据,这件事值得顾虑。我希望能够看到没有披露的数据,这样我可以自己做出判断。当然,这支疫苗产生的免疫反应比之前其它 RNA 疫苗的效果要好,这还是有点值得兴奋的。”
该公司透露,对于这次一期临床测试,NIAID 将稍后发布一篇学术文章。不过,作为本次测试的领导机构,NIAID 目前尚未对本次测试以及莫德纳的声明作出任何评价。
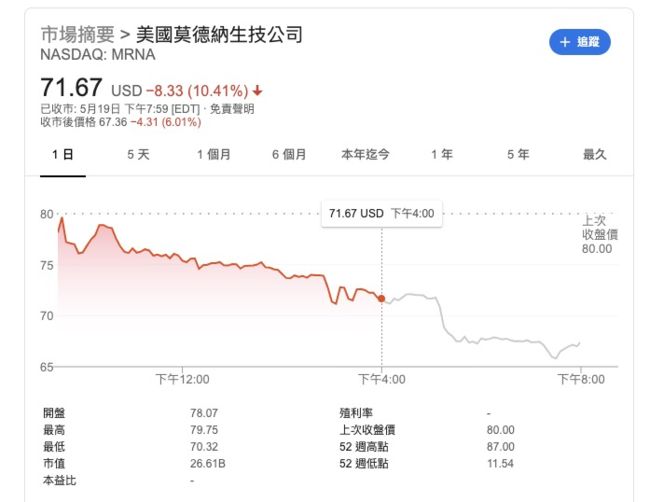
受到质疑后,莫德纳股价在美国时间周二重挫10%,盘后持续下跌,声明发布后新增的市值又被蒸发掉了不少,近3亿美元。

前景:已进入FDA“快速通道”
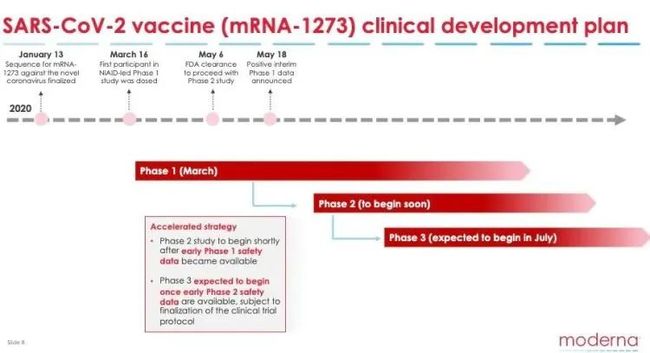
由于在一期临床测试中结果喜人,美国食药监局 (FDA)已经在5月12日批准该疫苗进入“快速通道” (Fast Track)。
北京中医药大学何明教授介绍,FDA 在1998年首次启用快速通道机制。其特点是 FDA 会更加主动地与医药企业沟通,在研发方案、临床试验设计、数据收集等方面进行指导,让研发进程少走弯路。FDA 更愿意和进入快速通道的药企会面和书面交流。
不仅如此,进入快通通道的药企还可以享受“滚动审查”(rolling review)的特权,也即可以分阶段向 FDA 送审,不用再等实验研究的所有阶段都完成之后一并提交。
值得提及的是,FDA 还有一项比“快速通道”更进一步的优惠政策,叫做“突破性疗法”。如果药企在二期或者更晚的临床测试中能够证明效果,则有可能获批享受该政策。
在宣布 mRNA-1273 疫苗一期临床测试结果的电话会议上,莫德纳表示二期测试预计很快就会开始。
二期测试继续评估疫苗的安全性、反应原性和免疫原性,预计将采用双盲机制,300名18-55岁和300名55岁以上成年人分为两组,他们将会随机收到50微克、100微克剂量或安慰剂。
莫德纳预计三期测试将在7月开始。由于在一期测试中发现250微克组的不良反应明显,三期将不会进行高剂量接种。除此之外,暂无关于三期测试的更多权威细节。
注:本作品著作权归PingWest品玩/硅星人独家所有,授权深圳市腾讯计算机系统有限公司独家享有信息网络传播权,任何第三方未经授权,不得转载
往期精彩文章推荐

长按关注
品玩官方公众号
科技创新者的每日必读


