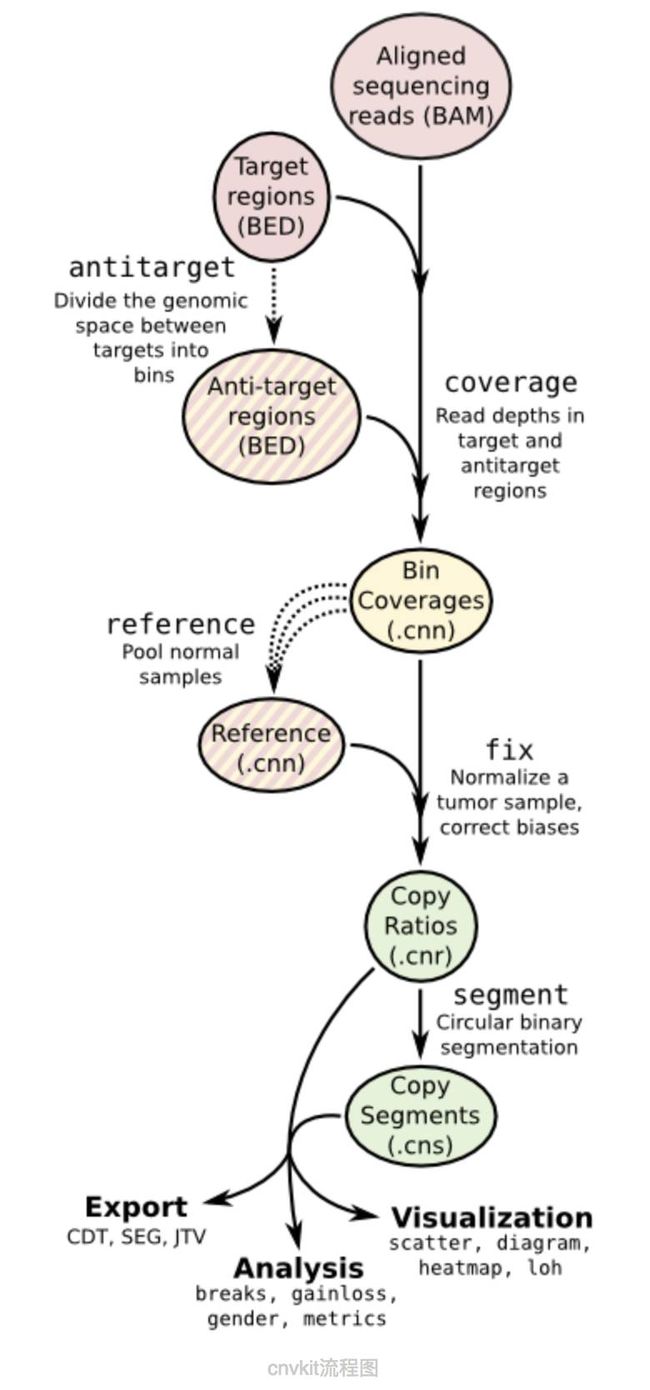
cnvkit被设计来处理同一个批次的多个肿瘤配对样本测序情况,首先对所有的normal数据进行bin处理拿到背景值,然后就这个背景值来处理所有的tumor测序数据计算拷贝数变异情况。
该软件使用比较复杂,建议读一读官网教程。所有的命令都被包装到一个python脚本里面,使用该脚本调用一系列字命令,如下:
官网教程
Copy number calling pipeline
batch
target
access
antitarget
autobin
coverage
reference
fix
segment
call
每个命令都有自己的特殊功能,需要仔细阅读。
流程图:
流程代码如下:
cnvkit.py access baits.bed --fasta hg19.fa -o access.hg19.bed
cnvkit.py autobin *.bam -t baits.bed -g access.hg19.bed [--annotate refFlat.txt --short-names]
# For each sample...
cnvkit.py coverage Sample.bam baits.target.bed -o Sample.targetcoverage.cnn
cnvkit.py coverage Sample.bam baits.antitarget.bed -o Sample.antitargetcoverage.cnn
# With all normal samples...
cnvkit.py reference *Normal.{,anti}targetcoverage.cnn --fasta hg19.fa [--male-reference] -o my_reference.cnn
# For each tumor sample...
cnvkit.py fix Sample.targetcoverage.cnn Sample.antitargetcoverage.cnn my_reference.cnn -o Sample.cnr
cnvkit.py segment Sample.cnr -o Sample.cns
# Optionally, with --scatter and --diagram
cnvkit.py scatter Sample.cnr -s Sample.cns -o Sample-scatter.pdf
cnvkit.py diagram Sample.cnr -s Sample.cns [--male-reference] -o Sample-diagram.pdf
可以看到软件提供的命令基本上的都用到了,coverage—>fix—>segment—>segment
其实上面这么一大串的命令已经被包装成了一句命令,就是:
cnvkit.py batch *.bam -r my_reference.cnn -p 8
这个一句话命令与上面的多行代码是等效的,默认的segment算法是 circular binary segmentation algorithm (CBS),也可以用 -m切换使用其它算法,比如: faster HaarSeg ( haar) or Fused Lasso ( flasso)
上面得到的只是segment的结果,还可以call一下:
cnvkit.py call Sample.cns -o Sample.call.cns
cnvkit.py call Sample.cns -y -m threshold -t=-1.1,-0.4,0.3,0.7 -o Sample.call.cns
cnvkit.py call Sample.cns -y -m clonal --purity 0.65 -o Sample.call.cns
cnvkit.py call Sample.cns -y -v Sample.vcf -m clonal --purity 0.7 -o Sample.call.cns
这个时候需要考虑到已有的vcf变异文件,或者计算好的tumor纯度,或者倍性等等。把segment计算得到的log2 ratio值还原成 0,1,2,3,4这样的拷贝数。
但是,事实上上面的代码一般来说是不能直接使用的,因为我们的测序数据通常是WES数据,需要加上很多参数。
实践运行cnvkit
上面流程很复杂,命令也很多,但是不知道也没关系,用起来其实就一个batch命令即可,当然这个batch命令本身参数也不少,而且被设计用来处理不同的数据情况。
# From baits and tumor/normal BAMs
## 同一批次的所有样本N/T测序数据的bam文件一起运行
cnvkit.py batch *Tumor.bam --normal *Normal.bam \
--targets my_baits.bed --annotate refFlat.txt \
--fasta hg19.fasta --access data/access-5kb-mappable.hg19.bed \
--output-reference my_reference.cnn --output-dir results/ \
--diagram --scatter
## 如果新增加了肿瘤测序数据,就运行下面的
# Reusing a reference for additional samples
cnvkit.py batch *Tumor.bam -r Reference.cnn -d results/
# Reusing targets and antitargets to build a new reference, but no analysis
cnvkit.py batch -n *Normal.bam --output-reference new_reference.cnn \
-t my_targets.bed -a my_antitargets.bed --male-reference \
-f hg19.fasta -g data/access-5kb-mappable.hg19.bed
值得注意的就是,如果是全基因组测序数据,用 batch --method wgs ,如果是捕获基因组测序,包括全外显子,就用 batch --method amplicon ,然后一定要提供捕获区域的bed文件,一般是外显子加上其侧翼上下游的50bp长度。
人类外显子长度平均是200bp,所以默认的bin是267bp,这样可以把比较长的exon给拆分开来。
还有就是 access 参数需要的文件,
至于最后得到cnv片段该如何注释到对应区域的基因这种小事,就不在本文讨论范围啦。
输入输出文件
其中 coverage 命令会对每一个 normal 样本都计算 *.targetcoverage.cnn and *.antitargetcoverage.cnn files , 说明是: target and antitarget coverage tables (.cnn)
这些文件需要合并起来:
cnvkit.py reference *coverage.cnn -f ucsc.hg19.fa -o Reference.cnn
然后再校正区域测序深度及GC含量,之后变成 copy number ratios (.cnr) 文件。
cnvkit.py fix Sample.targetcoverage.cnn Sample.antitargetcoverage.cnn Reference.cnn -o Sample.cnr
最后把 copy number ratios (.cnr) 文件用segment算法跑一下即可,输出cns后缀文件的 segment信息。
对于normal样本只需要输出cnn即可,合并成 Reference.cnn,然后把一个个tumor样品,根据这个 Reference.cnn来计算 cnr,进而计算 cns 。
最后对于cns可以进行call找到真正的拷贝数。 可以看到 cns文件内容如下,其中第4列是注释的基因,因为太多,看不清楚,我就没有秀给大家。
$ head NPC_merge_marked_fixed.cns |cut -f 1-3,5,8
chromosome start end log2 weight
chr1 12098 1701806 -0.183469 84.0794
chr1 1702902 1752401 -0.962192 4.87216
chr1 1752901 12777601 -0.220165 370.756
chr1 12778101 12920301 -1.11688 10.7699
chr1 12920307 27407686 -0.275998 558.214
chr1 27408186 125184087 -0.0447404 2418.53
chr1 143185087 248945922 -0.0422629 2967.61
chr2 10500 5692985 0.151978 85.3751
chr2 5692985 90402011 -0.0329165 1874.56
上面的segment结果还可以call一下,如果有需要的话。
可视化结果:
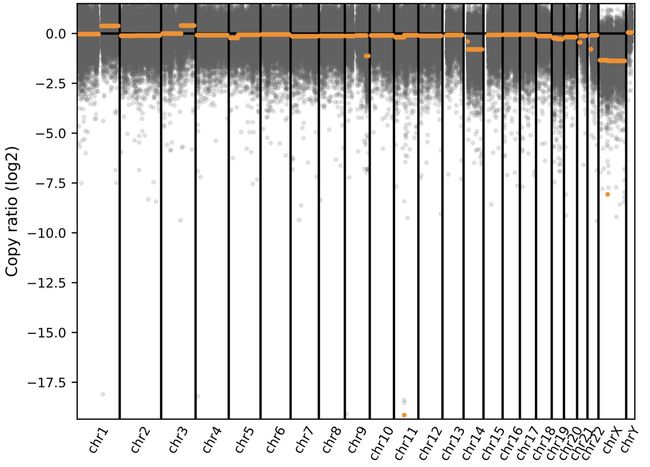 cnvkit-1
cnvkit-1
很明显可以看到有拷贝数变异的区域了。
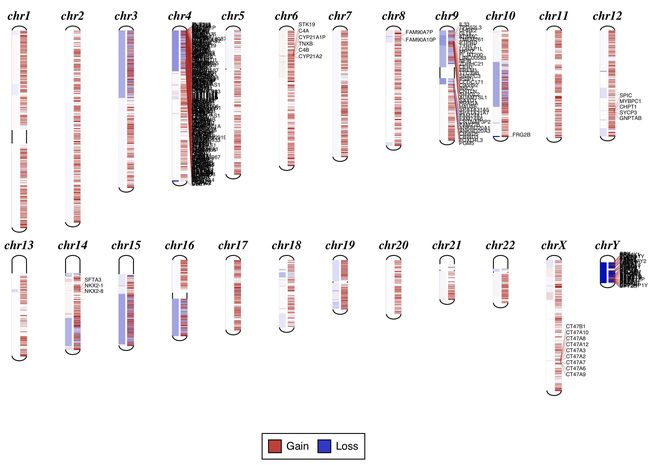 cnvkit-2
cnvkit-2
原文中此处为链接,暂不支持采集
原文中此处为链接,暂不支持采集
原文中此处为链接,暂不支持采集