光电成像相关检测技术整理
光电流显微检测
光电流检测是对光电效应产生的微弱电流进行检测的技术,是光电检测的重要手段之一,具有精度高、非接触、信息效率高和自动化程度高等特点。由于光电流检测是针对电流这一基本物理量进行检测的技术,因此不但在科学研究领域,如物理学、电化学、地磁学、天文学,空间科学等,而且在生活检测领域,如水质、大气检测,都具有非常广泛的应用。图1.1为光电流检测系统的典型配置,包括辐射源(光源)、信息载体(受污染气体或水质,大气环境)、光学系统(透镜,滤光片,衰减片等)、光电流探测器(光电二极管、光电传感器等)以及信息处理装置(ADC,微处理器等)。
光电流成像系统Photocurrent Mapping System又叫扫描光电流显微镜Scanning PhotoCurrent Microscopy,是一种用于检测材料光电流强度分布的专用设备,它既可以用来测量光电材料的光电响应信号,又可以用来表征材料的光电性质。XperRam Photocurrent光电流成像系统将光电材料对于光信号响应的不均匀性以可量化且可视化的方式显示出来。通过该系统,可以研究例如太阳能电池光生电流的不均匀性,探索光电器件量子效率与器件电阻的分布特性,研究器件吸收与电荷生成的微区特性,以及光电材料界面、半导体结区的品质分布等。
XperRam Photocurrent光电流成像系统包括激光器、显微镜、激光扫描振镜、数字源表和软件部分。其工作原理如下图所示。激光通过扫描振镜,经显微镜物镜聚焦到样品上,样品上因光电效应产生电流,电流信号读出后传至电脑。扫描时,振镜控制激光聚焦光斑在样品XY方向上扫描移动,软件记录每一个激光聚焦光斑的位置和其对应激发的电流值,即可实现光电流成像(Photocurrent Mapping)
纳米光子学
纳米光子学是研究在纳米尺度上光与物质相互作用的一门学科。利用近场光学对纳米器件进行设计制造和运用的技术 ,属于光子学的分支。纳米光子学的一个理想目的就是通过纳米技术,将有可能从单个的分子开始构建出功能完全等同于芯片的一种物质,它既能够储存数据又能用作电子通道的开关。
纳米光子器件是纳米光子学的一个重要组成部分,目前在研的的纳米光子器件有:
纳米激光器、量子点红外光电探测器、多量子阱自电光效应器件(MQW-SEED)、超晶格多量子阱红外光电探测器阵列、纳米级薄膜制作的红外摄像器件、光子晶体波导器件等。
超小型的纳米激光器在一系列领域中有着非常广阔的应用前景:在化学和生物医学工程中例如生物传感器、显微术和激光外科以及也有可能把纳米激光器用于鉴别化学物质。
纳米激光器在光计算,信息存储和纳米分析等领域也会得到广泛的应用。把纳米激光器集成到芯片上,便可提高计算机磁盘信息存储量以及未来的光子计算机的信息存储量,加速信息技术的集成化发展。
荧光光谱及成像技术
![]()
荧光信号的产生及信号捕获原理:
荧光物质被特定外界能量激发(如激光等高能射线),引起其电子轨道向高能轨道跃迁,并最终释放能量回归基态的过程中会产生可被检测的荧光信号。当然不是所有的物质都能被激发产生荧光,只有当该物质与激发光具有相同的频率并在吸收该能量后具有高的荧光效率而非将能量消耗于分子间碰撞过程中,其荧光信号才可被光学设备所检测(Fig.1)。
荧光成像系统的组件和工作原理:
荧光物质被激发后所发射的荧光信号的强度在一定范围内是与荧光素存在的量成线性关系的,这是荧光成像系统应用于生物学研究的理论基础,激光扫描系统的性能指标主要有:系统分辨率、线性范围、均一性、灱敏度。
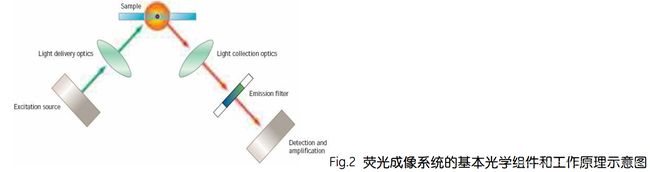
为了实现荧光信号的激发、捕获和放大的检测过程,按照顺序荧光成像系统主要包括以下组件:激发源(Excitationresource)、激光传输组件(Lightdeliveryoptics)、荧光收集组件(Lightcollectionoptics)、发射滤镜(Emissionfilter)和信号检测放大组件(Detectionandamplification)(Fig.2)。在荧光成像系统工作的过程中,每个组件的性能都关系着最终荧光信号的收集和检测结果。
1.现有的激发源主要可分为两大类即:宽波长光源,如紫外、氙灯等;单波长非连续光源,如激光光源。前者主要应用于分光光度计和照相成像系统,可直接照射被检样品。
2.激光传输组件(Lightdeliveryoptics)激光光源还需要一系列透镜和反射镜来导引其完成激发的过程。需要指出的是波长光源也可以通过光栅和滤镜的作用变为窄波长光源。激光传输组件主要在这一过程中起作用。用以将所需波长的光线导向样品,从而保证激发光的单一性。
3.荧光收集组件(Lightcollectionoptics)高质量的光学收集组件应包括透镜、反射镜和滤镜等,负责拟合不同波长的发射光、保证线性关系和透过性。
4.发射光过滤组件主要通过滤镜来起到收集和过滤杂信号的作用。
5.信号检测、放大和数字化组件:为了检测荧光光能信号并将其放大、转化成电信号从而迚行定量分析,光电倍增管(PMT)、电荷偶联器(CCD)常被人们所选择。该组件的性能通常通过数字化分辨率来表示,它是用来描述在同样信号强度条件下区分不同两个信号的能力,即人们常说的比特(bit),现多为8-bit,12-bit和16-bit(分别对应为256灰阶、4096灰阶和65536灰阶)。
超分辨成像技术
光学显微镜凭借其非接触、无损伤等优点,长期以来是生物医学研究的重要工具。但是,自1873年以来,人们一直认为,光学显微镜的分辨率极限约为200nm,无法用于清晰观察尺寸在200nm以内的生物结构。超分辨光学成像(Super-resolutionOpticalMicroscopy)是本世纪光学显微成像领域最重大的突破,打破了光学显微镜的分辨率极限(换言之,超越了光学显微镜的分辨率极限,故被称为超分辨光学成像),为生命科学研究提供了前所未有的工具。
为了提高光学显微镜的分辨率,早期的工作往往集中在如何减小艾里斑的尺寸,包括减小光的波长、增大数值孔径。对于前者,直接导致了各种电子显微镜的诞生---采用波长为纳米甚至亚纳米级的电子束进行成像,其分辨率可达纳米量级甚至更小。对于后者,一方面可以更高折射率的成像介质,例如,将空气换为水(折射率为1.333),采用400nm的光进行成像,极限分辨率可高达150nm。另一方面,可以利用结构更为复杂的光学收集系统(如共轭双物镜)来增加光学显微镜的有效孔径角,从而提高光学显微镜相对较差的轴向分辨率,其典型代表为4Pi显微镜。此外,还可以使用共焦小孔等来限制艾里斑的尺寸并消除杂散光,从而提高光学显微镜的横向和纵向分辨率,其典型代表是共聚焦显微镜(ConfocalMicroscope)。
值得指出的是,这里所述的光学显微镜指的是远场光学显微镜(Far-fieldOpticalMicroscope),物镜和样本之间的距离远大于光的波长。进一步的研究表明,远场光学显微镜存在分辨率极限的主要原因在于远场一般只能收集传导波信号,而携带了高频信息的倏逝波(EvanescentWave),其电场强度随传播距离的增加而呈指数衰减。因此,若使用距样本表面仅几个纳米的探针收集并探测近场光信号,可以大幅提高光学显微镜的分辨率,这种思路导致了近场扫描光学显微镜(Near-fieldScanningOpticalMicroscope,NSOM)的诞生,其分辨率可以优于25nm。而基于倏逝场扫描成像的光学显微镜,通常被称为近场光学显微镜(Near-fieldOpticalMicroscope)。
超分辨光学成像技术通常指的是基于远场光学显微镜的超分辨成像技术,主要包括两种实现途径:一种是基于特殊强度分布照明光场的超分辨成像方法(如STED)。另一种是基于单分子成像和定位的方法(如PALM)。
1.受激发射损耗显微镜技术(Stimulated Emission Depletion Microscopy, 简称STED)
该成像理论来源于爱因斯坦的受激辐射理论,德国科学家斯蒂芬·赫尔(Stefan W. Hell)创造性地利用受激辐射来抑制自发荧光辐射,最终实现了受激发射损耗显微镜技术(STED)。一个典型的STED显微镜需要两束严格共轴的激光,其中一束为激发光,另外一束为损耗光(也称STED光)。利用激发光使艾里斑范围内的荧光分子被激发,其电子从基态跃迁到激发态。随后,使用甜甜圈型(Doughnut,跟救生圈形状类似)的损耗光照射样品,使得处于激发光斑外围的激发态分子以受激辐射的方式释放能量回到基态,而位于激发光斑内部区域的激发态分子则不受损耗光的影响,继续以自发荧光的方式回到基态。这种照明方式的组合,将荧光发射区域限制在小于艾里斑的区域内,获得了一个小于衍射极限的荧光发光点。最后,通过在二维(或三维)空间内扫描共轴的激发光和损耗光,获得一幅二维(或三维)超分辨图像。1994年,斯蒂芬·赫尔等人提出了STED显微镜的理论。2000年,斯蒂芬·赫尔研究组通过生物实验证实了STED显微镜的超分辨成像能力。
2.光激活定位显微镜技术(Photoactivation Localization Microscopy, 简称PALM)
阿贝极限指出,在远场无法分辨相距l / 2NA的两个荧光分子所成的像,但是并没有对单个荧光分子的中心位置确定精度进行限制。如果在艾里斑内仅有一个分子在发射荧光, 我们可以利用单分子定位算法并结合光学系统艾里斑的形状,以超高精度(纳米量级)获得荧光分子的中心位置。倘若将这个单分子定位思想用于实现超分辨成像,其关键在于如何在一个艾里斑内区分多个荧光分子。
为了克服一个艾里斑内只允许一个分子发射荧光的限制,1995年美国科学家埃里克·白兹格(Eric Betzig)通过理论分析,提出可以利用光谱特性对艾里斑内的发射波长不同的荧光分子进行分时探测和中心位置定位,从而实现荧光密集标记样本的超分辨成像。2006年, 埃里克·白兹格等人利用光激活绿色荧光蛋白(PA-GFP)的可控荧光开关特性,结合单分子定位算法,实现了生物样本的超分辨成像。他们首先利用低能量的 405 nm 激光(激活光)来稀疏活化PA-GFP,再使用 561 nm激光(激发光)对活化后的PA-GFP进行单分子荧光成像,直至活化后的PA-GFP分子被光漂白。重复激活-激发-定位-漂白过程,可以在艾里斑内高精度找到大量PA-GFP分子的中心位置,从而重建出一幅由PA-GFP分子中心位置组成的超分辨图像。这种技术被称为光激活定位显微镜(Photoactivation Localization Microscopy, 简称PALM)。
光学相干断层扫描
各种成像技术中,光学相干断层扫描技术/光学相干层析成像[1](OpticalCoherenceTomography)是一项新兴的光学成像技术,当从散射介质中返回的弹道光子和蛇行光子与参考光的光程差在光源的相干长度范围内,发生干涉,而漫射光子与参考光的光程差大于光源的相干长度,不能发生干涉,从而把带有被测样品信息的弹道光子和蛇行光子提取出来,进行成像,它可以实现对生物组织高分辨率的非侵入层析测量,具有广泛的应用前景。光学相干层析成像技术是从光学相干域反射仪(或光学低相干反射仪)发展而来的,1991年,美国麻省理工学院(MIT)的DavidHuang等人在Science上首先报道了光学相干层析成像(简称OCT)技术。之后Schmitt等将此技术用于生物组织光学特性参数测量,取得了很好的效果。1996年CarlZeissMeditecInc.ofCalifornia把眼科的OCT系统做成临床医疗器械投放市场。
OCT专业全称又叫光学相关断层扫描。是最近几年应用于眼科的新型技术。OCT是一种非接触、高分辨率层析和生物显微镜成像设备。它可用于眼后段结构(包括视网膜、视网膜神经纤维层、黄斑和视盘)的活体上查看、轴向断层以及测量,是特别用作帮助检测和管理眼疾(包括但不限于黄斑裂孔、黄斑囊样水肿、糖尿病性视网膜病变、老年性黄斑变性和青光眼)的诊断设备。OCT现在分为时域和频域两类,其实各有优缺点。时域OCT性价比高,足以完成大多数眼底及青光眼疾病的检查。而且技术比较成熟。
OCT[3]基Michelson的干涉度量学,以超发光二极管发光体作为光源。经光导纤维进入光纤耦联器,光束被分为两束,一束经过眼的屈光介质射向视网膜,另一束进人参照系统。两个光路中反射或反向散射的光线在光纤耦联器被重新整合为一束并为探测器所探测,对不同深度组织所产生的反向散射强度和延搁时间进行测量。通过对伪彩色的灰阶值进行实时的显示来获得图像,像红、黄、亮绿这样明亮的颜色代表发射强的区域,而蓝黑等暗色代表低反射区,绿代表中等反射区。
参照镜面和光源的距离可以调节,当两个光路的光程差与光源的相干波长相匹配时才会产生干涉,所以的轴向分辨率由光源的相干波长决定,与光源的光谱带宽成反比。OCT的横向分辨率不仅受波长的影响,瞳孔直径和横向像素密度也是重要影响因素。
此外,当将OCT技术拓展到对生物组织进行成像时,其利用近红外线及光学干涉原理进行成像。简单地说就是将光源发出的光线分成两束,一束发射到被测物体(血管组织),这段光束被称为信号臂,另一束到参照反光镜,称为参考臂。然后把从组织(信号臂)和从反光镜(参考臂)反射回来的两束光信号叠加。当信号臂和参考臂的长度一致时,就会发生干涉。从组织中反射回来的光信号随组织的形状而显示不同强弱。把它与从反光镜反射回来的参考光信号叠加,光波定点一致时信号增强(增加干涉),光波定点方向相反时信号减弱(削减干涉)。形成干涉的条件是频率相同,相位差恒定。利用干涉原理,OCT比较标准光源与反射信号以增强单一反射,减弱散射光线的放射。由于干涉只发生在信号臂和参考臂长度相同时,所以改变反光镜的位置,就改变了参考臂的长度,则可以得到不同深度的组织的信号。这些光信号经过计算机处理便可得到组织断层图像。
参考文献:百度、百度文库、部分论文。如有侵权,告知删除。