研究内容:
通过结合基因组序列分析和体外生长实验,研究了15株产丁酸肠道菌对8种 b 族维生素和蛋白产生氨基酸的需要量。
重要结论:
- 反刍动物科植物黑球杆菌(Faecalibacterium prausnitzii)和变粒下体(Subdoligranulum variabile)对大部分维生素和氨基酸色氨酸具有营养缺陷型。
2.在Lachnospiraceae中,大多数种类为原生营养型,但生物素营养缺陷现象普遍存在。
Within the Lachnospiraceae, most species were prototrophic for all amino acids and several vitamins, but biotin auxotrophy was widespread.
- 此外,Eubacterium rectale and Roseburia spp., but few of the other Lachnospiraceae strains对硫胺素和叶酸缺乏营养。
In addition, most of the strains belonging to Eubacterium rectale and Roseburia spp., but few of the other Lachnospiraceae strains, were auxotrophic for thiamine and folate.
4.进行了5株硫胺素和叶酸营养缺陷型菌株在不同浓度维生素缺乏和存在条件下与不同原生营养细菌共培养的合成实验。这表明细菌之间确实发生了交叉喂养,并揭示了原生营养菌株之间交叉喂养效率的差异。
与单共培养相比,在共培养中也观察到维生素无关的生长刺激,特别是对于 F. prausnitzii A2-165,‘这表明它受益于社区成员提供的其他生长因子。
在健康的人类结肠中发现的产丁酸最多的厚壁菌种中存在多种维生素营养素,这表明这些细菌依赖于从饮食中提供的维生素,或通过微生物群落中其他成员的交叉喂养。
背景知识:
丁酸是肠道微生物产生的主要短链脂肪酸(SCFA)之一,具有多种保健作用,包括抗炎和抗癌作用;在厚壁菌门中,Clostridiales梭状芽孢杆菌目中有几种细菌是结肠中丁酸盐的主要生产者
Utilization of nondigestible carbohydrates by butyrate-producing bacteria is well documented (4, 5). However, there is limited information about their requirements for growth factors (nucleotides, amino acids, and vitamins).
重要概念:原养生物和营养缺陷型细菌
原养生物prototrophs: 能够产生生长因子的细菌称为原养生物 Bacteria able to produce growth factors are called prototrophs;
营养缺陷型细菌auxotrophs: 不能产生原养生物的细菌则是营养缺陷型细菌,需要从外部来源获得原养生物,包括食物或其他细菌的交叉喂养;bacteria that cannot produce them are auxotrophs and need to obtain them from external sources including diet or cross-feeding by other bacteria
相关研究:最近的一项研究探索了96个人类肠道细菌菌株的营养偏好https://pubmed.ncbi.nlm.nih.gov/29556107/
,但来自 Lachnospiraceae 和瘤胃球菌科成员的数据仍然有限;
维生素的重要性:维生素通常是细菌代谢所需的主要有机微量营养素,特别是 b 族维生素(生物素[ B7] ,维生素 b 12] ,叶酸[ B9] ,烟酸[ B3] ,泛酸[ B5] ,吡哆醇[ B6] ,核黄素[ B2]和硫胺素[ B1])。
维生素的作用:
它们主要作为酶辅助因子或辅助因子的前体(8)。
丁酸的产生与维生素的关系:
丁酸的产生直接取决于两种维生素的存在: 硫胺是丙酮酸的辅因子: 铁氧化还原酶,从丙酮酸生成乙酰辅酶A (乙酰辅酶 a) ,核黄素是电子转移黄蛋白复合物的一部分,与丁酰辅酶 a 脱氢酶一起,从巴豆酰辅酶 a (10)生成丁酰辅酶 a。
微生物产维生素:
微生物群中某些维生素途径基因的丰富性已被观察到在人类的生命历程中发生变化。例如,叶酸合成基因似乎富集在婴儿的肠道微生物群中,而钴胺素和硫胺生物合成基因随着年龄(19,20)增加。微生物组中某些维生素生物合成基因丰度的差异在不同人群中也有报道(19)。另一方面,评估肠道细菌合成维生素能力的实验研究则有限得多。现有的资料也揭示了基因组研究在预测代谢能力方面的局限性,如计算机数据和体外数据之间的差异(7,15,21)。在产丁酸菌中,只对粪便杆菌的维生素需求量进行了实验研究(21,22) ,并假设普氏杆菌使用核黄素作为氧化还原介质(23);
肠道微生物产生氨基酸:
人体大肠细菌氨基酸分解代谢的研究(参考文献24-26) ,但氨基酸的生产主要是研究瘤胃细菌(27,-30)。对单胃动物(包括人类)的研究已提供证据证明微生物起源的氨基酸对动物宿主的必需氨基酸库(31,-33)的贡献,但没有提供产生和/或排泄这些氨基酸的物种的详细情况。据我们所知,这项由 Heinken 等人进行的研究是唯一一项通过代谢建模和体外培养评估人类产丁酸细菌氨基酸合成的研究。
实验主要内容:
本研究采用生物合成途径理论分析和体外生长实验相结合的方法,探讨了15株产丁酸肠道细菌对8种 b 族维生素和20种氨基酸两种生长因子的需求。有两种维生素(叶酸和硫胺素)的缺乏导致几个菌株的生长受损,这两种维生素的生长行为是针对一系列维生素浓度而建立的,浓度范围跨越了估计存在于结肠中的维生素浓度,并证明了原生营养细菌和营养缺陷型细菌之间的维生素交叉喂养。
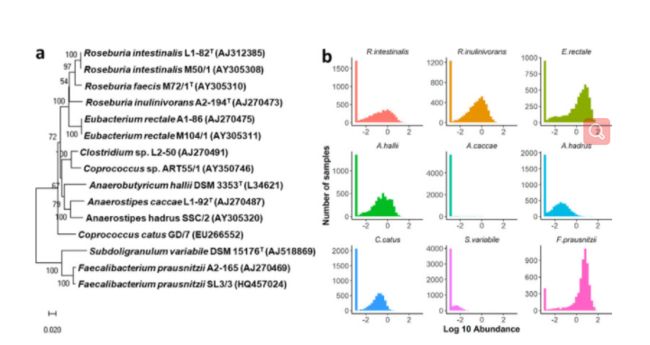
实验材料菌株:这些菌株既包含了高度流行的和/或丰富的种类(如普氏平原铁线杆菌(f. prausnitzii)、回肠真杆菌(Eubacterium rectale)) ,也包含了在许多个体和/或低丰度(如厌氧菌属(Anaerostipes caccae)中未检测到的种类(图1)。
代谢途径的分析:
代谢途径的分析包括查询几个带注释的基因组数据库,然后对选定的基因进行手工 BLASTP 分析,详见材料和方法。
图B 是上述菌株在人群中的分布丰度!
微生物中维生素合成基因的分布情况:
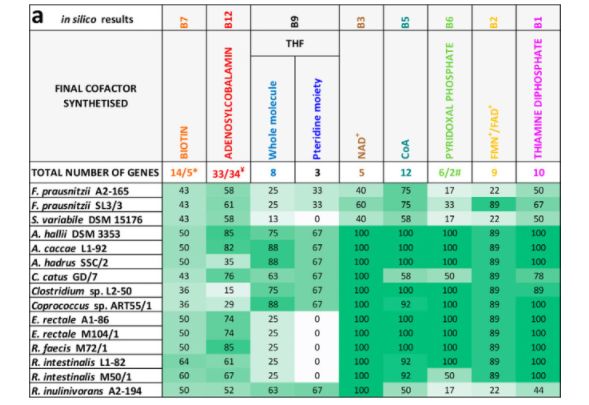
所有维生素的完整分析调查提供了在图。补充材料中的 S1和表 S1,结果的概述见图2a。大多数被检测的菌株含有全部或大部分与烟酸、泛酸、吡哆醇、核黄素和硫胺素有关的辅助因子的生物合成基因。另一方面,生物素、钴胺素和叶酸的生物合成途径在许多被调查的菌株中部分或完全缺失。反刍动物科(Ruminococcaceae)中的普氏拟杆菌(f. prausnitzii)和变形体(Subdoligranulum variabile)基因缺失较多。在螺旋藻科中,大多数蔷薇科和大肠杆菌菌株并不存在叶酸生物合成途径。
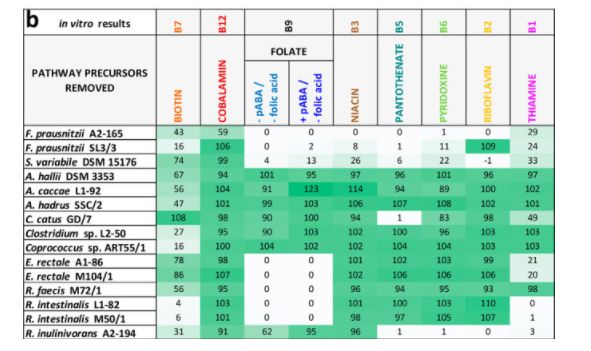
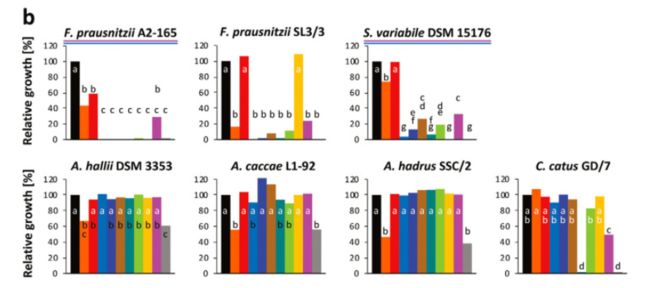
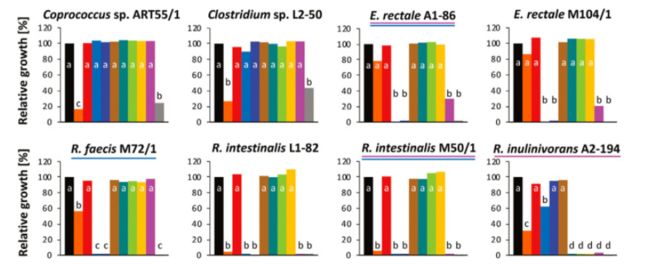
15株丁酸产生菌产生8种维生素途径的电子和体外结果概述。(a)计算结果。显示了新生生物合成途径中基因存在的百分比(当存在不同的维生素合成途径时,只有最高百分比的基因显示; 详情见图。中一及表中一)。* 主要途径中有14个基因(除了肠道菌株 M50/1)和5个替代途径中的5个基因(肠道菌株 M50/1) ,其中1个或2个第13步基因; # 主要途径中有6个基因(f. prausnitzii,s. variabile DSM 15176,r. inulinivorans A2-194)和2个替代途径中的基因(其余菌株)。(b)体外测试结果。在缺乏相应的维生素或前体的情况下,所有维生素存在的阳性对照组的生长百分比显示出来(图3中给出了显著的差异)。对氨基苯甲酸。颜色渐变反映百分比(0% [白色]到最大百分比[深绿色])。
维生素的存在与否对培养的影响:
为了在体外评价营养缺陷,开发了完全定义的无维生素或无氨基酸培养基。用不含维生素的酪蛋白酸水解物或单个氨基酸代替 Bacto Casitone 和酵母提取物,分别进行维生素和氨基酸缺陷营养试验,以及其他微量元素和微量元素试验。大多数螺旋藻科植物在规定的培养基中生长良好,但两种瘤胃球菌科植物生长较差,初步测定的4个瘤胃球菌菌株(A2-165、 SL3/3、 M21/1和 L2-6)中,只有 A2-165和 SL3/3能在规定的培养基中生长(未显示数据) ,并作进一步分析。
所有菌株都在缺乏八种维生素辅助因子之一及其前体的情况下生长,以验证硅胶结果。
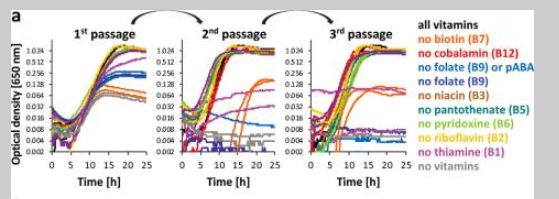
成年培养物继代培养两次,以确保剩余的维生素从包含所有维生素的前培养不影响结果。典型的生长曲线如图3a 所示,为罗斯伯里亚肠 M50/1(所有的生长曲线如图所示。S3) ,以及在第三代缺乏单个维生素的情况下所取得的最终生长相对于所有菌株的阳性对照如图3b 所示。大多数细菌菌株可以在没有钴胺素、烟酸、泛酸、吡哆醇和核黄素的情况下生长,而一些细菌在没有生物素、叶酸和硫胺素的情况下生长不理想或根本没有生长。细菌中缺陷型数量最多的菌株分别是普鲁斯尼茨菌 A2-165和 SL3/3,变异链球菌 DSM 15176和伊努里沃氏菌 A2-194。大多数菌株属于罗斯伯里亚/e。在缺乏叶酸或同时缺乏四氢叶酸前体(对氨基苯甲酸和叶酸)的情况下,rectale 组显示没有生长。图2b 展示了与计算机数据(图2a)比较的体外结果的概述,这表明生长实验与叶酸、烟酸、泛酸、吡哆醇和核黄素的基因组预测是一致的。然而,在体外和计算机数据显示生物素、钴胺素和硫胺素存在一些分歧。
上述图表的解释:缺乏维生素条件下产丁酸细菌的生长。(a)在 CAH-CDM 的三个通道中,在96个孔板中,肠壁菌 M50/1的生长缺乏个体维生素及其各自的前体,而阳性对照(黑线)缺乏所有维生素,阴性对照(灰线)缺乏所有维生素。(b)相对于15个不同菌株第三代的阳性控制的最终光密度。在亨盖特管中分别培养了普氏拟杆菌(f. prausnitzii)菌株和黄斑假丝酵母(C.catus GD/7)菌株。所有其它菌株均在96孔板中培养。对照组在不同菌株的维生素浓度范围从0.392到1.372不等。所有的生长曲线如图所示。补充材料中有 S3。混合的标准差在每个菌株2.2到14.7之间。信件请参阅 Tukey 测试结果。具有共同字母的处理差异不显著(p 值 < 0.05)。在人工合成的群落交叉喂养试验中用作硫胺素和叶酸营养缺陷型的菌株分别用粉红色和蓝色划线标出。
维生素纯培养和混合培养的生长数据。(a)在所有维生素存在的情况下,用于建立生长相对于阳性对照的维生素营养缺陷筛选的复制数量。除了 A2-165菌株、 SL3/3菌株、 DSM 15176菌株、 L1-92菌株、 A1-86菌株、 M104/1菌株和 A2-194菌株外,其他菌株的维生素浓度见表 S5。(b)维生素营养缺陷筛在单一维生素浓度下的生长曲线。灰线表示图3所用的数据(细线表示 Hungate 管的增长和单一 OD 读数,粗线表示96孔板的增长和平均数据超过1小时)。(c)在叶酸或硫胺素浓度增加的情况下,纯培养生长的复制数目(稳定 od/生长率)。(d)所有维他命条件及品系的生长曲线。灰线表示图4c 和 d 所用的数据。下载图 S3,PDF 档案,1.2 MB。
不同浓度的硫胺和叶酸对微生物生长的影响:
在硫胺(红色)或叶酸(蓝色)浓度增加的情况下生长的菌株的纯培养生长参数。(a 至 d)图表显示了指数相(a 和 b)的最大增长速率,并显示了稳定相(c 和 d)的光密度。营养缺陷型菌株呈黑色,硫胺素型和叶酸型菌株分别呈红色和蓝色。相应的生长曲线如图所示。3 d.图示突出显示最接近体内估计浓度的浓度(34)。字母表示方差分析,不同字母的处理差异显著(p < 0.05,无字母表示无显著性差异)。
为什么选择这几种氨基酸:
由于氨基酸生物合成途径的计算机研究揭示了大多数菌株和氨基酸检测的完整途径的存在,体外实验只对选定的菌株进行。所有菌株的生长水平与 AA-CDM 阳性对照相似(化学定义培养基中含有游离氨基酸混合物[见材料和方法]) ,缺乏丙氨酸、天冬酰胺、苏氨酸、赖氨酸或组氨酸(图。S4) ,这表明缺乏单个基因可能是由于基因组注释较差,并且可以通过手工 BLASTP 分析找到的基因被正确识别。缺乏蛋氨酸导致 Anaerostipes caccae l 1-92的生长水平和最大生长速率(,h-1)均低于全氨基酸阳性对照和除半胱氨酸外没有氨基酸的阴性对照(图2)。全氨基酸为0.68 ± 0.02,无氨基酸为0.37 ± 0.02,无蛋氨酸为0.10 ± 0.01,p < 0.05。结果表明,在没有色氨酸存在的条件下,普劳斯尼茨氏菌 SL3/3、变异链球菌 DSM 15176和伊努里沃氏菌 A2-194等缺失色氨酸生物合成基因的菌株无生长。S4).粪球菌属。ART55/1和变异链球菌 DSM 15176在芳香族氨基酸生物合成的中心途径中缺失基因,而 Coprococcus sp. 。ART55/1能够在没有所有芳香族氨基酸的情况下生长,而变异链霉菌 DSM 15176则不能生长(图)。S4).三种芳香族氨基酸不同组合情况下的生长模式与 Coprococcus sp. 一致。ART55/1为全营养型,dsm15176为营养缺陷型,仅为色氨酸型(未显示数据) ,说明这两个菌株的分离途径缺失的基因是由于基因组信息不完全所致。总的来说,选定的生长试验结果表明,这里调查的细菌除了色氨酸以外,大部分都是原生营养的。
Cross-feeding between vitamin auxotrophs and prototrophs in synthetic communities. 合成群落中维生素营养缺陷型与原生营养体的交叉喂养
The
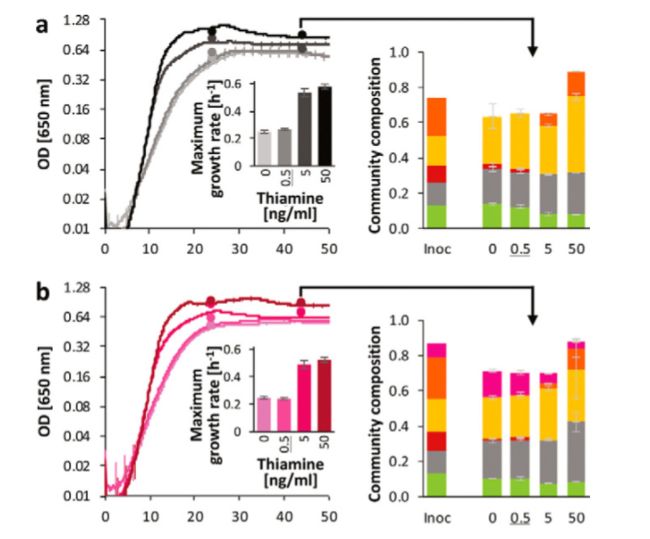
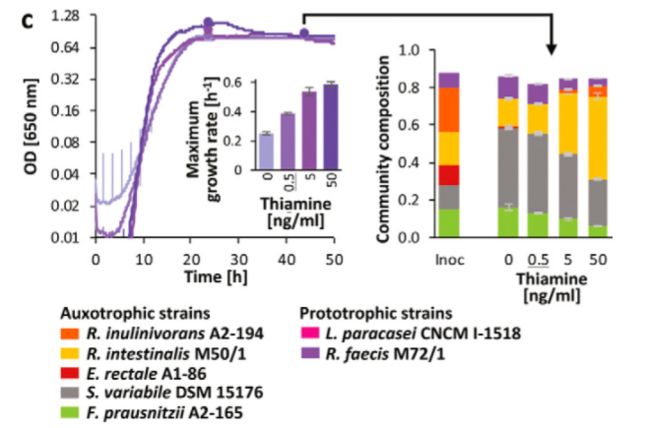
这里确定的生长营养素是否可能影响细菌在体内的生长特性。因此,我们检查了选择的营养缺陷型菌株的生长行为为两种维生素,几个营养缺陷型鉴定,硫胺和叶酸。O’ keefe 等人(34)估计了结肠中这些维生素的含量,他们发现叶酸水平很高(大约0.46 g/g 结肠排出物; 相比之下,1个 CDM 含有0.05 g/ml,0.11 m)。结肠硫胺素浓度较低(约0.001 g/g; 1 CDM = 0.05 g/ml,0.15 m)。5株营养缺陷型菌株在不同的维生素硫胺和叶酸浓度范围内(0.05 ng/ml 至5 g/ml)生长。我们还研究了原生营养菌株是否能够刺激营养缺陷型菌株的生长,这将证明它们交叉喂养维生素(在缺乏外部维生素的情况下)或其他生长因子(在有外部维生素的情况下)的能力。测试的原生营养菌包括本文研究的一些丁酸产生菌(粪粉刺玫瑰(Roseburia faecis M72/1)和粪球菌(Coprococcus sp.)。ART55/1的叶酸)以及非丁酸产生菌(副巴西乳杆菌的硫胺,嗜热链球菌的 CNCM I-1518和双歧杆菌的 CNCM I-3650的叶酸)。在含维生素培养基中生长后,对所有菌株进行洗涤去除培养基中的维生素,然后在纯培养和混合培养中进行生长试验。在此过程之后,清洁培养基中的 f. prausnitzii A2-165没有显示任何生长,但在 M2GSC 培养基(35)中平行培养生长,表明清洗过程之后细胞仍然存活(数据未显示)。所有其他营养缺陷型菌株均在 CDM 中生长(图4)。营养缺陷型菌株的生长依赖于维生素浓度,而原生营养型菌株的生长特性与维生素浓度无关。S3).
(i)硫胺素。硫胺素营养缺陷型沙门氏菌 DSM 15176、 rectale A1-86、 r. inulinalis M50/1和 r. inulinivorans A2-194只有在5ng/ml 硫胺素或更高水平时才表现出最佳生长,高于体内估计浓度(34)。低浓度硫胺素对大肠杆菌 A1-86的影响最为严重,在低于5g/ml 的所有浓度下,生长速度均减慢(图4a 和图 c)。C).在没有硫胺素的条件下,在0.5ー50ng/ml 硫胺素浓度范围内培养出硫胺素与营养缺陷型菌株(包括 f. prausnitzii A2-165)加副马铃薯干细胞株 CNCM I-1518或 r. faecis M72/1作为原养菌。结果表明,群落组成、硫胺素浓度及其相互作用对菌株的生长速度、总稳定光密度(OD)和丰度均有显著影响(p < 0.05) ,除变异链球菌 DSM 15176外,其他菌株的生长速度、总稳定光密度均无显著影响(p > 0.05)。在所有条件下,只含有营养缺陷型菌株的五元共培养体系均可观察到生长,但在0、0.5和5ng/ml 硫胺素浓度下,固定相 OD 显著低于50ng/ml 硫胺素浓度(p < 0.0001) ,在较低的硫胺素浓度下,最大生长速率显著低于较高的硫胺素浓度(p < 0.0001)。微生物群落组成以肠道菌群 M50/1和变异链霉菌 DSM 15176为主。在两个较低的维生素浓度下也存在较高的丰度(p < 0.0001)。因此,尽管在实验条件下不能在纯培养基中生长,但似乎是其他细菌的存在促成了这种菌株的生长。只有在较高的硫胺浓度下才能检测到伊努力沃氏菌 A2-194,而雷卡勒大肠杆菌 A1-86只有在较低的硫胺浓度下才能检测到。在原营养菌株 CNCM I-1518(图5b)存在下,总体生长和群落组成与各营养缺陷型共培养菌相似,在硫胺素浓度最高时总体生长显著增加(p < 0.0001) ,0和0.5 ng/ml 硫胺素浓度的原营养菌株相对生长较好(p < 0.0001) ; 在所有硫胺素浓度下,副营养菌株 I-1518占总群落的比例在21.4 ± 0.8ー4.2 ± 0.7之间。这表明该菌株对群落的影响很小,并且不是一个有效的硫胺素交叉喂食者。另一方面,在原养菌 M72/1(图5c)存在下,所有处理的固定 ODs 相似,在0.5 ng/ml 硫胺素存在下的生长速率明显高于其他两种共培养基(只有营养缺陷型和营养缺陷型加副马齿苋 CNCM I-1518,p < 0.0001)。变异沙门氏菌 DSM 15176受粪便沙门氏菌 M72/1的影响最大,与其他两种共培养相比,在没有硫胺素的情况下和在两种浓度较低的情况下,沙门氏菌的生长情况较好(p < 0.0001)。与原生菌株 l. paracasei CNCM I-1518相似,粪氏菌 M72/1在两个较低的硫胺素水平上竞争较好(p < 0.0001,14.2% ± 0.6% ー4.5% ± 0.2%)。
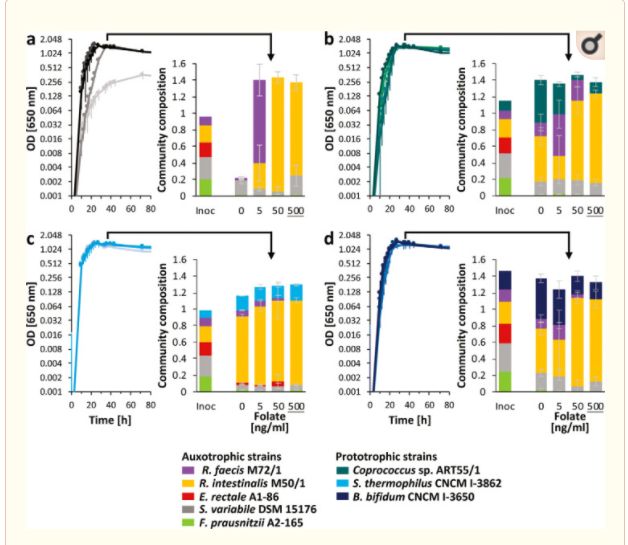
(ii)叶酸。叶酸营养缺陷型菌株 dsm15176、 e. rectale A1-86、 r. intestinalis M50/1和 r. faecis M72/1在叶酸至少50ng/ml (约比体内条件下估计值低10倍)的情况下,大多数菌株都表现出合理的生长速度(图4d) ,尽管生长速度明显较低,但大多数菌株叶酸最高浓度为5 g/ml (图4b)。浓度低于5至50纳克/毫升导致完全没有生长的大多数营养缺陷型。对变异链球菌 DSM 15176、 e. rectale A1-86和 r. faecis M72/1进行了延长的滞后期观察,甚至在一些菌株体内叶酸浓度接近估计的500ng/ml (图。S3d).在 Hungate 试管中与上述菌株进行叶酸共培养,获得了更为理想的叶酸生长条件,因为96孔板中叶酸在厌氧箱中的生长情况比亨盖特管中的差(未见数据)。选择一个较高的浓度范围(高达500纳克/毫升)比硫胺反映估计叶酸在体内的有效性。除方差分析外,其他菌株的群落组成、叶酸浓度及其相互作用对固定光合速率和丰度均有显著影响(p < 0.05) ,而群落组成仅显著影响固定光合速率和丰度。在缺乏叶酸的情况下,五元营养缺陷型微生物群落的生长十分有限,主要检测到变异链球菌 DSM 15176。在叶酸浓度为5ng/ml 时,菌株 M72/1成为优势菌株,其次是菌株 M50/1,在叶酸浓度最高的两个水平上均成为优势菌株(图6a)。研究了3种不同的原营养细菌对同一营养缺陷型 Coprococcus sp. 的交叉摄食行为。ART55/1(图6b)、嗜热链球菌 CNCM i-38621(图6c)和双歧杆菌 CNCM i-36501(图6d)。在没有叶酸和叶酸存在的情况下,Coprococcus sp. 的所有原生营养菌株的总体群落生长是相似的。在缺乏叶酸的情况下,ART55/1和 b. bifidum CNCM I-3650分别占群落的36.4% ± 3.8% 和35.3% ± 3.4% 。另一方面,嗜热链球菌 CNCM I-3862对营养缺陷型菌株的生长有促进作用,尤其是对肠道营养缺陷型菌株 M50/1,对整个群落的生长贡献率仅为14.9% ± 0.4% (图6)。此外,在存在的嗜热链球菌 CNCM I-3862,在没有叶酸的情况下,群落剖面与高叶酸培养的相似,并且可以检测到大肠杆菌 A1-86(在两个较低的叶酸浓度下可达2.3%)(图6c)。
叶酸浓度增加时 Hungate 管内共培养生长的研究。(a 至 d)生长曲线(随叶酸浓度的增加而增加的黑暗)表现为一个五元营养缺陷型群落(a)或一个叶酸原生营养型菌株(Coprococcus sp。55/1[ b ] ,嗜热链球菌 CNCM I-3862[ c ] ,或 b. bifidum CNCM I-3650[ d ])。彩色的堆叠柱状图显示了菌种(Inoc)的相对群落组成(相对于生长培养菌的可见度为300)和生长36小时后的稳定期(如箭头所示)。所有菌株的百分比之和按原样品的 OD 进行标定。强调叶酸浓度最接近体内浓度的估计值(34)。
大肠中维生素和氨基酸的浓度是小肠内流、肠道微生物群的利用和生产以及宿主吸收之间平衡的结果(36,37)。健康人的结肠内容物中维生素 b 的浓度有所不同(34) ,其水平可能受饮食习惯或某些疾病状态的影响,这可能对肠道微生物群落有影响(38)。在这里,我们结合细菌基因组序列的电子计算分析和体外生长试验,以建立人体大肠中15个产丁酸细菌对维生素和氨基酸的生物合成能力。基于网络平台 PATRIC 和生长数据的基因组数据的初步比较显示了某些差异,但进一步的人工搜索发现,实际上存在一些缺失的基因。这突出了体外测试的相关性和存储在公共数据库中的基因组信息的局限性。最近一项对2000多种细菌基因组中维生素生物合成途径的研究,除了一种细菌(r. faecis M72/1)之外,其他细菌都包括在内(18)。我们的基因存在百分比是基于完整的路径,然而 Rodionov 等人(18)将特征基因的一个分段定义为从头生物合成的指标,忽略了在所有实验验证的原型生物中没有检测到的基因。当只考虑这些特征基因时,我们的数据与他们对生物素、叶酸、烟酸、泛酸、吡哆醇、核黄素和硫胺素的预测是一致的,但是对于 Rodionov 等人指定为维生素钴原营养的大多数菌株来说,并非所有维生素钴生物合成的特征基因都能在这里被鉴定出来(见补充材料中的表 S1)。
由于基因组注释(7)的局限性,在体外生长试验的电子结果中进行确认是重要的。人体肠道细菌,特别是属于厚壁菌的一些种类,很难生长,常规使用复合培养基成分。必须建立完全确定的培养基来测试微量营养素的需求,而且据我们所知,这里检测的大多数菌株以前都没有在这样的培养基中生长过。对于大多数的螺旋藻科植物来说,在这里使用的两种培养基中都可以获得良好的生长,但是对于较挑剔的瘤胃菌科植物来说,即使加入了其他报道的培养基成分,两个菌株(M21/1和 L2-6)仍然无法生长(21)。关于氨基酸生物合成,我们的结果表明,调查菌株大多是原生营养,这是与以前的研究(39)一致。根据这些缺乏色氨酸生物合成途径中几个基因的菌株,只有在缺乏色氨酸的情况下,才发现这三个菌株无法生长。其他基因缺失(大部分是单个基因)在体外没有得到确认,可能是由于基因组注释不准确或缺少序列数据。这里分析的不同基因组的完整程度差异很大,从完整基因组到179个非支架重叠群(表 S3)。因此,Coprococcus sp. 缺乏三个分支酸生物合成基因。ART55/1(总装配间隙长度,235 kb) ,生长测试不能证实,可能是由于缺少序列信息。此外,丙氨酸和蛋氨酸生物合成的氨基转移酶往往具有重叠的底物特异性(40) ,可能没有正确指定。
最近,Tramontano 等人(7)评估了氨基酸对某些菌株生长的抑制作用。克拉氏拟杆菌、木聚糖类拟杆菌和美丽拟杆菌对芳香族氨基酸的存在比较敏感。在这里,我们大多没有观察到在不同培养基中生长速度的主要差异。然而,当培养基中只去除蛋氨酸时,与其他条件相比,只去除蛋氨酸时,a. caccae L1-92的生长速率显著降低,包括除半胱氨酸外缺乏所有氨基酸的阴性对照。这表明在其他氨基酸存在时,蛋氨酸的缺失可能影响氨基酸生物合成途径的调节。
维生素营养缺陷型最多的种类为F. prausnitzii, S. variabile, and the E. rectale/Roseburia group。先前的研究已经发现,增加 b 族维生素的消耗(特别是核黄素、钴胺素、叶酸和吡哆醇)与这些肠道细菌的丰富度(41,42)有关。有趣的是,这些物种是人类肠道微生物群中最普遍和最丰富的物种之一(图1) ,但是 b 族维生素的缺陷型观察可能使它们对环境变化更加敏感。生长试验与大多数维生素的计算机预测结果吻合良好,但硫胺素、生物素和钴胺素的生长试验结果存在差异。虽然所调查的 e. rectale 和 r. intestinalis 菌株都具有合成硫胺素所需的所有基因,但它们在没有硫胺素的情况下无法生长。目前尚不清楚合成基因在这些细菌中是否没有表达或没有功能,因为它们可能适应从环境中抢救前体,或者介质中的分子是否可以抑制某些基因。Rodionov 等人(18)(BioF,BioA 和 BioD)定义的生物素生物合成的四个标志基因中的三个在我们的大多数菌株中也被发现缺失; 然而,在缺乏生物素的情况下,大多数菌株的生长并没有完全停止,即使在无生物素培养基中传递了三个菌株。生物素是参与脂肪酸合成、氨基酸代谢和三羧酸循环的不同羧化酶的辅助因子。1940年代和1950年代进行的一些研究表明,生物素需求是由某些合成过程决定的,例如某些种类的乳酸菌的天冬氨酸生产,当天冬氨酸供应时,它们对生物素的需求较低(45,46)。因此,氨基酸的存在可以降低生物素的需要量。有关肠道细菌所需维生素水平的信息很少,但某些研究估计其他细菌中这种辅助因子的细胞内浓度相当高(大肠桿菌细胞质中的40m 生物素[47])相对于其他维生素(15)。
这里调查的菌株都没有合成维生素 B12辅酶所需的全部基因。Rodionov 等人(18)和 Shelton 等人(48)报告称,即使在已验证原生营养状态的菌株中,钴胺素的生物合成路径通常也是不完整的。在评估他们的研究中报告的特征基因时,只有 r. faecis M72/1包含 Rodionov 等人鉴定的所有18个基因(18) ,而 Shelton 等人定义的7个基因(48)只在我们的菌株中的6个菌株中发现(表 S1)。在大多数其他菌株中,这两个研究中都有70% 以上的特征基因存在,但是厌氧菌 SSC/2、梭菌 L2-50和 Coprococcus sp。ART55/1几乎不含任何生物合成钴胺素的基因,很可能是善意的营养缺陷型。然而,我们的体外试验显示,除了 f. prausnitzii A2-165之外,所有菌株在没有钴胺素的情况下都有良好的生长。一些肠道微生物可能不需要钴胺素,因为他们有 b12独立的酶(11)。对该项目15个基因组的 BLASTP 分析表明,某些菌株,包括三个未携带氨基酸生物合成途径的菌株(表 S4)中存在 MetE 酶(一种与 b12无关的蛋氨酸代谢依赖性方法的替代酶)。tRNA 的合成也需要维生素 B12,但是一种与 B12无关的酶,环氧鸟苷还原酶(QueH)已被报道(48,49)。除了肠道杆菌 M50/1和 Coprococcus sp. 外,我们所有的菌株中都检测到了 QueH。ART55/1(表 S4) ,这可能是由于草图基因组中缺失的数据(表 S3)。核苷酸生物合成也包含 b12依赖的步骤(48)。然而,b12独立酶变异体 NrdD (厌氧核苷三磷酸还原酶 III 类)似乎存在于这里检测的菌株中(表 s 4) ,并且在我们的培养基中提供了核苷酸,因此,在我们的实验装置中不需要外部的钴胺素来满足核苷酸需求。总之,我们的数据表明,这里研究的一些菌株是真正的钴胺素营养缺陷型,但在培养基中存在蛋氨酸和核苷酸以及携带的与 B12无关的基因使得它们在没有 B12的情况下能够生长。然而,我们不能排除的可能性,介质含有痕量钴胺素或钴胺素前体。
交叉摄取食物:
接下来,我们想要探索已鉴定的营养缺陷型菌株是否会从原生营养型菌株的存在中受益。为此,我们建立了合成肠道微生物群落,并监测它们对不同浓度维生素的不同原营养体的反应。合成菌群提供了研究受控系统中细菌相互作用的机会(50) ,并被用于分析微生物相互作用,以指导数学模型的发展(51,52)。在这里,我们使用五个成员的合成菌群来解析硫胺素和叶酸营养缺陷型细菌对维生素和原生营养菌株的反应。硫胺素营养缺陷型细菌的纯培养生长即使在硫胺素浓度超过体内估计浓度的情况下也表现出生长障碍,说明硫胺素可能是体内的生长限制因子。在没有硫胺素的情况下共培养生长较好,这可能是由于其他营养素的交叉补充可以部分缓解生长缺陷或细胞溶解和某些菌株释放硫胺素所致。在有维生素存在的情况下,不同菌株在共培养生长后的相对丰度存在较大差异,大部分群落为肠炎沙门氏菌 M50/1,其次为变异沙门氏菌 DSM 15176。这表明不同菌株竞争营养物质的能力不同,或生长特性的内在差异(如最大生长速度或基因调节差异)。在缺乏维生素的情况下,营养缺陷型菌株的相对丰富度存在差异,尤其是叶酸。原营养菌株对群落组成影响不大,在维生素充足的条件下只占整个群落的一小部分,但在缺乏维生素的情况下大部分变得更加丰富,这表明它们在这些条件下的竞争能力增强。然而,在缺乏维生素的情况下,它们对营养缺陷型菌株表现出了变异性和菌株特异性的影响,并且它们将群落组成恢复到维生素充足条件下的不同能力,这表明它们与其他群落成员分享维生素的能力存在差异。有趣的是,在硫胺素缺乏的情况下,存在 r. faecis M72/1,导致 s. variabile DSM 15176的增加,损害了 r. intestinalis M50/1,这可能是由于两个 Roseburia 菌株之间更强的竞争。这两个共培养的罗斯布里亚菌株均为营养缺陷型,也表明它们之间在低叶酸浓度下存在强烈的竞争,在高叶酸条件下,玻璃菌 M50/1表现出优良的生长。到目前为止,Bacteroidetes 已经对近缘物种的稳定共存进行了研究,主要集中在糖代谢,但是我们的数据表明,肠道微环境中维生素需求和维生素供应的潜在差异也应该被考虑进去。然而,其他类型的拮抗相互作用,如细菌素的产生,也可能有助于相关菌株之间的竞争。在一次清洗去除多余的维生素后,普劳斯尼茨基 A2-165在合成培养基中没有生长,但它受到营养缺陷型群落的刺激,这表明它需要群落成员提供的其他生长因子,并且与其他研究一样,对其他微生物有很强的依赖性
总之,这是第一次通过直接比较硅胶和体外方法来评估人类肠道中一系列产丁酸细菌种类对维生素和氨基酸的需要量。有趣的是,反刍动物科(f. prausnitzii 和 s. variabile)的缺陷型数量大于螺旋藻科(Lachnospiraceae)。只有有限数量的瘤胃球菌科被调查在这里,它仍然有待确认这是否也适用于其他物种在这厚壁菌科。在我们共培养的概念证明研究中,我们提供了营养缺陷型和原生营养型菌株对维生素 B1(硫胺素)和 B9(叶酸)交叉喂养的证据。虽然目前的实验为原生菌株刺激生长的能力提供了第一手资料,但是未来的纵向实验结合了对群落中每个成员和维生素的详细追踪,还是有必要的。营养缺陷型和原营养型细菌在某些健康条件下可能受到不同的影响,而且在不同的维生素利用率下,无论是从饮食中还是通过微生物群内的交叉喂养,都可能受到不同的影响,这可能是 Steinert 等人最近讨论的决定微生物群组成和功能的一个重要因素(38)。更好地了解微生物对维生素的需求以及微生物与微生物之间的相互作用,将有助于设计基于微生物区系的方法来支持有益微生物。
材料:
十五个菌株属于12个优势和亚优势产丁酸物种,Fifteen strains belonging to 12 dominant and subdominant butyrate-producing species from the Lachnospiraceae and Ruminococcaceae families with publicly available genomes were assessed for vitamin and amino acid auxotrophies。采用来自达能菌株收集的双歧杆菌 CNCM I-3650、副干酪乳杆菌 CNCM I-1518和嗜热链球菌 CNCM I-3862进行共培养实验。培养基为: M17 + 1 g/l 半胱氨酸(s. thermophilus CNCM I-3862)或 MRS + 1 g/l 半胱氨酸(b. bifidum CNCM I-3650,l. paracasei CNCM I-1518)(培养基购自 Oxoid,Thermo Fisher Scientific,沃尔瑟姆,MA,USA) ,在 CDM 中继代培养。
培养基:
以半定量培养基 YCFA (60)为基础,但对氮源进行了修饰: 用不含维生素的酪蛋白水解物(CAH)或游离氨基酸混合物(AA)代替酪蛋白酶消化物 Bacto Casitone (酪蛋白)和酵母提取物。当使用酪蛋白酸水解液时,培养基中添加了某些可能受酸水解过程影响的氨基酸(l-色氨酸、 l-丝氨酸、 l-苏氨酸、 l-谷氨酰胺和 l-天冬酰胺)(61)。此外,不同的核苷酸,微量元素和维生素的解决方案加入,以弥补缺乏酵母提取物在清洁发展机制。表 S5中的维生素浓度被指定为1,但更多的维生素被用于某些菌株的生长(f. prausnitzii A.-165和 SL3/3,变异链球菌 DSM 15176,a. caccae L1-92,e. rectale A.-86,和 M104/1,以及 r. inulinivorans A.-194; 基础水平以上的50种维生素)。pH 值在6.3至6.8之间,详见表 S5。
处理:
在 CDM 培养基中,对15株丁酸产生菌的维生素 B7、维生素 B12、叶酸(B9)、烟酸(B3)、泛酸(B5)、吡哆醇(B6)、黄素(B2)、硫胺素(B1)和9种氨基酸(丙氨酸、天冬酰胺、苏氨酸、甲硫氨酸、赖氨酸、组氨酸)以及芳香族氨基酸顶氨酸、苯丙氨酸和酪氨酸的合成进行了研究。为了确定维生素缺陷型,除叶酸外,所有的前体物质和给定维生素的辅助因子都被从培养基中去除,为此我们设立了两个实验处理来研究这些菌株是否有能力合成四氢叶酸分子的不同部分(紫檀环和对氨基苯甲酸)。为了评价氨基酸缺陷型,对 AA-CDM 培养基进行了一次去除单个氨基酸的实验。嗜粪球菌。研究了 ART55/1和变异链霉菌 DSM 15176对芳香族氨基酸不同组合的去除效果。
检测生长:
所有的氨基酸实验和大部分的维生素实验都是在平底的96孔板中进行的(Costar; Corning inc. ,NY,USA) ,密封在37 ° c 的密封条中,在 Don Whitley 无氧工作站(英国宾利)(80% N2,10% CO2,10% H2)的微孔板阅读器(Epoch 2,BioTek Instruments inc. ,VT,USA)中在650nm 处读取。
摇动平板(双轨道模式,频率: 425 cpm [3 mm ]) ,在整个生长实验期间每10分钟读一次。无论使用何种培养基或维生素水平,catus Coprococcus GD7都表现出聚集性生长,而且两株 f. prausnitzii 都表现出非常缓慢的生长。因此,这些菌株的维生素实验是在亨盖特管(气相100% CO2)中进行的,以便在确定光密度之前使培养物充分混合,或避免在平板阅读器中进行长时间的动力学实验。Hungate 管在37 ° c 静态培养,均质化,并在诺瓦斯佩克 II 型可见光谱仪中650nm 处读数。(Pharmacia LKB Biotechnology AB,乌普萨拉)。96孔板和亨盖特管的顶空度分别为总体积的三分之一(分别为100l 和5ml)。