- 原文:Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions
-
doi: 10.1186/s13073-016-0296-x
摘要:
基于质谱和核磁共振的代谢组学研究比较了患病个体和健康个体,结果表明,微生物代谢产物通常是在疾病状态下变化最明显的化合物。 最近的研究表明,这些源自饮食成分的微生物转化的代谢物中的几种对生理过程具有重要影响,例如肠道和免疫稳态,能量代谢,血管功能和神经行为。
在这里,我们回顾了几种最有趣的饮食依赖性代谢物,这些代谢物可能会影响宿主生理,因此可能是治疗干预措施的合适靶标,例如短链脂肪酸,三甲胺N-氧化物,色氨酸和酪氨酸衍生物以及氧化脂肪酸。 此类干预将需要调节细菌种类或产生这些代谢产物所需的细菌生物合成酶,因此,我们简要介绍了目前对其生物合成中涉及的细菌和酶促途径的理解,并总结了其作用的分子机制。 然后,我们将更详细地讨论这些代谢物对健康和疾病的影响,并回顾调节这些代谢物水平以促进人类健康的当前策略。 我们还建议未来的研究,以实现针对肠道菌群的全部治疗潜力。
饮食成分的微生物转化改变与疾病相关哺乳动物与驻留在胃肠道中的数万亿个微生物细胞之间的共生关系依赖于复杂的分子对话,而微生物代谢产物是这种对话的主要媒介。
微生物在宿主生理中的几种代谢途径的基本作用已被长期确立,包括在维生素K的生产,水溶性B维生素(包括生物素,叶酸,烟酸,吡ido醇,核黄素,钴胺素和泛素酸)的生产中,降解 饮食中的草酸盐和胆汁盐的修饰(在[1,2]中进行了综述)。
然而,在过去的十年中,人们对肠道菌群产生了浓厚的兴趣,导致发现了许多新的领域,其中饮食成分的细菌转化可能在宿主健康和疾病中发挥关键作用。 对饮食-微生物群-宿主相互作用的这种加深了解显示出创造新治疗方法的巨大机会,包括选择性地改变分子的微生物产生以促进人类健康和预防疾病[3]。 要阐明可调节宿主生理的目标微生物代谢物,需要确定健康个体和患病个体之间存在差异的主要代谢物(及其下游由其I / II期异源生物代谢酶形成的下游共代谢物),并评估这些代谢物的生物学活性。 在过去的十年中,一系列具有里程碑意义的代谢组学研究通过使用质谱(MS)或核磁共振(NMR)分析来识别源自肠道微生物的潜在重要微生物代谢物[4-10],极大地增进了我们的理解。 在患病个体中富集或枯竭[11-30],或可用于预测对食物或其他干预措施的生理反应 (表1)。
·这些研究已经确定了许多可能在人类健康和疾病中发挥重要作用的代谢物,包括短链脂肪酸(SCFA)和长链脂肪酸代谢物,例如共轭亚油酸(CLA)和10-羟基-顺式 12十八碳酸酯(HYA); 三甲胺(TMA)和三甲胺N-氧化物(TMAO); 色氨酸代谢物,例如吲哚,3-丙酸吲哚(IPA)和硫酸吲哚酚(IndsS); 酪氨酸和苯丙氨酸代谢产物,例如马尿酸,苯乙酰基甘氨酸,硫酸苯酯,对甲酚硫酸盐(PCS),苯丙酰基甘氨酸,肉桂酰基甘氨酸和雌马酚硫酸盐。这些研究确定的许多代谢产物是由特定饮食组成部分转化而成的,这些特定饮食组成部分的微生物通过表达必需的酶来作用于这些组成部分的特定微生物进行转化。 因此,利用这些依赖饮食的代谢途径来改变微生物的存在可能是理解宿主对特定饮食成分和疾病易感性的反应的关键 。
-
表1:
-
ASD自闭症谱系障碍,BMI体重指数,CKD慢性肾脏疾病,CVD心血管疾病,EPS 4-乙基苯基硫酸盐,HFD高脂饮食,IBS肠易激综合征,IPA吲哚-3-丙酸酯,PCS对甲酚硫酸盐,SCFA短链脂肪酸,TMA三甲胺,TMAO三甲胺N-氧化物;
这篇综述将集中在由肠道微生物群从饮食成分形成的几种关键代谢产物上,这些代谢产物最近被发现会对宿主生理产生显着影响,目前已被靶向或作为人类疾病治疗的靶标。
·我们将简要描述这些代谢物的微生物来源以及这些代谢物在其宿主上的生物学作用。
·然后,我们将更详细地讨论操纵这些代谢物水平的当前和潜在治疗方法,以及了解肠道微生物代谢物潜在价值所需的更广泛的研究领域。
短链脂肪酸
生物合成和分子作用机理
- SCFA是最丰富的微生物代谢产物,在近端结肠中的浓度达到50-130 mM [33]。 糖酵解微生物导致这些SCFA形成的生化途径在[34]中有综述。 乙酸盐是最丰富的短链脂肪酸,是许多微生物产生的乙酰辅酶A(乙酰辅酶A),是许多代谢途径的核心[35]。 丙酸酯主要通过琥珀酸途径合成[36],而丁酸酯主要通过丁酰-CoA:乙酸酯CoA转移酶合成[37]。 由于SCFA的生产取决于各种微生物群落之间复杂的基质交叉进料和废物处理(例如氢气和二氧化碳气体)的处置[34],因此肠成分或细菌菌株SCFA水平与个体饮食之间不存在简单的线性关系。·在考虑增加SCFA的治疗尝试时,这是一个关键点,尤其是因为这些其他废物会对宿主产生严重的胃肠道不适。 因此,仅施用单一饮食成分或细菌菌株可能不会对SCFA产生预期的影响,因此需要仔细确认SCFA水平和其他产品的变化以解释此类研究的结果。
- 乙酸,丙酸和丁酸被归因于许多分子作用机制,可能与其促进肠道健康,减少炎症和抑制癌症的治疗潜力有关(表2)。 尽管这三种SCFA的效价范围都很大,但它们都是G蛋白偶联受体43(GPR43;也称为FFA2)和GPR41(也称为FFA3)的配体 。
·丁酸盐还是GPR109A(也称为羟基羧酸受体)的低亲和力配体[40]。 这三种受体存在于整个胃肠道以及免疫细胞和脂肪组织中,并且与炎症和癌症的调节有关。 此外,丙酸酯和丁酸酯均抑制组蛋白脱乙酰基酶(HDAC)活性,从而改变基因表达,这似乎抑制了许多组织中的肿瘤形成和炎症途径。 在肝细胞和脂肪细胞中,所有三种SCFA似乎都可以调节过氧化物酶体增殖物激活的受体-γ(PPAR-γ)的表达(通过未知的间接机制),从而导致解偶联蛋白2的表达增加,AMP激酶(AMPK)的合成ATP水平降低和活化 。 同样,丙酸酯可调节肠道细胞中的PPAR-γ活性,其作用之一是增加上皮Kruppel样因子4的表达[42],这是一种在抑制结直肠癌中可能很重要的肿瘤抑制因子。 丁酸酯还抑制NF-κB通路(一种典型的促炎信号通路,表达细胞因子,趋化因子和粘附分子的基因)[43-47]。 - 所有这三种SCFA均用作能量底物,丙酸酯用作糖异生的底物,而乙酸盐和丁酸酯用作脂肪酸合成的底物。 SCFA的这些不同作用使它们发挥多能作用,通常可促进肠道健康,减少炎症和抑制癌症,并且,如下面将要讨论的,许多研究已经研究了SCFA或可发酵纤维的治疗潜力。 这些研究的结果通常是模棱两可的,这表明需要对SCFA在各种疾病状态下起作用的适当剂量和确切机制有一个更好的了解,以设计更适当的干预措施。
表2
对肠道炎症和大肠癌的影响
- 腔内SCFA的减少与溃疡性结肠炎和肠道炎症有关,可通过膳食纤维或SCFA的施用来改善[48-50]。 屏障功能降低促进肠道炎症,丁酸通过抑制HDAC诱导肠道细胞“生理性缺氧”来促进屏障功能[51],从而稳定缺氧诱导因子1α从而调节许多改善上皮屏障功能的基因[52]。 丁酸盐对HDAC的抑制作用还通过调节肠道巨噬细胞的功能来促进肠道免疫耐受[53],并通过涉及叉头盒P3(FOXP3)乙酰化和GPR43活化的机制来调节T细胞的发育[54]。 GPR43的缺失会加剧小鼠的肠道炎症[57],而乙酸盐对GPR43的激活也可以防止结肠上皮损伤[58]。 丁酸酯还可以调节肠道紧密连接蛋白的表达,增强上皮细胞增殖,并抑制细胞凋亡[59],可能是通过其对胰高血糖素样肽(GLP)-2分泌的影响而实现的,而后者对胰高血糖素样肽具有营养作用 。 肠道炎症促进结直肠癌的发展,而产生SCFA的细菌对结肠癌发生的抑制作用尚未解决。 除了具有抗炎作用外,当肿瘤细胞系在体外暴露时,丁酸酯还具有抗增殖和抗癌作用[61-63],主要是通过抑制HDAC [64,65]。
·流行病学研究虽然尚无定论,但显示膳食纤维的摄入量与结肠癌的发生率呈反比关系[66-71],这表明纤维发酵导致结肠SCFA增加可能是保护作用的原因。 然而,大型的多中心随机临床试验,例如《息肉预防试验》(n = 2079)[72]和麦麸研究(n = 1429)[73],显示高纤维饮食对复发性息肉的形成没有影响。 但是,其他研究表明,SCFA与人类[74-77]以及动物中结肠癌的发展之间存在不一致的关系(有关研究的重要评估,请参见[78])。 在许多研究中,在能量匮乏的情况下,丁酸酯可刺激细胞增殖[79,80],这很可能是由于丁酸酯是结肠上皮细胞的能量来源。 然而,在过度增殖的状态下,例如由次级胆汁酸诱导的状态[81]或维持在高葡萄糖下的癌细胞[80],丁酸盐抑制增殖。 这些差异可以由以下事实部分解释:癌细胞主要使用葡萄糖而不是脂肪酸(例如丁酸)作为能源(Warburg效应)[82],从而导致丁酸在细胞内的积累,从而充分抑制了HDAC,从而抑制了细胞的生长 。 - 对此矛盾的是,有时是自相矛盾的结果进行了批判性审查,得出的结论是,丁酸盐仅在癌变的特定敏感阶段才发挥抗增殖作用,这些作用取决于丁酸盐向结肠的输送,即结肠中丁酸盐产生的程度。 取决于纤维的类型,其变化范围很大,并且需要很高的结肠酸丁酸盐浓度,并且可能难以在人类中再现[78,84]。 最近使用小鼠仔细控制癌症表型的研究尚未解决这些问题。 例如,一项小鼠研究使用了用乙氧基甲烷然后用右旋糖酐硫酸钠(DSS)处理的gnotobiotic小鼠诱导结肠癌,然后用产生丁酸盐的细菌将这些小鼠定殖,发现膳食纤维所需的微生物群具有丁酸盐依赖性的肿瘤抑制作用。
- 在该模型中,丁酸在肿瘤中的代谢较少,并起HDAC抑制剂的作用。 相比之下,另一项最新研究表明,在结直肠癌的遗传小鼠模型(ApcMin / + Msh2-/-)中,肠道微生物产生丁酸可刺激息肉形成[85]。 重要的是,人类中超过10%的结肠癌在腺瘤性息肉病大肠杆菌(APC)和DNA错配修复基因MutS同系物2(MSH2)中受损[86]。 因此,食用膳食纤维以生成丁酸酯是否可用于治疗性预防或治疗大肠癌仍未完全解决。 考虑到需要非常高的丁酸盐含量才能有效并且大多数人对饮食中的大量纤维存在厌恶感,因此可能需要采用替代策略,例如工程改造纤维以提高丁酸盐产量,减少氢气和二氧化碳气体的产生。
周围炎症
- SCFA的抗炎作用超出了肠道,例如抑制血管平滑肌细胞增殖和迁移[87],改善肾脏功能[88],赋予肺部抗炎作用[89、90],以及预防 炎性关节炎[91]。 这些作用的潜在机制似乎主要集中在HDAC抑制和GPR43活化上,从而通过调节免疫细胞活化发挥作用。 例如,喂食高纤维饮食的小鼠循环中的SCFA含量增加,通过一种机制来防止肺部过敏性炎症,这种机制涉及削弱树突状细胞刺激TH2细胞介导的过敏性炎症的能力[89]。 发现高纤维或醋酸盐喂养可以通过抑制HDAC抑制成年小鼠的过敏性气道疾病并增加FOXP3乙酰化,而这种效果与胎儿小鼠有关,其中高纤维或醋酸盐母体饮食能够抑制某些动物的与哮喘有关的基因[表达 。 加拿大健康婴儿纵向发展研究发现,与低危婴儿相比,处于哮喘风险的婴儿在生命的前100天内表现出其肠道菌群组成的瞬时变化[92]。 这些高危婴儿的SCFA形成所涉及的微生物类群水平降低(特别是Lachnospira,Veillonella,Faecalibacterium和Rothia),粪便乙酸盐含量降低。 用这四个微生物类群接种无菌小鼠后代可以减轻气道炎症,这表明其在抑制炎症中起因果作用[92]。
- 总之,这些结果表明潜在地引入增加SCFA产生的细菌(或细菌组合)作为预防成年人和儿童哮喘和其他相关炎症性疾病发展的措施。 要实现这一潜力,就需要优化合适的微生物群以进行补充和随后的临床试验。
对食欲和能量稳态调节的影响
- Turnbaugh及其同事进行的具有里程碑意义的研究表明,与从瘦小鼠中转移微生物相比,从肥胖小鼠向无菌小鼠中转移微生物会增加SCFA的肥胖和盲肠水平 ,引起了人们对微生物作用的浓厚兴趣。
在调节食欲和能量稳态方面生产SCFA。 Turnbaugh及其同事将转移微生物群的致肥胖潜力归因于其将膳食成分发酵为SCFA的能力增强,从而增加了能量收获。 随后的研究表明,肥胖的人粪便中的SCFA水平要高于瘦人[93],而roux-en-Y胃旁路手术是肥胖症和2型糖尿病的一种有效治疗方法,会导致人类和大便的粪便微生物状况发生重大变化, 啮齿类动物,导致SCFA水平降低[94-97]。 尽管这些结果表明,SCFA的微生物产生量增加会促进肥胖,但许多研究都支持相反的结论。 - 例如,微生物菌群转移实验从人类双生子供体的无菌小鼠中进行,其中一个是肥胖的,另一个是瘦肉的,这表明与肥胖小鼠一样,表型也随微生物群转移。 但是,在这种情况下,从瘦肉捐赠者那里转移会导致盲肠丙酸和丁酸水平升高。 此外,富含菊粉或其他不易消化的纤维的饮食会增加SCFA的形成,从而持续抑制人的肥胖[98,99]。 最后,在高脂饮食(HFD)喂养的小鼠中,直接给予SCFA,尤其是丁酸,可以抑制体重增加,肥胖和胰岛素抵抗[41,100–103]。Byrne及其同事最近对该领域的各种研究进行了荟萃分析,得出的结论是,升高的SCFA水平对肥胖症具有总体净收益,这是由于肥胖对饱腹感和食物摄入减少,脂肪生成和胆固醇合成能量消耗和生热增加以及对肥胖抑制作用所致 。SCFA抗肥胖作用的分子机制是屏障功能的改善,它可以阻止细菌毒素进入循环系统,从而诱导代谢性内毒素血症,肥胖症和胰岛素抵抗[105-107]。 此外,AMPFA和GPR43的SCFA激活可诱导多种反应,这些反应可减少肥胖,包括增加脂肪氧化,降低葡萄糖水平和增加饱腹感肽(例如GLP-1,肽YY(PYY)和胃抑制性多肽)的分泌 。
- 总体而言,由于增加SCFA的微生物产量似乎是治疗肥胖症的合理治疗干预措施,因此需要进行进一步的研究以确定如何有效地对人类进行此类长期干预措施。 对于很大一部分人来说,大量不可消化的膳食纤维(如菊粉)的食用受到胃肠道不良作用(如腹胀,腹部绞痛,肠胃气胀和腹泻)的严重阻碍。 这些不利影响部分是由于发酵过程中氢气和二氧化碳的同时形成。 因此,优化微生物群或底物以增加SCFA的产生并最小化释放的氢气和二氧化碳气体对于这种治疗在普通人群中的广泛应用至关重要。
三甲胺和三甲胺N-氧化物
- 通过筛选与心血管疾病(CVD)相关的代谢产物鉴定了TMA及其共代谢物TMAO,并且TMA被证明需要肠细菌才能形成[15]。 最初在脱硫脱硫弧菌中发现的两种酶(CutC和CutD)将胆碱裂解为TMA和乙醛,可将胆碱用作能源[108]。 最近的研究发现,在多种变形杆菌和Firmicutes中都有同源基因,放线菌的程度较小,这表明它们是通过水平基因转移传播的[109]。 最近还显示,TMA是由左旋肉碱和胆碱通过类似的反应形成的,所述类似的反应由最初以大肠杆菌为特征的YeaW和YeaX酶[110],以及最初以鲍曼不动杆菌为特征的CntA和CntB催化[111]。 在结肠中形成并吸收后,TMA进入门脉循环,将血液引导至肝脏,在肝脏中,其被含黄素的单加氧酶3(FMO3)氧化为TMAO [112]。 对近交系小鼠遗传变异的分析表明,血浆TMAO水平与FMO3活性显着相关[112]。 口服抗生素可阻止通常在胆碱或肉碱饮食激发后发生的TMAO的增加,表明TMAO的产生需要微生物细菌[15、113、114]。 TMAO水平可预测动脉粥样硬化的风险[15,112,115],并在慢性肾脏病(CKD)和肥胖症患者中升高[116]和肥胖[17,98],而在溃疡性结肠炎中降低 。 MAO直接诱发CVD,因为TMAO本身或足够的胆碱或左旋肉碱的施用可以提高TMAO水平,都可以增加Apoe-/-小鼠的动脉粥样硬化[15,114]。 目前尚不清楚TMAO发挥其病理作用的具体分子机制。 肾脏中TMAO的积累可能会改变渗透压平衡,TMAO水平升高在动物模型中与诸如纤维化和功能障碍等肾损害的标志物相关[116]。 迄今为止,尚未鉴定出TMAO的受体。 TMA而不是TMAO充当痕量胺相关受体5(TAAR5)的配体[118],但TAAR5似乎仅在嗅觉感觉神经元中表达。 向Apoe-/-小鼠施用TMAO可抑制体内巨噬细胞的胆固醇逆向转运[114],但在细胞培养中直接用TMAO处理巨噬细胞不会增加其吸收胆固醇的能力或抑制其胆固醇向ApoA1或HDL流出的能力。
*FMO3活性的降低(增加TMA含量并降低TMAO含量)会降低肠道胆固醇的吸收,降低肝脏胆汁分泌和LXR信号传导,并通过肠内胆固醇外排(小肠中胆固醇的主动分泌)来增加胆固醇的处置[120]。 施用抗生素可以阻止这些作用,而补充TMAO则不能,这表明降低FMO3活性的作用是由TMA或FMO3的另一种微生物底物增加引起的[120]。
·因此,非常需要阐明TMAO分子靶标和TMA潜在作用的研究。 - 如果没有确定的TMAO分子靶标,减少CVD的干预措施必须集中在降低TMAO含量上。
·减少饮食中的胆碱或左旋肉碱会降低TMAO水平,但可能会产生不良影响。 特别是,补充的左卡尼汀水平低于TMAO形成所需水平,可以改善心血管功能[121]。 对13个对照试验(n = 3629)的荟萃分析表明,补充左旋肉碱可使全因死亡率降低27% 。 胆碱缺乏症虽然可能有益于心血管健康,但显着增加了非酒精性肝病的风险。 抑制FMO3降低TMAO含量也是不可取的,因为TMA的积累会导致鱼类恶臭。 由于这些限制,当前的药物开发集中在一种革命性的方法上:通过选择性抑制有害于其宿主的途径(如微生物CutC / D,CntA / B和YeaW / X)对微生物进行非致命性靶向。 胆碱3,3-二甲基-1-丁醇(DMB)的结构类似物非致死性地抑制了高胆碱或左旋肉碱饮食的小鼠的微生物CutC / D并降低了TMAO水平[123]。 重要的是,DMB可抑制Apoe-/-小鼠的巨噬细胞泡沫细胞形成和动脉粥样硬化病变的发展[123]。 需要未来的临床试验来确定CutC / D抑制剂在降低人类TMAO水平和疾病方面的安全性和有效性,以及长期治疗策略是否会对它们的作用产生抗药性。然而,这种选择性,非致命性抑制微生物功能的革命性策略可能代表了人类疾病药物治疗的重要新领域。
色氨酸代谢物:吲哚和吲哚衍生物
-
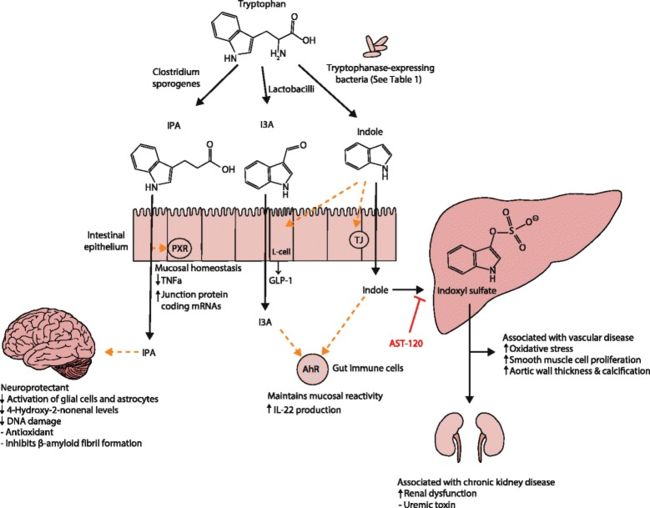
色氨酸是一种在多种食品(例如红肉,鱼和蛋)中发现的必需氨基酸。 表达色氨酸酶的共生细菌将色氨酸分解为吲哚,这是一种乳杆菌属细菌的群体感应化合物[124](图1)。
·通过未知酶将色氨酸转化为吲哚-3-醛(I3A) 。 产气荚膜梭菌可能通过色氨酸脱氨酶将色氨酸转化为IPA [6]。 从肠道吸收进入门脉循环后,肝脏将吲哚转化为IndS。
图 1
吲哚及其代谢物对宿主生理和疾病的作用的分子机制。 结肠内腔中的色氨酸被细菌分解代谢,生成吲哚和吲哚衍生物。 3-丙酸吲哚(IPA)通过孕烷X受体(PXR)作用于肠道细胞,以维持粘膜稳态和屏障功能。 IPA还可以作用于其他器官,例如大脑,在该处赋予神经保护作用以抵抗缺血引起的神经元损伤或阿尔茨海默氏病。 吲哚-3-醛(I3A)作用于在肠道免疫细胞上发现的芳烃受体(AhR),并增加白介素22(IL-22)的产生。 AhR的激活在肠道免疫中起着至关重要的作用,例如维持上皮屏障功能和提高免疫耐受性以促进微生物共生,同时防止病原体感染。 吲哚具有多种作用,例如向肠L细胞产生胰高血糖素样蛋白1(GLP-1)的信号分子或作为AhR的配体。 吲哚也被肝脏代谢为硫酸吲哚酚,过量会危害人体健康。 生理盐水中硫酸吲哚酚的积累是有毒的,并与血管疾病和肾功能不全有关。 口服肠道吸收剂AST-120可吸收吲哚并降低血清中的吲哚酚硫酸盐浓度,是治疗慢性肾脏疾病的潜在疗法。
吲哚及其代谢产物通过多种分子机制影响宿主生理(图1)。 吲哚和I3A是芳烃受体(AhR)的激动剂,芳烃受体是一种调节白介素(IL)-22表达,增加TH17细胞活性并有助于维持上皮内淋巴细胞的转录因子[125]。 吲哚上调肠上皮细胞中紧密连接蛋白的表达并调节促炎和抗炎基因的表达[126,127]。 AhR的这些活性有助于确保共生细菌在肠道菌群中胜过病原菌[128],而AhR的缺失会增加DSS诱导的结肠炎的严重程度[129]和对啮齿类柠檬酸杆菌感染的反应[130](人类模型) )。 除了这些作用外,最近的研究表明,吲哚还可以调节L细胞中GLP-1的释放[131],因此吲哚的形成可能有助于饱腹感和抑制肥胖。 最近的其他研究表明,IPA是孕烷X受体(PXR)激动剂,尤其是在吲哚存在的情况下[132]。 广泛的PXR激动剂可抑制NF-κB[133],而肠肿瘤坏死因子(TNF)-α的下调和IPA对连接蛋白的上调则需要PXR [132]。 IPA还可以有效清除羟基自由基[134],从而在各种动物模型中都可以防止氧化损伤[134-137]。 因此,需要进一步的研究来确定通过细菌或直接施用IPA增强IPA的形成是否对诸如炎症性肠病和结肠直肠癌之类的炎症条件有益。 吲哚似乎主要是有益的,但其代谢产物IndS是一种尿毒症毒素,可在CKD患者中蓄积[138]。 IndS还与肾小球硬化加速[139],内皮功能障碍增强[140],单核细胞与血管内皮粘附增强[141]和氧化应激增加[141,142]相关。 口服木炭吸附剂AST-120结合肠腔中的吲哚并降低血浆IndS水平,从而减少与肾脏损伤相关的肾脏损害和动脉粥样硬化[143]。 需要进一步的研究来确定将色氨酸代谢从IndS转移到IPA是否对肾脏疾病或其他疾病有益。
酪氨酸代谢物:对甲酚硫酸盐和4-乙基苯基硫酸盐
- PCS和4-乙基苯基硫酸盐(EPS)是分别通过微生物代谢产物对甲酚和4-乙基苯酚的肝硫酸化形成的结构相似的尿毒症毒素。 无菌小鼠血浆和尿液中PCS或EPS的缺乏证明了它们的微生物起源。 艰难梭菌中羟苯基乙酸脱羧酶操纵子基因的失活突变体(hpdB / C / A)阻止了酪氨酸或其代谢产物羟苯基乙酸发酵为对甲酚[144]。 其他肠道细菌很少编码HpdB / C / A [144]。 尚无关于形成4-乙基苯酚的细菌途径的描述,但是酒腐败酵母Brettanomyces通过酪氨酸代谢产物对香豆酸生成了4-乙基苯酚,酪氨酸代谢物对香豆酸通过肉桂酸脱羧酶和乙烯基苯酚还原酶存在于许多食品中。 4-乙基苯酚还可以通过口服的染料木黄酮(一种在大豆中发现的植物雌激素)通过未知的但可能是微生物途径形成[145]。 重度CKD接受血液透析的患者中PCS和EPS均会累积[146]。 PCS水平可预测CKD患者的临床结局[147],并与CKD患者的心血管死亡率相关[148,149]。 尽管常规透析不能去除PCS,但口服AST-120吸附剂或益生元阿拉伯木糖低聚糖[151]可以降低血浆PCS水平。 素食者的PCS水平低于杂食动物[152]。 在慢性肾功能衰竭的大鼠模型中,EPS水平升高,而AST-120治疗可降低这些水平[153]。
- 在自闭症小鼠模型中,EPS水平增加了46倍,而脆弱类杆菌的治疗可阻止这种增加[28]。 给小鼠施用EPS会导致类似焦虑的行为[28]。 PCS的分子作用机制包括细胞膜的直接损伤[154],凋亡途径的诱导[155],NADPH氧化酶4(NOX4)的活化导致活性氧(ROS)的形成[156],JNK的活化和 p38-MAPK [157],导致内皮损伤的Rho激酶(ROCK)激活[158],导致基质金属蛋白酶2和9表达的表皮生长因子(EGF)受体激活[159],并抑制了多种 包括CYP2E1,CYP3A4,UGT1A1,UGT1A9和UGT2B7的药物代谢酶[160]。 鉴于其与PCS的化学相似性,预计EPS会发挥相似的作用,但迄今为止尚未证明具体的分子靶标。 需要进一步的研究来鉴定PCS和EPS生物合成途径的药物抑制剂,以及这些抑制剂是否对疾病具有有益作用。
必需脂肪酸衍生的代谢产物
- 长期以来,反刍动物的微生物群已将必需脂肪酸亚油酸(LA)和亚麻酸转化为CLAs(如cis-9和trans-11 CLA)和共轭亚麻酸(CLnAs)(如cis-9,trans-
·11和顺式15 CLnA [161-163],通过异构酶的作用。 但是,最近的研究发现,小鼠和人类的微生物群,特别是弓形藻科,乳酸杆菌属。 双歧杆菌和双歧杆菌具有产生CLA和CLnAs的能力[164-166]。 在乳酸杆菌中,用于形成共轭脂肪酸的中间体包括氧化代谢产物HYA和10-羟基十八烷酸酯(HYB)[167,168]。 最近已鉴定了通过乳杆菌将LA转化为CLA的酶,包括肌球蛋白交叉反应抗原,短链脱氢酶/氧化还原酶和乙酰乙酸脱羧酶[169]。 共轭脂肪酸发挥许多非常有益的作用,包括减少肥胖,改善胰岛素敏感性,减少致癌作用和减少动脉粥样硬化(综述[170])。 CLAs和CLnAs通过PPAR-γ(在[171]中综述),PPAR-α[172]起作用,并抑制环氧合酶和脂氧化酶[173,174]。 目前尚不清楚典型的肠道菌群是否会产生足够的CLA / CLnA来发挥补充CLA / CLnA所见的肠外作用,因为饲喂必需脂肪酸会增加肠道的营养,但不会增加CLA和CLnA的循环水平[164]。 像CLA和CLnAs一样,HYA还具有抗炎活性,包括下调脂多糖(LPS)诱导的树突状细胞成熟,阻断TNF诱导的屏障损伤以及防止DSS诱导的肠损伤[175,176]。 HYA通过GPR40–MEK–ERK途径起作用[176]。 需要进行进一步的研究以确定增加的微生物HYA产量是否可以用于治疗。
转化为为未来的诊断和治疗方法
- 在前面的部分中,我们简要地谈到了单个代谢物的潜在未来研究,但是在广泛的研究和理解领域还需要进一步发展,以充分实现肠道微生物代谢物在疾病治疗中的潜力。 最后,我们将重点介绍这些需要发展的四个方面。
- 首先,开发可识别特定疾病状态或区分密切相关疾病状况的最小限度的生物标志物微生物代谢物。 Preter及其同事对炎症性肠病进行的分析证明了该策略的重要性[22],对于高度异质性疾病(例如自闭症谱系障碍,其中也涉及微生物群)的类似方法[177],可能会有所帮助。 这也适用于识别可能有疾病风险的个体,例如那些携带高水平细菌菌株的个体,这些菌株将胆固醇转化为香豆素,使他们更容易感染艰难梭菌。 为了转换为实际治疗方法,将需要在临床实验室中进行测量,在这些实验室中,免疫测定阵列(而不是研究环境中可用的更复杂的MS或NMR方法)可能将继续是主要的可用方法。 因此,确定选择性评估疾病所需的最小数量的生物标志物代谢物至关重要。 类似的策略可用于确定干预措施的有效性和安全性。
- 其次,开发算法来预测基于微生物代谢物的饮食和药物干预的个性化反应。 Zeevi及其同事最近报道了这种方法的一个令人振奋的例子,他们证明了可以使用他们的肠道菌群和其他数据来预测不同个体对相同食物的高度血糖反应[32]。 同样,能够使用诸如CASINO等工具预测特定代谢产物(例如SCFA)对单个食物的反应[31]对于允许对特定饮食成分不耐受的个体成功使用功能性食物来提高结肠SCFA含量至关重要。 考虑到个体之间微生物组成的可变性,基于算法的个性化对于任何基于营养的方法似乎都是必不可少的。
- 第三,通过选择性增加产生代谢产物的天然物种的丰度,或通过工程化内源性肠道微生物以高水平生产的方法,开发了易于推广的方法,以增加肠道有益微生物的微生物产量。
·后一种方法的一个例子是我们的研究,该研究使用共生大肠杆菌中饱足性因子N-酰基磷脂酰乙醇胺的异源表达(Nissle 1917株),从而导致在喂食HFD的小鼠中抑制肥胖[178]。 此类策略可能有助于产生足够的IPA,CLA或HYA来阻断炎症性疾病,但也可用于鉴定新的代谢产物。 工程细菌的一个优点是能够在细菌菌株中产生有益代谢产物的能力,该菌株在患病个体的肠道中很好地定殖,而不是在天然细菌中产生相同有益代谢产物但在病菌的肠道中定居的能力很差。 - 第四,类似于产生CutC / D的工作,针对产生有害代谢物的各种微生物途径的非致死性特异性抑制剂的开发。 特别地,对对甲酚基和4-乙基苯酚的形成的抑制似乎对该策略是可修正的。 这种控制有害细菌代谢产物的革命性方法似乎不太可能导致标准抗生素产生耐药性的快速发展,因为携带耐药性的适应性优势更为有限。 如果是这种情况,那么长期使用这种代谢途径抑制剂将在慢性疾病中具有巨大的潜在益处。
结论和未来展望
- 在过去的十年中,我们对肠道微生物代谢物在调节宿主健康中所起的重要作用的理解取得了显着进展。 MS和NMR研究已经确定了多种微生物代谢物,它们在疾病条件上有所不同,并且现在正在利用这些相同的方法来更好地识别紧密相关疾病中的细微差别。 这些鉴定出的代谢产物中的一些,例如TMAO,IndS和PCS,似乎直接增加了对疾病的易感性,而另一些代谢产物,例如SCFA,IPA,CLA和HYA,似乎发挥了保护作用。 要充分表征这些微生物代谢产物以及许多其他微生物代谢产物对人体健康的生理影响,还有许多工作要做。
- 未来的研究很有可能会发现许多其他肠道微生物代谢产物显着富集或枯竭的疾病状态。
·重要的是要记住,这些研究本身并不显示因果关系。 因此,似乎非常需要仔细控制的研究来确定每种鉴定出的微生物代谢产物的生理作用及其特定的作用机理。 此外,为了充分利用肠道菌群在疾病预防中的潜力,我们需要对饮食成分和宿主遗传基因如何影响各种代谢产物的产生有更多的了解。 最后,将这些发现转化为临床实践将需要开发广泛可用的临床化学方法,以检测个人关键代谢产物的变化。 尽管要充分利用肠道菌群来改善人类健康面临着巨大挑战,但近十年来取得的显着进步表明,这种方法具有巨大的潜力,可以彻底改变人类疾病的治疗方法。
缩略语
AhR芳烃受体
·AMPK AMP激酶
·CKD慢性肾脏病
·CLA共轭亚油酸
·CLnA共轭亚麻酸
·CoA辅酶A
·CVD心血管疾病
·DMB 3,3-二甲基-1-丁醇
·DSS葡聚糖硫酸钠
·EPS 4-乙基苯基硫酸盐
·GIP胃抑制多肽
·GLP胰高血糖素样肽
·GPR G蛋白偶联受体
·HDAC组蛋白脱乙酰酶
·HFD高脂饮食
·HYA 10-羟基-顺式-12-十八烯酸酯
·HYB 10-羟基十八烷酸酯
·I3A吲哚-3-醛
·白介素
·IndS硫酸吲哚酚
·IPA吲哚-3-丙酸酯
·LA亚油酸
·LPS脂多糖
·MS质谱
·NMR核磁共振
·PCS对甲酚硫酸盐
·PPAR-γ过氧化物酶体增殖物激活受体-γ
·PYY肽YY
·PXR孕烷X受体
·ROCK Rho激酶
·ROS活性氧
·SCFA短链脂肪酸
·TMA三甲胺
·TMAO三甲胺N-氧化物
·TNF肿瘤坏死因子