HNC:头颈癌(head and neck cancer)
HPV:人类乳头状病毒(human papillomaviruses)
TCGA:癌症基因组图谱(The Cancer Genome Atlas)
FFPE:福尔马林固定,石蜡包埋(formalin-fixed, paraffin-embedded)
IHC:免疫组化(immunohistochemistry)
一.研究背景
头颈癌是世界第六常见的疾病,是头颈部最常见的上皮来源的恶性肿瘤,每年约有60万人新发生病例数。导致该病的主要原因包括吸烟、酒精以及HPV的感染。也有相当多的研究去挖掘影响头颈癌预后的因素,但这些因素往往都是一些临床因素和HPV状态,目前还没有广泛应用到头颈癌中的分子分类器和病人接受治疗反应分类器。
肿瘤内缺氧和免疫力一直与各种肿瘤患者预后相关,之前并没有研究考虑肿瘤内缺氧(hypoxia)和免疫力(immune)这两个因子在头颈癌治疗中的作用。
今天小编推荐的这篇文章Jill M. Brooks等人通过文献挖掘,获取头颈癌相关的缺氧基因(n = 26)[1]以及免疫相关的基因(n = 28)[2],整合这两个基因集和构成的一个54基因分类器,并将该模型应用到头颈癌病人预后以及靶向治疗的药物反应评估中去。
这个由54个基因构成的分类器最终识别了三个在缺氧以及免疫方面有独特的特征的头颈癌亚型,即hypoxialow/immunehigh,、hypoxiahigh/immunelow和mixed三组亚型病人,进一步对这三个亚型病人的生存以及三个亚型中由CD3蛋白在肿瘤内,肿瘤周围基质和肿瘤前缘三个部位得到相应蛋白的免疫组化结果得到的免疫细胞发挥作用的组的分布情况;同时,他们还发现PD-L1和CD3蛋白和头颈癌的预后相关;CA-IX作为缺氧相关标志物,PD-L1作为免疫功能相关标志物,通过多重染色的结果展示CD3与CA-IX负相关,CD3与PD-L1正相关。
这个分类器对靶向缺氧和免疫相关基因治疗头颈癌的治疗方法具有一定的指导作用,例如检查点抑制剂的使用,在未来的研究中,进一步结合相应的用药数据,可实现对感兴趣的标志物在病人生存以及药物反应的验证。
标题:Development and Validation of a Combined Hypoxia and Immune Prognostic Classifier for Head and Neck Cancer 杂志:Clinical Cancer Research IF:8.911 发表时间:2019.6.10
二.方法和材料
(1)数据集:TCGA数据库(n = 275)作为训练集,Chicago数据集(n = 134)和FFPE数据集(n = 163)作为验证数据集(样本特征如Table 1所示)。将头颈癌表达谱进行log2转化后再z-score标准化。
(2)聚类分析:基于log2转化后的表达谱,采用层次聚类,使用皮尔逊相关系数和“ward”聚类方法。
(3)免疫组化得分评定:由两个受过专业训练的病理学家评估IHC,其中IHC评定得分从1-4变化,值越大,表明相应的蛋白含量越多。对于CD3蛋白来说,在肿瘤内,肿瘤周围基质和肿瘤前缘三个部位得到相应蛋白的免疫组化结果,其中,如果三个部位的IHC得分均小于2,则将该组病人定义为免疫荒漠组(immune desert);肿瘤内和肿瘤周围基质免疫组化得分差异大于1,则将改组病人定义为免疫排斥组(immune excluded);三个部位的IHC得分均大于2,将该病人定义为免疫激发组(immune inflamed)。(4)缺氧-免疫相关基因:通过文献检索,得到26个缺氧基因[1]以及28个免疫相关的基因[2]。
(5)差异表达的p值:通过具有Dunn校正的Kruskal–Wallis检验获取不同亚型组基因间表达差异的p值。
(6)相关系数:通过R语言计算斯皮尔曼相关系数。
三.结果展示
1. 预后分类器的构建以及验证:将26个缺氧基因和28个免疫相关基因映射到Table 1中的3套表达谱数据中,通过双向层次聚类发现样本有三种模式,即hypoxialow/immunehigh,、hypoxiahigh/immunelow和mixed,相应样本基因表达模式如Fig 1 A,C,E所示,又基于log-rank检验这三套数据集中分组病人的生存曲线是否差异,发现log-rank检验的p值都显著(如 Fig 1B,D,F)。
Fig 1.三套数据集中不同表达模式的病人分组。A,C,E)Table 1中三套数据集表达模式;B,D,F)三套数据集中进行生存分析。
2. 头颈癌亚型基因表达模式的刻画:基于TCGA数据库中的头颈癌患者的z-score标准化后的表达谱,通过箱式图展示在上述识别的三个亚型的头颈癌患者中重要的一些缺氧基因以及免疫相关基因表达模式的差异(如 Fig 2),其中,白色表示hypoxialow/immunehigh,深灰色表示hypoxiahigh/immunelow,浅灰色表示mixed。
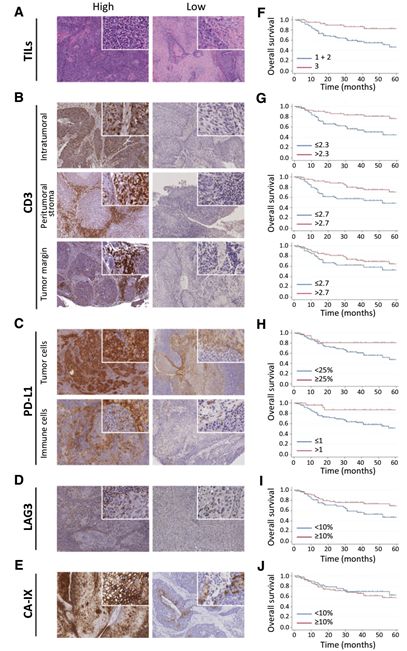
3. 蛋白质分类器:由于发生转录后调控或者蛋白质的降解,基因表达可能与蛋白质的表达不相关,基因标志物不能区分肿瘤细胞或基质细胞中的表达,也不能鉴定是否是细胞类型特异的表达。因此,Jill M. Brooks等人又将TILs、CD3、PD-L1和LAG3作为免疫相关蛋白标志物,CA-IX作为缺氧标志物。通过IHC实验得到相应样本中对应蛋白表达的高低,通过蛋白表达的高低划分样本组(如 Fig 3 A-E),进一步通过log-rank检验看高低表达组病人的生存情况(如 Fig 3 F-J)
4. 头颈癌免疫图谱:统计上述蛋白标志物在hypoxialow/immunehigh,、hypoxiahigh/immunelow和mixed三组亚型中病人的表达情况(如 Fig 4A所示)。在免疫学中,CD3(分化簇3)T细胞的共受体是一种蛋白质复合物,CD3缺失或抑制可导致T细胞缺失或减少。参照方法中提到的划分免疫荒漠组(immune desert)、免疫排斥组(immune excluded)以及免疫激发组(immune inflamed)组,统计不同组中hypoxialow/immunehigh,、hypoxiahigh/immunelow和mixed三组亚型病人的分布(如 Fig 4B所示)。
5. 肿瘤免疫细胞与缺氧的相互作用:CA-IX作为考虑缺氧的代表关键蛋白,PD-L1作为免疫的关键蛋白,考虑不同微环境下上述两个因子和CD3蛋白的作用。在Fig A-C中展示了三个亚型的头颈癌患者PD-L1、CA-IX和CD3在基质和肿瘤部位的染色情况,其中,绿色代表CD3的染色情况,红色代表CA-IX,蓝色代表PD-L1。近一步看处于基质、肿瘤以及两者混合的CD3蛋白的表达与CA-IX的关系,基于斯皮尔曼相关发现CD3与CA-IX负相关,又看处于基质、肿瘤以及两者混合的PD-L1蛋白的表达与CD3的关系,发现两者正相关。
四.参考文献
1. Eustace A, Mani N, Span PN, Irlam JJ, Taylor J, Betts GN, et al. A 26-gene hypoxia signature predicts benefit from hypoxia-modifying therapy in laryngeal cancer but not bladder cancer. Clin Cancer Res 2013;19:4879–88.
2. Lal N, Beggs AD, Willcox BE, Middleton GW. An immunogenomic stratification of colorectal cancer: Implications for development of targeted immunotherapy. Oncoimmunology 2015;4:e976052.
往期分享
01-早期诊断的生物标记增加:DIS和PIS
02-IF7+:纯生信泛癌分析挖掘可用于ICI应答预测的生物标志物
03-IF6+:纯生信基于网络互作结合基因表达谱、拷贝数变异数据鉴定多发性骨髓瘤标志物
05-IF4+从DNA修复基因的角度构建胶质瘤的预后模型