Siglec15 shapes a non-inflamed tumor microenvironment and predicts the molecular subtype in bladder cancer
Siglec15塑造非炎症肿瘤微环境并预测膀胱癌的分子亚型
发表期刊:Theranostics
发表日期:2021 Jan 1
影响因子:8.597
DOI: 10.7150/thno.53649
一、研究背景
膀胱癌(BLCA)是第二大常见的泌尿系统癌症。尽管进行了新辅助和辅助化疗,但转移性BLCA的疗效不佳。癌症免疫治疗,包括免疫检查点阻断(ICB),对晚期BLCA取得了有希望的生存获益。虽然BLCA是一种以高肿瘤突变负担(TMB)和新抗原为特征的免疫原性癌症,但由于原发或继发机制的耐药性,只有少数患者对ICB有反应。鉴于癌症治疗的巨大经济负担和毒副作用,必须探索更强大和经济的生物标志物,预测对ICB的反应。
Siglec15是西亚酸结合免疫球蛋白类凝集素家族成员之一,是新兴的广谱靶点,可用于正常化癌症免疫治疗,与PD-L1互补。Siglec15通过抑制CD8+T细胞的增殖促进肿瘤生长,Siglec15抑制剂可以缓解这种免疫抑制。
二、材料与方法
1 数据来源
1)TCGA:从UCSC Xena下载泛癌RNA测序(RNA-seq)数据(FPKM值)、体细胞突变数据和生存信息、拷贝数变异(CNV)数据
2)从Bonneville研究的补充文件中收集的MSI数据
3)从LinkedOmics下载甲基化数据
4)GEO:BLCA GEO队列(GSE13507、GSE31684、GSE48075、GSE48277、GSE69795、GSE70691、GSE32894和GSE5287)、3个免疫治疗相关的队列(GSE78220(黑色素瘤)、GSE135222(NSCLC)和GSE91061(黑色素瘤))
5)一个肾细胞癌的免疫治疗队列:PMID 29301960
6)一个BLCA免疫治疗相关队列:IMvigor210队列的完整表达数据和详细的临床信息
7)从BioGPS、CCLE下载Siglec15在正常组织和癌细胞系中的表达数据
8)湘雅队列:采集60份新鲜膀胱癌样本
2 分析流程
三、结果展示
01 - Siglec15的泛癌表达模式、预后意义和免疫学相关性
经过对TCGA、GTEx和Oncomine数据库的表达数据进行综合分析,发现Siglec15在BLCA和乳腺癌(BRCA)等大多数癌症中与正常组织相比都有高表达(图S1A-D)。根据BioGPS和CCLE数据库的表达数据筛选,Siglec15也在包括膀胱癌细胞系在内的各种癌细胞系中表达(图S1E-F)。除了巨噬细胞外,Siglec15在正常组织中的表达量非常低(图S1G)。在三十个由膀胱癌和正常组织组成的配对样本中,发现Siglec15在癌症组织中的表达量显著且高于正常组织(图S1H)。
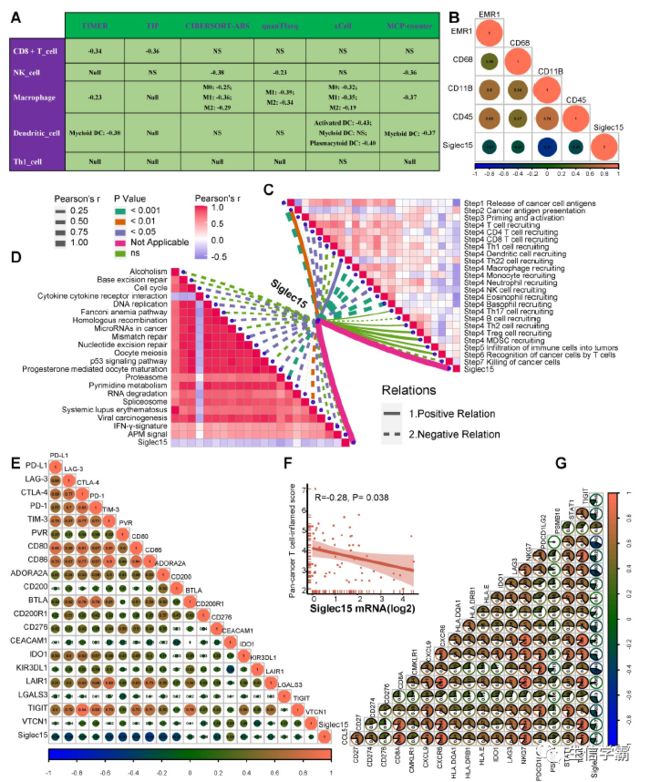
之后的研究旨在描绘Siglec15的免疫学作用的泛癌症分析对于确定可能从抗Siglec15免疫治疗中获益的癌症类型至关重要。结果显示,Siglec15与BLCA中的大多数免疫调节剂呈负相关(图2A)。使用ssGSEA算法估计了TME中TIICs的浸润水平,Siglec15与BLCA中的大多数TIICs呈负相关(图2F)。证明了Siglec15的表达与BLCA中的几个免疫检查点,包括PD-L1、PD-1、CTLA-4和LAG-3是相互排斥的(图2B-E)。
总之,Siglec15的过表达模式是TME特异性的,这证明了Siglec15作为正常化癌症免疫治疗靶点的潜力。Siglec15在TME中的免疫抑制作用在BLCA中最为明显,这表明BLCA可能是抗Siglec15免疫治疗的合适候选癌症类型。
02 - BLCA中Siglec15的突变分析
Siglec15基因没有发现突变。Siglec15的CNV模式如图S6A所示。Siglec15的拷贝数缺失和甲基化降低了Siglec15 mRNA的表达(图S6B-C)。表明Siglec15基因的表观遗传修饰可能是抗Siglec15抑制剂的一种替代性干预治疗方法。图S6D-F总结了低组和高组Siglec15的前30个突变基因,以及BLCA的突变概况。
03 - Siglec15在BLCA中塑造了一个非炎症的TME
发现Siglec15与大量免疫调节剂呈负相关(图3A)。高Siglec15组大部分MHC分子下调,说明高Siglec15组抗原呈递和处理能力下调。三种关键的趋化因子(CXCL9、CXCL10和CCR3),在BLCA中诱导CD8+T细胞招募到TME中,在高Siglec15组中被下调。其他趋化因子以及配对受体,与Siglec15呈负相关。
癌症免疫循环的活动是趋化因子系统和其他免疫调节剂功能的直接综合表现。在高Siglec15组中,发现循环中大部分步骤的活动被下调,包括癌细胞抗原的释放(步骤1)、引物和活化(步骤3)、免疫细胞向肿瘤的贩运(步骤4) (图3B)。随后,这些步骤的活性降低可能会降低效应器TIICs在TME中的浸润水平。T细胞识别癌细胞的活性(步骤6)在低Siglec15组中被下调,这可能是由于低Siglec15组中PD-L1的高表达。
使用7种独立算法计算TIICs的浸润水平。Siglec15与CD8+T细胞、NK细胞、Th1细胞、巨噬细胞和树突状细胞的浸润水平在不同算法中呈负相关(图3C)。同样,Siglec15与这些TIICs的效应基因呈负相关(图3D)。据报道,免疫检查点抑制剂如PD-L1/PD-1的表达在非炎症TME 7中很低,一致的是, Siglec15与大多数免疫检查点抑制剂呈负相关(图3E)。
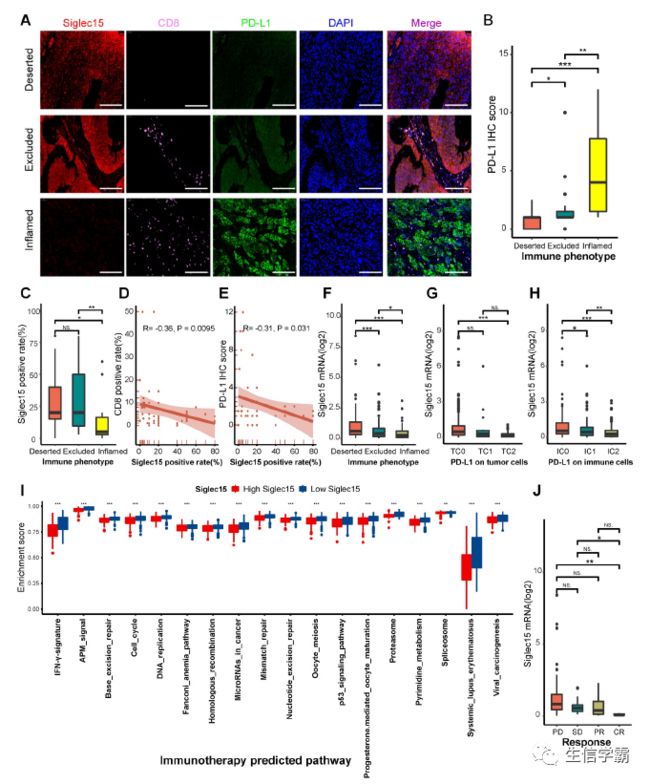
这些结果在TMA队列中得到验证。在TMA队列中的样品被分为三个表型,荒芜,排除和炎症,根据CD8 + T细胞的空间分布。代表性的图像显示在图4A中。炎症表型的PD-L1 IHC评分最高(图4B)。一致地,炎症表型的CD8阳性率最高,表明这三种免疫表型的分类是合适的。在这三种表型中,炎症表型的Siglec15表达量最低(图4C)。同时,Siglec15的表达与CD8的表达呈负相关(图4D)。PD-L1的表达与CD8的表达呈正相关。最后,发现Siglec15的表达与PD-L1的表达呈负相关(图4E)。
此外,在三个外部队列中验证了这些结果。在IMvigor210队列中,Siglec15的表达在荒漠型、TC0(PD-L1值最低的肿瘤细胞)和IC0(PD-L1值最低的免疫细胞)组中较高(图4F-H)。Siglec15与GSE32894、GSE31684和IMvigor210队列中的大多数免疫调节剂、TIICs的效应基因和免疫检查点呈负相关。
04 - Siglec15可预测BLCA的临床反应和ICB的高进展
理论上,Siglec15表达较高的患者对ICB的反应应该较低,因为Siglec15定义了非炎症TME。与表现出对治疗的部分或完全反应的患者相比,Siglec15的表达在疾病进展和稳定的患者中显著较高(图4J)。Siglec15与大多数免疫治疗阳性基因标志的富集分数呈负相关(图4I),这在三个外部队列中得到了验证。
此外,分析了Siglec15和各种免疫标志在不同ICB反应的亚组中的相关性。这些组别被定义为完全反应组、部分反应组、稳定疾病组和疾病进展组。亚组分析结果表明,高Siglec15与这些免疫信号呈负相关,并预测所有亚组对免疫治疗的反应较低。Siglec15与泛癌T细胞炎症评分呈负相关(图5A-B)。
高Siglec15组中ICB相关超进展的发生率可能更高。在高Siglec15组中,与超进展正相关的基因的拷贝数扩增率和mRNA表达量都明显较高(图S22A-B)。相反,高Siglec15组中,与超进展负相关的基因的mRNA表达明显降低(图S22A-B)。
05 - Siglec15预测分子亚型和治疗机会
PURE-01研究结果表明,基底型BLCA对pembrolizumab的免疫细胞浸润和病理反应率最高,即基底型肿瘤更容易对ICB产生反应。在7个分子亚型系统中,Siglec15表达较低的BLCA更可能是基底型亚型(图5C)。此外,在高Siglec15组中,腔内分化、Ta通路和尿道分化的富集分数更大,基底分化、EMT分化、免疫浸润和干扰素反应的富集分数较低(图5C)。此外,除了贝勒分子亚型系统,其他系统中Siglec15的ROC曲线下面积(AUC)≥0.90(图5E)。
分子亚型也可以预测新辅助化疗、放疗和几种靶向治疗的临床反应。基底亚型肿瘤更容易对新辅助化疗作出反应。低Siglec15组(基底亚型)的RB1、ERBB2和FANCC的突变率明显较高(图5D)。此外,在低Siglec15组中,放疗预测通路和EGFR配体的富集分数更高(图5F)。Drugbank数据库的结果显示,低Siglec15组对化疗、免疫治疗和ERBB治疗的反应明显更高(图5G)。这表明,ICB、新辅助或辅助化疗、ERBB治疗可以单独或联合用于治疗Siglec15低表达的BLCA。
Siglec15表达较高的BLCA更可能是腔隙亚型(图5C)。在高Siglec15组中,几种免疫抑制性致癌途径的富集分数明显较高(图5F),这些致癌途径与BLCA中的非炎症TME有关。因此,抑制这些途径促进了炎症TME的形成,从而重新激活癌症免疫。理论上,Siglec15与这些致癌途径有着相似的免疫抑制功能。因此,阻断这些通路的靶向治疗可以与抗Siglec15治疗相结合,用于治疗Siglec15高表达的BLCA。抗血管生成疗法可能适用于高Siglec15表达的BLCA(图5G)。
06 - Siglec15预测湘雅队列的免疫表型和分子亚型
在本研究的队列中,Siglec15与大多数免疫调节剂负相关。在多种算法中还发现Siglec15与CD8+T细胞、NK细胞、树突状细胞和巨噬细胞呈负相关(图6A)。Siglec15还与巨噬细胞的四个关键标记基因负相关(图6B)。Siglec15与癌症-免疫循环的关键步骤负相关,包括癌细胞抗原的释放(步骤1),以及免疫细胞向肿瘤的贩运(步骤4)(图6C)。还分析了Siglec15和预测的ICB反应信号之间的相关性,Siglec15与所有免疫治疗相关的阳性信号的富集分数负相关(图6D)。Siglec15还与大多数免疫检查点和T细胞炎症得分负相关(图6E-G)。
综上所述,Siglec15可以在7种不同的分子亚型算法中准确区分基底和腔隙亚型(图S23A-B)。Siglec15表达较高的BLCA更可能是腔隙亚型。此外,Siglec15在预测新辅助或辅助化疗、放疗和靶向治疗的治疗反应性方面的作用也得到了成功验证(图S23C)。
07 - 识别与免疫有关的DER
在这项研究中,确定了1500个共同的DER(图S24)。高Siglec15组中上调的DERs和高免疫/基质评分组之间没有共同点。同样,高Siglec15组和高免疫/体质评分组中下调的DERs之间也没有交集(图S24H-K)。这揭示了Siglec15与TME的免疫和基质评分呈负相关。几个基底亚型特异性基因,在低Siglec15组中被上调(图S24A)。此外,几个腔镜亚型特异性基因在高Siglec15组中上调(图S24A)。这意味着Siglec15的表达水平可以预测BLCA的分子亚型。基于GO和KEGG分析的结果表明,这些DER富集在免疫相关的功能过程中(图S25)。PPI分析的结果确定了24个簇。在这24个簇中,前三个簇和相应的枢纽基因也与免疫相关过程相关。
08 - IRS的开发和验证
总的来说,根据单变量Cox分析,发现524个DER影响预后。然后,使用LASSO算法确定了21个具有最小lambda的最佳候选DER(图7A-C)。根据IRS RNA-表达谱,采用多变量Cox回归分析,开发出IRS。在TCGA训练集中,以IRS的中位值为风险分界点,将275例患者分为高IRS组(n=137)和低IRS组(n=138)。如图7D所示,低IRS患者的总生存时间明显长于高IRS患者。在TCGA内部验证集中,IRS的预测准确性得到了很好的验证(图7E)。在多个外部BLCA队列中进一步验证了IRS RNA表达谱的预后价值。研究结果表明,IRS RNA-表达谱在所有BLCA队列中都是一个有价值的预后面板(图7F-H)。
除了预后价值外,IRS还可以预测ICB的临床反应。IRS与Siglec15呈负相关,但与泛癌T细胞炎症评分呈正相关(图S29A-B)。在高IRS组中,PD-L1、CTLA-4、LAG-3等几种免疫检查点的表达明显较高(图S29C)。同时,IRS与几种免疫调节剂、效应器TIICs和癌症免疫周期活性呈正相关(图S29D-F)。最后,大多数免疫治疗正相关标志的富集分数在高IRS组中明显更高(图S29G)。
最后,比较了IRS和TIDE算法之间预测ICB反应的准确性,还评估了这两种算法的预后价值。在GSE78220、GSE91061、PMID29301960(KIRC)、IMvigor210队列中,都进行了TIDE和IRS的比较。总的来说,TIDE和IRS在预测ICB反应方面是相当的。至于预后价值,IRS可能表现得比TIDE更好。
四、结论
该研究表明,膀胱癌可能是抗Siglec15免疫治疗的合适候选者。本研究表明,Siglec15在BLCA中塑造了一个非炎症的TME,也可以预测对ICB和BLCA分子亚型的临床反应。