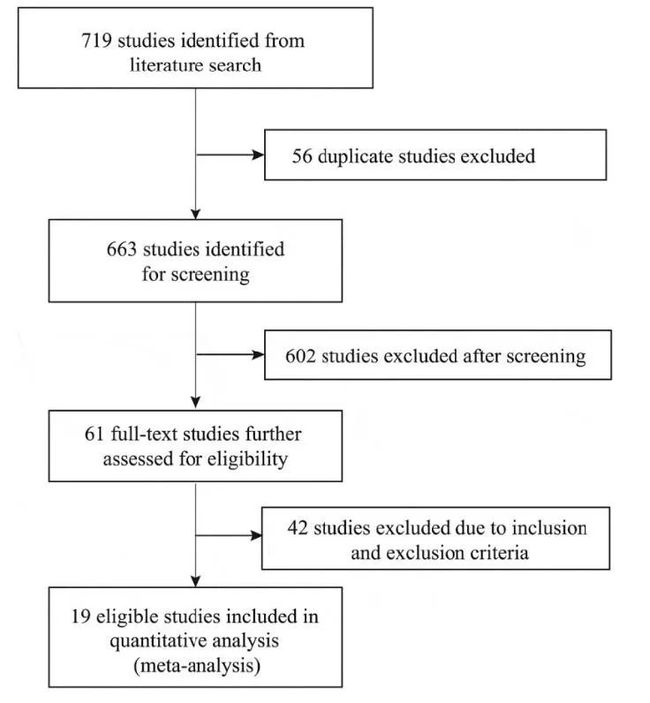
- zephyr OS 线程的使用
目录概述1线程的概念1.1线程定义1.2线程的本质定义1.3线程的核心组成要素1.4线程与进程的对比1.5线程在RTOS中的关键特性1.6线程的同步与通信1.7线程在嵌入式系统的特殊考量1.8多线程编程模型2ZephyrRTOS中线程2.1创建线程的步骤2.2ZephyrRTOS中线程定义2.3关键API函数2.4线程中的睡眠函数3线程应用实践3.1完整线程定义模板3.1.1源代码3.1.2关键细
- 华为OD机考2025B卷 - 停车费用统计 (Java & Python& JS & C++ & C )
算法大师
最新华为OD机试真题华为OD机试真题(Java/JS/Py/C)华为odjavapython华为OD机考2025B卷javascriptc++
最新华为OD机试真题目录:点击查看目录华为OD面试真题精选:点击立即查看2025华为od机试2025B卷-华为机考OD2025年B卷题目描述停车场统计当日总收费,包月的车不统计,不包月的车半个小时收一块钱,不满半小时不收钱,如果超过半小时,零头不满半小时按半小时算,每天11:30-13:30时间段不收钱,如果一辆车停车时间超过8小时后不收费(网友回忆,数值不一定为8,正式机考的时候注意一下)。输入
- SAP-ABAP:SAP全模块的架构化解析,涵盖核心功能、行业方案及技术平台
爱喝水的鱼丶
运维SAPABAP服务器ERP
一、核心业务模块(Logistics&Operations)模块代号核心功能典型流程关键事务码物料管理MM采购/库存/发票校验采购到付款(P2P)ME21N(采购订单),MI31(库存盘点)销售与分销SD订单/定价/发货/开票订单到现金(OTC)VA01(销售订单),VF01(开票)生产计划PPMRP/工艺路线/成本核算计划到生产(P2P)MD04(MRP清单),COOIS(生产订单监控)质量管理
- 鸿蒙OH南向开发 小型系统内核(LiteOS-A)【扩展组件】下
yx525623
鸿蒙开发openharmony鸿蒙南向鸿蒙开发harmonyosopenharmony鸿蒙南向嵌入式硬件
轻量级进程间通信基本概念LiteIPC是OpenHarmonyLiteOS-A内核提供的一种新型IPC(Inter-ProcessCommunication,即进程间通信)机制,不同于传统的SystemVIPC机制,LiteIPC主要是为RPC(RemoteProcedureCall,即远程过程调用)而设计的,而且是通过设备文件的方式对上层提供接口的,而非传统的API函数方式。LiteIPC中有两
- Xilinx FPGA ICAP原语实现多重配置
whik1194
ISEVivadoMicroBlaze系列教程FPGAxilinxICAPMultiboot多重配置
文章目录1.FPGA可以运行几个固件2.XilinxICAP原语简介3.ICAP原语模板的使用4.ICAP在Spartan-6上的使用5.ICAP在Kintex-7上的使用工程下载1.FPGA可以运行几个固件众所周知,常见的FPGA通常为SRAM结构,固件程序一般存放在外置的串行Flash中,比如SPIFlash,M25P16或N25Q128等。FPGA启动时,一般先从SPI起始地址开始加载数据到
- Web Components 与 Shadow DOM 的样式隔离
海派程序猿
前端
WebComponents和ShadowDOM:一墙之隔,天下太平?各位看官,咱们今天聊聊WebComponents里面一个挺有意思的概念——ShadowDOM。别被这名字吓到,什么“影子”,什么“领域”,听起来玄乎,其实它就是WebComponents实现样式隔离的一把利器。想象一下,你写了一个非常炫酷的日期选择器,用了自定义的颜色、字体,各种动画效果,简直完美!然后你把它扔到你的项目里,结果…
- 一、Linux C/C++ 网路socket基础代码
1776323096
LinuxC/C++网络IOlinuxc语言c++服务器网络
文章目录需要用到的函数1、intsocket(int__domain,int__type,int__protocol);2、intbind(int__fd,__CONST_SOCKADDR_ARG__addr,socklen_t__len);3、intlisten(int__fd,int__n);4、intaccept(int__fd,__SOCKADDR_ARG__addr,socklen_t*
- Linux下使用C/C++进行UDP网络编程
袁本美
Linux网络linuxudpc++
UDP是UserDatagramProtocol的简称,中文名是用户数据报协议,是一种无连接、不可靠的协议,同样它也是工作在传顺层。它只是简单地实现从一端主机到另一端主机的数据传输功能,这些数据通过IP层发送,在网络中传输,到达目标主机的顺序是无法预知的,因此需要应用程序对这些数据进行排序处理,这就带来了很大的不方便,此外,UDP协议更没有流量控制、拥塞控制等功能,在发送的一端,UDP只是把上层应
- Python 音乐爬虫实战:从网页抓包到歌曲下载
维他奶糖61
python爬虫开发语言
在数字音乐的世界里,通过编程的方式获取自己喜欢的音乐,是一件既有趣又充满挑战的事情。今天,我们就用Python来打造一个简单的音乐爬虫,实现从网页抓包分析,到最终下载歌曲的全过程。一、代码概览流程先来看一下完整的Python代码:importos#抓包过滤媒体#id#EltfAyJRBlZeEF1aUCQFAFhfFF8NUnheUVhfF11XUyQaVldTR19NVndTVVlSQ1hfVw
- 智联招聘爬虫
维他奶糖61
爬虫python开发语言数据挖掘
使用Python和Selenium进行招聘信息爬取在当今数字化时代,数据已成为企业决策的重要依据。对于人力资源部门或求职者而言,获取最新的招聘信息至关重要。然而,手动浏览和收集招聘信息不仅耗时费力,而且效率低下。为了解决这个问题,我们可以使用Python和Selenium库来自动化这一过程,实现从招聘网站上批量爬取招聘信息。准备工作在开始之前,你需要确保已经安装了以下库:Python(建议版本3.
- JS 与 CSS 的交互式开发:打造灵动的网页体验
维他奶糖61
pandas数据库前端
在当今的网页开发领域,静态的网页早已无法满足用户日益增长的交互需求。JavaScript(JS)和层叠样式表(CSS)作为前端开发的两大支柱,它们的强强联合能够创造出令人惊叹的交互式网页效果。从简单的按钮点击变色,到复杂的动画过渡和动态页面布局变换,JS与CSS的交互式开发赋予了网页生命与活力。接下来,就让我们深入探索这一奇妙的领域。理解JS与CSS的分工与协作在开始交互式开发之前,我们需要明确J
- Python 图片爬虫实战:从代码解析到应用技巧
维他奶糖61
python爬虫开发语言
在数字时代,图片资源丰富多样,通过爬虫技术批量获取心仪的图片成为不少人的需求。本文将以爬取彼岸桌面壁纸网4K美女壁纸为例,深入解析Python图片爬虫代码,分享实用技巧,带你轻松掌握图片爬虫技术。一、爬虫实现思路爬虫的核心是模拟浏览器访问网页,解析页面内容,提取所需信息。本次爬虫的流程如下:构建目标网页URL列表,循环访问各页面;发送HTTP请求获取页面内容,解析HTML文档;定位图片元素,提取图
- 电商用户行为可视化大屏--大数据项目
一.项目目的1.深入了解服务:用户的浏览路径、购买频率、商品评价等数据,能够精准地刻画用户画像。了解用户的年龄、性别、地域等基本信息,以及他们的兴趣爱好、消费习惯等更深入的特征,从而为个性化的营销和服务提供依据。2.优化用户体验:通过分析用户在页面之间的跳转时间、购物车的使用情况等,找出可能存在的流程不畅或设计不合理的地方。3.提高运营效率:对商品销售数据、库存数据等进行关联分析,有助于合理安排库
- 时序数据库IoTDB可实现的基本操作及命令汇总
时序数据说
时序数据库iotdb数据库物联网大数据开源
一、数据写入、删除与导出1.1数据写入在物联网场景下,元件产生的数据通常会自动写入。但有时,需要修改过去的数据,可以使用INSERT语句插入修改后的值,覆盖原数据。示例:INSERTINTOroot.BHSFC.Q1.W003(timestamp,speed)VALUES(1657472400000,2);1.2数据删除1.2.1SQL语句删除删除整个时间序列:DELETEFROMroot
- 一文读懂Kubernetes之 K8s 概述
野熊佩骑
Linux系统应用运维kubernetes容器云原生docker微服务kubeletdevops
目录一、Kubernetes集群组件(一)、控制平面组件(ControlPlaneComponents)1、kube-apiserver2、etcd3、kube-scheduler4、kube-controller-manager5、cloud-controller-manager(可选的)(二)、节点组件1、kubelet2、kube-proxy(可选的)3、容器运行时(Containerrun
- JavaEE:分布式session
一、使用Redis存储分布式session:1.SpringBoot整合Redis,见如下地址:JavaEE:SpringBoot整合Redis_a526001650a-CSDN博客2.代码实现分布式session存储(此处以token为例):@AutowiredprivateRedisTemplateredisTemplate;//Redis数据操作类//登录接口,存储token到redis中@
- Linux下基于C++11的socket网络编程(线程版本)
吃拉面的小波
C++网络编程linux网络c++
第一:关于C++11的线程操作哈哈,百度这个比较直接,可以很清楚的告诉你。第二:声明不再追溯,可以先看看(基础版本)(进程版本)(select函数版本)(epoll版本)再看这个,谢谢。工具类我也不再写,可以查看(进程版本),一模一样,直接复制过来就可以用了。客户端也和(进程版本)一样,所以后面的文章,就不再写客户端。第三:代码工具类:略,看声明客户端:略,看声明服务端/*============
- Flutter:BLE蓝牙开发
杨先生_
Flutterflutter
说明:使用flutter_blue_plus插件实现低功耗蓝牙开发。一、添加蓝牙权限:1.Android网络权限(工程/android/app/src/main/AndroidManifest.xml):2.iOS蓝牙权限(工程/ios/Runner/Info.plist): ... NSBluetoothAlwaysUsageDescription NeedBLEpermission N
- Linux下基于C++11的socket网络编程(epoll版本)
第一:epoll哈哈,百度这个比较直接,可以很清楚的告诉你。第二:声明不再追溯,可以先看看(基础版本)(进程版本)(select函数版本)再看这个,谢谢。工具类我也不再写,可以查看(进程版本),一模一样,直接复制过来就可以用了。客户端也和(进程版本)一样,所以后面的文章,就不再写客户端。第三:代码工具类:略,看声明客户端:略,看声明服务端/*============================
- Linux下基于C++11的socket网络编程(基础版本)
吃拉面的小波
C++网络编程linux网络c++
第一:socket的基础知识略,网上有很多这样的知识,我觉得他们应该讲的比我好。我是跟着韩国人尹圣雨写的《TCP/IP网络编程》这本书学的。第二:使用的线程库C++11std::thread在经过自己简单的封装第三:声明因为我也是初学,可能写的不好,封装的也不好,我写这篇文章,只是希望帮助很基础的初学者,慢慢的接触socket,也给自己记录一下学习的经过。所以,如果错误的,或者不好的地方,望各位多
- (PAT甲级)1019 General Palindromic Number 进制转换+回文数 (进制转换问题的实用技巧)
JaredYe
算法c++c语言pat考试
AnumberthatwillbethesamewhenitiswrittenforwardsorbackwardsisknownasaPalindromicNumber.Forexample,1234321isapalindromicnumber.Allsingledigitnumbersarepalindromicnumbers.Althoughpalindromicnumbersaremos
- 【Linux系统】Linux系统习题整理
JaredYe
1024程序员节linux
1-Linux系统&用户管理一.单选题(共15题,100分)1.(单选题)超级用户(root)用()作为默认的shell提示符。A.$B.#C.?D.!我的答案:B:#;正确答案:B:#;6.6分2.(单选题)Shell的自动补齐功能按()键会在相关目录下自动查找匹配项。A.TabB.SHIFTC.^DD.ALT我的答案:A:Tab;正确答案:A:Tab;6.6分3.(单选题)终止一个前台进程可能
- 我用这10个工具,开发效率提升了3倍!
ZoeXu-Arch
人工智能aipython数据库自动化
大家好,我是Zoe,今天来和大家聊聊开发效率这件事。前言:选对工具,开发效率直接起飞在这个卷出银河系的时代,写得快、测得稳、部署无感,才是开发者的核心竞争力。真正拉开人与人差距的,不只是编码能力,而是你有没有一整套趁手的“开发武器库”。最近我测试并整理了10款亲测有效、提升开发效率的神器,涵盖:AI编程助手、本地开发环境、数据处理、DevOps流水线……一句话总结:这10个工具,顶得上一个团队。希
- 数据库领域下的时序数据库并发控制
数据库管理艺术
数据库专家之路大数据AI人工智能MCP&Agent数据库时序数据库ai
时序数据库并发控制:原理、实现与最佳实践关键词:时序数据库、并发控制、MVCC、时间戳排序、乐观并发控制、分布式事务、性能优化摘要:本文深入探讨时序数据库中的并发控制机制,从基本原理到实际实现进行全面剖析。文章首先介绍时序数据库的特点和并发控制挑战,然后详细分析MVCC、时间戳排序等核心算法原理,并通过代码示例展示实现细节。接着探讨分布式环境下的特殊考量,提供性能优化策略和实际应用案例。最后展望未
- k8s强制删除pod&pv&pvc和ns&namespace
zz960226
kubernetes容器云原生
k8s如何强制删除pod&pv&pvc和ns&namespace方法namespace、pod、pv、pvc全部处于“Terminating”状态时,此时的该名称空间下的所有控制器都已经被删除了,之所以出现pod、pvc、pv、ns无法删除,那是因为kubelet阻塞,有其他的资源在使用该namespace,比如CRD等,尝试重启kubelet,再删除该namespace也不好使。正确的删除方法:
- 信息安全与网络安全---引言
薄荷椰果抹茶
信息安全与网络安全安全网络安全
仅供参考文章目录一、计算机安全1.1CIA三元组1.2影响等级1.3计算机安全的挑战二、OSI安全体系结构2.1安全攻击2.2安全服务2.3安全机制三、基本安全设计准则四、攻击面和攻击树(重点)4.1攻击面4.2攻击树五、习题与答案一、计算机安全(1)对某个自动化信息系统的保护措施(2)其目的在于实现信息系统资源的完整性、机密性、以及可用性1.1CIA三元组C:机密性数据机密性Dataconfid
- PART 7 视频
qq_39717490
音视频opencv人工智能
在Debian10上安装OpenCV的两种方法:从存储库和源代码中安装OpenCV_debianopencv-CSDN博客本人的树莓派系统是pi@pi:~$lsb_release-aNoLSBmodulesareavailable.DistributorID:DebianDescription:DebianGNU/Linux12(bookworm)Release:12Codename:bookwo
- Linux下基于C++11的socket网络编程(基础)个人总结版
丯是幡动
网络linuxc++分布式
跟着这个人做的,感觉是一个非常好的socket入门的代码,而且文件命名也有,代码还全,复制就能跑,对小白非常友好https://blog.csdn.net/RMB20150321/article/details/121478376?spm=1001.2014.3001.5502一共五个版本从简单到难,打算和这个博主一样做。另外,感谢deepseek救我狗命阅读建议:直接先看2,有函数不懂的看1找。
- 《Python 实现 B 站视频信息爬虫:从批量获取到 CSV 保存》
维他奶糖61
python音视频爬虫
B站视频信息爬虫实战:用Python批量获取B站视频数据引言在数据分析和内容研究场景中,获取B站视频的标题、播放量、作者等信息是常见需求。本文将介绍如何使用Python编写一个B站视频爬虫,通过DrissionPage库实现自动化数据采集,并保存为CSV格式。相比传统Selenium,DrissionPage的API更简洁,适合快速开发爬虫脚本。技术栈与环境准备核心库:DrissionPage:基
- JavaEE:CAS单点登录
杨先生_
JavaEEjava-eejava
说明:CAS单点登录用于实现多个顶级域名不同的系统或各子系统实现统一登录,一处登录,各系统免登录。JWT工具类实现:JavaEE:JWT生成/解析token与Spring拦截器_jwt可以解析token吗-CSDN博客一、CAS登录/登出实现:1.单点登录(创建全局ticket+临时ticket):/** *登录CAS系统(供CAS登录页调用) *1.登录验证,并创建用户分布式会话(Token存入
- 312个免费高速HTTP代理IP(能隐藏自己真实IP地址)
yangshangchuan
高速免费superwordHTTP代理
124.88.67.20:843
190.36.223.93:8080
117.147.221.38:8123
122.228.92.103:3128
183.247.211.159:8123
124.88.67.35:81
112.18.51.167:8123
218.28.96.39:3128
49.94.160.198:3128
183.20
- pull解析和json编码
百合不是茶
androidpull解析json
n.json文件:
[{name:java,lan:c++,age:17},{name:android,lan:java,age:8}]
pull.xml文件
<?xml version="1.0" encoding="utf-8"?>
<stu>
<name>java
- [能源与矿产]石油与地球生态系统
comsci
能源
按照苏联的科学界的说法,石油并非是远古的生物残骸的演变产物,而是一种可以由某些特殊地质结构和物理条件生产出来的东西,也就是说,石油是可以自增长的....
那么我们做一个猜想: 石油好像是地球的体液,我们地球具有自动产生石油的某种机制,只要我们不过量开采石油,并保护好
- 类与对象浅谈
沐刃青蛟
java基础
类,字面理解,便是同一种事物的总称,比如人类,是对世界上所有人的一个总称。而对象,便是类的具体化,实例化,是一个具体事物,比如张飞这个人,就是人类的一个对象。但要注意的是:张飞这个人是对象,而不是张飞,张飞只是他这个人的名字,是他的属性而已。而一个类中包含了属性和方法这两兄弟,他们分别用来描述对象的行为和性质(感觉应该是
- 新站开始被收录后,我们应该做什么?
IT独行者
PHPseo
新站开始被收录后,我们应该做什么?
百度终于开始收录自己的网站了,作为站长,你是不是觉得那一刻很有成就感呢,同时,你是不是又很茫然,不知道下一步该做什么了?至少我当初就是这样,在这里和大家一份分享一下新站收录后,我们要做哪些工作。
至于如何让百度快速收录自己的网站,可以参考我之前的帖子《新站让百
- oracle 连接碰到的问题
文强chu
oracle
Unable to find a java Virtual Machine--安装64位版Oracle11gR2后无法启动SQLDeveloper的解决方案
作者:草根IT网 来源:未知 人气:813标签:
导读:安装64位版Oracle11gR2后发现启动SQLDeveloper时弹出配置java.exe的路径,找到Oracle自带java.exe后产生的路径“C:\app\用户名\prod
- Swing中按ctrl键同时移动鼠标拖动组件(类中多借口共享同一数据)
小桔子
java继承swing接口监听
都知道java中类只能单继承,但可以实现多个接口,但我发现实现多个接口之后,多个接口却不能共享同一个数据,应用开发中想实现:当用户按着ctrl键时,可以用鼠标点击拖动组件,比如说文本框。
编写一个监听实现KeyListener,NouseListener,MouseMotionListener三个接口,重写方法。定义一个全局变量boolea
- linux常用的命令
aichenglong
linux常用命令
1 startx切换到图形化界面
2 man命令:查看帮助信息
man 需要查看的命令,man命令提供了大量的帮助信息,一般可以分成4个部分
name:对命令的简单说明
synopsis:命令的使用格式说明
description:命令的详细说明信息
options:命令的各项说明
3 date:显示时间
语法:date [OPTION]... [+FORMAT]
- eclipse内存优化
AILIKES
javaeclipsejvmjdk
一 基本说明 在JVM中,总体上分2块内存区,默认空余堆内存小于 40%时,JVM就会增大堆直到-Xmx的最大限制;空余堆内存大于70%时,JVM会减少堆直到-Xms的最小限制。 1)堆内存(Heap memory):堆是运行时数据区域,所有类实例和数组的内存均从此处分配,是Java代码可及的内存,是留给开发人
- 关键字的使用探讨
百合不是茶
关键字
//关键字的使用探讨/*访问关键词private 只能在本类中访问public 只能在本工程中访问protected 只能在包中和子类中访问默认的 只能在包中访问*//*final 类 方法 变量 final 类 不能被继承 final 方法 不能被子类覆盖,但可以继承 final 变量 只能有一次赋值,赋值后不能改变 final 不能用来修饰构造方法*///this()
- JS中定义对象的几种方式
bijian1013
js
1. 基于已有对象扩充其对象和方法(只适合于临时的生成一个对象):
<html>
<head>
<title>基于已有对象扩充其对象和方法(只适合于临时的生成一个对象)</title>
</head>
<script>
var obj = new Object();
- 表驱动法实例
bijian1013
java表驱动法TDD
获得月的天数是典型的直接访问驱动表方式的实例,下面我们来展示一下:
MonthDaysTest.java
package com.study.test;
import org.junit.Assert;
import org.junit.Test;
import com.study.MonthDays;
public class MonthDaysTest {
@T
- LInux启停重启常用服务器的脚本
bit1129
linux
启动,停止和重启常用服务器的Bash脚本,对于每个服务器,需要根据实际的安装路径做相应的修改
#! /bin/bash
Servers=(Apache2, Nginx, Resin, Tomcat, Couchbase, SVN, ActiveMQ, Mongo);
Ops=(Start, Stop, Restart);
currentDir=$(pwd);
echo
- 【HBase六】REST操作HBase
bit1129
hbase
HBase提供了REST风格的服务方便查看HBase集群的信息,以及执行增删改查操作
1. 启动和停止HBase REST 服务 1.1 启动REST服务
前台启动(默认端口号8080)
[hadoop@hadoop bin]$ ./hbase rest start
后台启动
hbase-daemon.sh start rest
启动时指定
- 大话zabbix 3.0设计假设
ronin47
What’s new in Zabbix 2.0?
去年开始使用Zabbix的时候,是1.8.X的版本,今年Zabbix已经跨入了2.0的时代。看了2.0的release notes,和performance相关的有下面几个:
:: Performance improvements::Trigger related da
- http错误码大全
byalias
http协议javaweb
响应码由三位十进制数字组成,它们出现在由HTTP服务器发送的响应的第一行。
响应码分五种类型,由它们的第一位数字表示:
1)1xx:信息,请求收到,继续处理
2)2xx:成功,行为被成功地接受、理解和采纳
3)3xx:重定向,为了完成请求,必须进一步执行的动作
4)4xx:客户端错误,请求包含语法错误或者请求无法实现
5)5xx:服务器错误,服务器不能实现一种明显无效的请求
- J2EE设计模式-Intercepting Filter
bylijinnan
java设计模式数据结构
Intercepting Filter类似于职责链模式
有两种实现
其中一种是Filter之间没有联系,全部Filter都存放在FilterChain中,由FilterChain来有序或无序地把把所有Filter调用一遍。没有用到链表这种数据结构。示例如下:
package com.ljn.filter.custom;
import java.util.ArrayList;
- 修改jboss端口
chicony
jboss
修改jboss端口
%JBOSS_HOME%\server\{服务实例名}\conf\bindingservice.beans\META-INF\bindings-jboss-beans.xml
中找到
<!-- The ports-default bindings are obtained by taking the base bindin
- c++ 用类模版实现数组类
CrazyMizzz
C++
最近c++学到数组类,写了代码将他实现,基本具有vector类的功能
#include<iostream>
#include<string>
#include<cassert>
using namespace std;
template<class T>
class Array
{
public:
//构造函数
- hadoop dfs.datanode.du.reserved 预留空间配置方法
daizj
hadoop预留空间
对于datanode配置预留空间的方法 为:在hdfs-site.xml添加如下配置
<property>
<name>dfs.datanode.du.reserved</name>
<value>10737418240</value>
- mysql远程访问的设置
dcj3sjt126com
mysql防火墙
第一步: 激活网络设置 你需要编辑mysql配置文件my.cnf. 通常状况,my.cnf放置于在以下目录: /etc/mysql/my.cnf (Debian linux) /etc/my.cnf (Red Hat Linux/Fedora Linux) /var/db/mysql/my.cnf (FreeBSD) 然后用vi编辑my.cnf,修改内容从以下行: [mysqld] 你所需要: 1
- ios 使用特定的popToViewController返回到相应的Controller
dcj3sjt126com
controller
1、取navigationCtroller中的Controllers
NSArray * ctrlArray = self.navigationController.viewControllers;
2、取出后,执行,
[self.navigationController popToViewController:[ctrlArray objectAtIndex:0] animated:YES
- Linux正则表达式和通配符的区别
eksliang
正则表达式通配符和正则表达式的区别通配符
转载请出自出处:http://eksliang.iteye.com/blog/1976579
首先得明白二者是截然不同的
通配符只能用在shell命令中,用来处理字符串的的匹配。
判断一个命令是否为bash shell(linux 默认的shell)的内置命令
type -t commad
返回结果含义
file 表示为外部命令
alias 表示该
- Ubuntu Mysql Install and CONF
gengzg
Install
http://www.navicat.com.cn/download/navicat-for-mysql
Step1: 下载Navicat ,网址:http://www.navicat.com/en/download/download.html
Step2:进入下载目录,解压压缩包:tar -zxvf navicat11_mysql_en.tar.gz
- 批处理,删除文件bat
huqiji
windowsdos
@echo off
::演示:删除指定路径下指定天数之前(以文件名中包含的日期字符串为准)的文件。
::如果演示结果无误,把del前面的echo去掉,即可实现真正删除。
::本例假设文件名中包含的日期字符串(比如:bak-2009-12-25.log)
rem 指定待删除文件的存放路径
set SrcDir=C:/Test/BatHome
rem 指定天数
set DaysAgo=1
- 跨浏览器兼容的HTML5视频音频播放器
天梯梦
html5
HTML5的video和audio标签是用来在网页中加入视频和音频的标签,在支持html5的浏览器中不需要预先加载Adobe Flash浏览器插件就能轻松快速的播放视频和音频文件。而html5media.js可以在不支持html5的浏览器上使video和audio标签生效。 How to enable <video> and <audio> tags in
- Bundle自定义数据传递
hm4123660
androidSerializable自定义数据传递BundleParcelable
我们都知道Bundle可能过put****()方法添加各种基本类型的数据,Intent也可以通过putExtras(Bundle)将数据添加进去,然后通过startActivity()跳到下一下Activity的时候就把数据也传到下一个Activity了。如传递一个字符串到下一个Activity
把数据放到Intent
- C#:异步编程和线程的使用(.NET 4.5 )
powertoolsteam
.net线程C#异步编程
异步编程和线程处理是并发或并行编程非常重要的功能特征。为了实现异步编程,可使用线程也可以不用。将异步与线程同时讲,将有助于我们更好的理解它们的特征。
本文中涉及关键知识点
1. 异步编程
2. 线程的使用
3. 基于任务的异步模式
4. 并行编程
5. 总结
异步编程
什么是异步操作?异步操作是指某些操作能够独立运行,不依赖主流程或主其他处理流程。通常情况下,C#程序
- spark 查看 job history 日志
Stark_Summer
日志sparkhistoryjob
SPARK_HOME/conf 下:
spark-defaults.conf 增加如下内容
spark.eventLog.enabled true spark.eventLog.dir hdfs://master:8020/var/log/spark spark.eventLog.compress true
spark-env.sh 增加如下内容
export SP
- SSH框架搭建
wangxiukai2015eye
springHibernatestruts
MyEclipse搭建SSH框架 Struts Spring Hibernate
1、new一个web project。
2、右键项目,为项目添加Struts支持。
选择Struts2 Core Libraries -<MyEclipes-Library>
点击Finish。src目录下多了struts