-
原文: The gut microbiota, bacterial metabolites and colorectal cancer
-
杂志: Nature Reviews Microbiology volume 12, pages661–672(2014)
- DOI: 10.1038/nrmicro3344
- 作者:Harry J. Flint
- 单位: Microbiology Group, Rowett Institute of Nutrition and Health, University of Aberdeen, UK
本文核心内容:
- 饮食摄入量对肠道环境有重要影响,其中很大一部分是由肠道菌群对饮食化合物的代谢活性介导的。
- 不同的微生物代谢产物具有促进和预防结直肠癌(CRC)的潜力。
- 越来越多的证据表明,微生物来源的短链脂肪酸可控制炎症和调节T细胞的数量。 这涉及抑制宿主组蛋白脱乙酰基酶和与细胞表面受体的相互作用。
- 肠道菌群中的多种物种在释放和转化饮食来源的植物化学物质以及宿主来源的胆汁酸和糖结合物方面具有复杂的作用,所有这些都会影响整个微生物的代谢组。
- 肠道菌群组成的改变可以在粪便样本和与CRC相关的肿瘤相关群落中检测到。 尽管其中许多变化可能是必然的,但某些特定的病原体似乎是导致病因和疾病发展的原因。
- CRC的病因学不太可能归因于单一病原体的存在和活动,因此建议应考虑微生物代谢产物的累积作用,以更好地预测和预防癌症的加重。
摘要
- 越来越多的证据表明,人类肠道微生物群不仅通过特定病原体的致癌活性,而且还通过更广泛的微生物群落,特别是其代谢组的影响,对大肠癌的病因做出了贡献。 最近的数据表明,乙酸,丙酸和丁酸短链脂肪酸在抑制炎症和癌症中起作用,而其他微生物代谢产物(例如:次级胆汁酸)则促进癌变。
- 在这篇综述中,我们讨论了饮食,微生物代谢和CRC之间的关系,并认为应该考虑微生物代谢产物的累积作用,以便更好地预测和预防癌症的进展。
主要内容:
- 我们对人类微生物群的组成和代谢的了解的最新进展已经确定,它对人类健康具有重要影响。 重要的是,积累的数据表明,微生物群通过影响炎症,DNA损伤和细胞凋亡而在几种类型癌症的病因学中起作用。 由于我们最大的微生物暴露发生在肠道,特别是大肠,因此肠道菌群参与结直肠癌(CRC)是一个活跃的研究领域。
- 结肠炎相关癌CRC是世界上第三大最常见的癌症死亡原因1。 这种疾病通常通过一系列遗传改变而发展,这被称为腺瘤-癌序列2(Box1)。 与大肠的近端区域相比,大肠的远端(包括降结肠和直肠)的肿瘤更为常见3,这可能反映了这些肠腔腔环境的差异。 尽管某些形式的CRC可能是遗传性的5,但大多数CRC病例显示出与饮食和生活方式有关1,6。
- 此外,患有炎症性肠病(IBD)的人显示出CRC(这被称为结肠炎相关癌症(CAC))的发病率增加 。 最近已经综述了特定病原细菌通过与宿主细胞的促炎性相互作用促进CRC的潜在作用 。 然而,越来越明显的是,肠道内细菌群(而不只是特定病原体)的集体活动,特别是其代谢产物,强烈地影响着对CRC4,9的预防和发展。 在这篇综述中,我们讨论了最近的研究,这些研究说明了CRC背景下饮食与微生物代谢之间的复杂关系,重点是保护性和有害细菌代谢产物对炎症和癌症的影响。
- 我们提出,不是单一的致病性生物,而是微生物群的净新陈代谢输出和由此引起的炎性信号是CRC的主要贡献者,应进行调查以增进我们对这种疾病的了解。
Box1: CRC发生的遗传基础:腺瘤-癌序列
- 每年报告超过120万例大肠癌新病例,其中大多数是偶发性发生,这是由于几个基因中突变的积累和表观遗传修饰所致。 被认为会导致恶性进展的遗传改变的顺序积累涉及从正常粘膜向恶变前病变的转变,并在数年内发展为大肠腺瘤和暴发性CRC13。 这种病原学框架被称为腺瘤-癌序列132。 初始突变最常发生在腺瘤性息肉病(APC)肿瘤抑制基因中,该基因编码一种多功能蛋白,在WNT信号通路,细胞间粘附,细胞骨架稳定,细胞周期调节和凋亡中具有重要作用。 APC中的突变赋予选择性生长优势,从而增强了突变细胞的生长。 另一个基因(例如KRAS)的进一步突变,通常是G蛋白信号转导以及细胞增殖和分化调节的基因,可促进克隆的快速生长和细胞数量的增加。 突变继之以克隆扩增的过程仍在继续,而PIK3CA,SMAD4,TP53,CTNNB1和BRAF等基因的突变最终导致恶性肿瘤。
- 尽管所有腺瘤都具有恶性转化的能力,但并非所有腺瘤都会发展为浸润性癌。 腺瘤的病理特征(如大小,类型,组织学分级和增生灶的存在)都可以预测其恶性潜能。 然而,目前尚不清楚为什么有些腺瘤会发展为恶性肿瘤,而另一些腺瘤会稳定甚至消退。 值得注意的是,腺瘤中炎症细胞的数量增加了,远远高于健康结肠组织中预期的数量
饮食和肠道菌群的组成
- 胃肠道的不同区域在运输时间,pH,暴露于氧气,营养物质可利用,宿主分泌物(例如胆汁和消化酶),粘膜表面以及与免疫系统的相互作用方面差异很大,所有这些都会影响微生物定植14。 ·。 ·大肠包含健康成年人中最密集和代谢活跃的微生物群落(每克含量> 1011个细胞),除放线菌属,变形杆菌属和疣状微生物菌外,其主要由属于两个门的无氧细菌(硬毛菌和拟杆菌)组成。 ·尽管微生物群落的组成存在很大的个体差异,但人体研究表明,饮食组成对肠道菌群有重要影响,因此,在精心控制之间进行切换后的几天,便可以检测到粪便菌群的变化。 ·饮食16,17。 ·对碳水化合物摄入变化有反应的许多物种似乎都属于Firmicutes和Actinobacteria,它们是营养学专业的14,18。 ·在Firmicutes中,Ruminococcaceae(尤其是Ruminococcus bromii)响应富含抗性淀粉的饮食而增加,而Lachnospiraceae响应于富含麦麸的饮食而增加16,19。 ·粪便微生物群的组成发生了实质性变化,例如产生丁酸盐的硬毛菌(主要是玫瑰茄属和真细菌)和放线菌(例如双歧杆菌和嗜水气单胞菌)的减少,这些都是由于低碳水化合物引起的。 ·,减肥饮食16,20。 ·最近,由于极端植物性饮食(纤维含量高,脂肪和蛋白质含量低,分别占热量摄入的32%和10%)之间的转换,据报道,成分变化范围更大。 基础饮食(不含纤维,脂肪和蛋白质含量高,分别占热量摄入的70%和30%)。 响应以动物为基础的饮食,拟杆菌属(例如拟杆菌属和阿利培斯属)和嗜蓝芽胞菌的丰富度增加,而硬毛纲的几个成员数量减少17。 ·还有证据表明,习惯性饮食摄入的变化是肠道微生物群分布差异的原因。 例如,普氏杆菌属比例很高的个体。 粪微生物中的细菌倾向于消耗更多的纤维,而拟杆菌属则占更多。 富含消耗高水平蛋白质和脂肪的个体 。 这表明拟杆菌属中有拟杆菌属的生态区划。 ·比拟杆菌属装备得更好。 用于降解纤维。 有趣的是,最近的宏基因组学分析表明,粪便微生物群在普通人群中具有双峰分布,因此某些个体的多样性(称为低基因计数(LGC))比其他个体(称为高基因计数(HGC))少 。 LGC群落倾向于以拟杆菌属为主。 ·并显示出产生丁酸盐的Firmicutes减少,具有这种特征的人肥胖和代谢综合症的发生率更高23,24。 ·此外,改用控制减肥饮食的LGC菌群肥胖志愿者表现出菌群多样性的增加,接近了HGC社区24.因此,饮食显然对肠道菌群的组成有重要影响。 ·,因此饮食干预可能会影响对具有微生物成分的疾病(例如CRC)的敏感性。
- 尽管对纤维摄入与癌症风险之间的联系进行了辩论,但最近的荟萃分析研究表明,高纤维摄入,尤其是谷物和全谷物的摄入,与CRC25风险降低以及晚期结直肠腺瘤患者( ·据报道是CRC前体病变)与健康对照组相比膳食纤维摄入量低26。 ·相比之下,富含红色和加工肉,脂肪和酒精的饮食与CRC6风险增加相关。 ·与非裔美国人相比,农村土著非洲人的CRC发生率较低,这意味着相对于蛋白质和脂肪,膳食中摄入的非消化性碳水化合物含量较高,并且肠道菌群的发酵能力存在重大差异27。 ·肠道中的微生物代谢 ·到达大肠和宿主产品(主要是粘蛋白)的未消化饮食成分被厌氧微生物群落发酵,产生了范围非常广泛的代谢产物,既反映了可用底物的化学多样性,也反映了微生物群的卓越生化能力, ·28。 ·健康成年人的主要发酵产物是气体和有机酸(图1),特别是乙酸,丙酸和丁酸这三种短链脂肪酸(SCFA),通常以3/1/1的比例混合在一起 ·在结肠中的浓度为50–150 mM29。 ·不可消化的碳水化合物通常是微生物发酵的主要底物,包括植物细胞壁的结构多糖(非淀粉多糖),抗性淀粉和某些可溶性低聚糖(例如低聚果糖)18。 ·结肠中不可消化的碳水化合物的可用性随饮食和进餐时间的不同而有很大差异,而内源性衍生产品(如粘蛋白)的供应却几乎保持不变。
肠道中的微生物代谢
- 到达大肠和宿主产品(主要是粘蛋白)的未消化饮食成分被厌氧微生物群落发酵,产生了范围非常广泛的代谢产物,既反映了可用底物的化学多样性,也反映了微生物群的卓越生化能力。 ·健康成年人的主要发酵产物是气体和有机酸(图1),特别是乙酸,丙酸和丁酸这三种短链脂肪酸(SCFA),通常以3/1/1的比例混合在一起 ·在结肠中的浓度为50–150 mM29。 ·不可消化的碳水化合物通常是微生物发酵的主要底物,包括植物细胞壁的结构多糖(非淀粉多糖),抗性淀粉和某些可溶性低聚糖(例如低聚果糖)18。 ·结肠中不可消化的碳水化合物的可用性随饮食和进餐时间的不同而有很大差异,而内源性衍生产品(如粘蛋白)的供应却几乎保持不变。
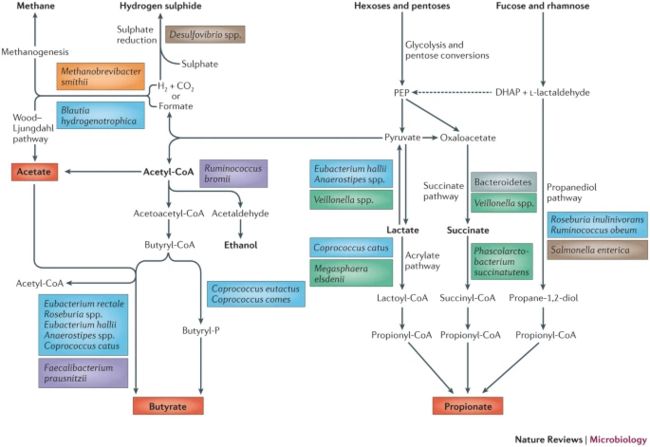
图1:负责碳水化合物发酵和细菌交叉喂入的主要微生物代谢产物生物合成的途径
- 在三种主要的短链脂肪酸(SCFA;以红色显示)中,乙酸可由许多肠细菌从丙酮酸中通过乙酰辅酶A以及通过乙酸原酶(如Blautia hydrootrophica)通过Wood-Ljungdahl途径产生。 ·丁酸酯是由两个乙酰辅酶A分子由多个Firmicutes形成的,而丁酰辅酶A:乙酸酯辅酶A转移酶通常用于催化最后一个酶促步骤。 ·丙酸盐的主要生产途径是琥珀酸盐途径,拟杆菌属可利用它从碳水化合物中产生丙酸盐,有些菌商使用其从乳酸或琥珀酸盐中产生丙酸盐。 ·在某些肠道细菌中还发现了另外两个丙酸酯形成途径:使用乳酸的丙烯酸酯途径和使用脱氧己糖(如岩藻糖和鼠李糖)的丙二醇途径40。 ·还显示了参与氢代谢和乙醇生产的途径。 ·显示的细菌物种基于对优势物种的培养分离株的研究和宏基因组学分析,因此并不详尽。 ·古生菌显示为橙色,拟杆菌属显示为灰色,蓝藻纲科(Firmicutes)显示为蓝色,芸香球菌科(Firmicutes)显示为紫色,负eg科(Firmicutes)显示为绿色,变形杆菌显示为棕色。 ·DHAP,磷酸二羟基丙酮酯; ·PEP,磷酸烯醇丙酮酸。
- 结肠中的细菌代谢不仅可以发酵,还可以包括无氧呼吸,其中硝酸盐,硫酸盐和各种有机化合物起电子受体的作用。 与大多数专性厌氧菌相比,兼性厌氧菌(包括变形杆菌)能够利用可用的氧气作为电子受体,从而增加了从底物的能量回收,除拟杆菌属(Bacteroides spp.31)和费氏杆菌(Faecalibacterium prausnitzii32)也可以使用氧气。 拟杆菌属 具有细胞色素,而F. prausnitzii似乎依赖于黄素和硫醇的细胞外电子转移。 **重要的是,由于这些厌氧菌对氧气的敏感性,这种新陈代谢形式只能在低氧气浓度下发生,其对肠道粘膜微生物生态学的影响还需要进一步研究 **。 使用氢和甲酸盐的微生物(图1),包括产甲烷的古生菌(如史密斯甲烷微杆菌),产乙酸的细菌(如产氢青枯菌)和减少硫酸盐的细菌(如Desulfovibrio spp。) ,在其中起着特别重要的作用。 通过种间交叉进食的相互作用进行厌氧代谢 。 成年肠道中产甲烷的古细菌的丰度各不相同,肠道运输的变化(受饮食影响)可能在确定产甲烷,产乙酸和硫酸盐还原的相对贡献中起重要作用 。
保护性代谢物
- 为简单起见,根据细菌代谢产物和酶活性是否对肠道健康和致癌作用具有主要保护作用或有害作用,将其分为以下几部分。
·但是,应该强调的是,某些代谢物的作用可能会根据其浓度(例如,多胺)或环境条件(例如,细菌β-葡萄糖醛酸糖苷酶)而变化。
SCFA的微生物生产
·饮食会影响微生物SCFA的产生(Box2)。 乙酸盐是最丰富的短链脂肪酸,是大多数肠细菌作为发酵产物产生的,但是它也是由产氢细菌,例如氢营养菌,H2和CO2或甲酸盐通过Wood-Ljungdahl途径形成的(图37)(图 1)。 产乙酸细菌可以从一分子葡萄糖中产生三分子乙酸盐,但是构成大部分微生物群的非产乙酸厌氧菌必须通过形成除乙酸(或代替乙酸)以外的其他产品(包括琥珀酸盐,丙酸盐)来形成其他还原性废物。
·,丁酸盐,甲酸盐,D-乳酸盐,L-乳酸盐和乙醇(图1)。 不同发酵产物的相对合成根据微生物群的组成和环境条件而变化,包括pH,氢分压和可用的底物 。 关于培养的分离物和宏基因组学数据的最新研究表明,丙酸和丁酸主要是由不同种类的肠细菌对碳水化合物的作用产生的(图1)。 丙酸主要由拟杆菌和一些属于Negativicutes类的Firmicutes(例如Phascolarctobacterium succinatutens,Dialister spp。和Veillonella spp。)通过琥珀酸途径形成。 琥珀酸盐是某些细菌在某些环境条件下的代谢终产物29,但是专门的琥珀酸盐利用者(例如P. succinatutens)将产生的大部分琥珀酸盐转化为丙酸盐。 丙酸酯的形成还有另外两个途径:丙烯酸酯途径和丙二醇途径(图1)。
在某些Firmicutes(包括玫瑰蔷薇和Ruminococcus obeum)中存在以乳酸为底物的丙烯酸酯途径显示出有限的分布,而以脱氧己糖(例如岩藻糖和鼠李糖)为底物的丙二醇途径则存在于变形杆菌 。
- 粪便SCFA中存在的丙酸比例与拟杆菌 的相对丰度相关,这证明琥珀酸途径是丙酸的主要来源。 某些Firmicutes使用丁酰CoA:乙酸酯CoA转移酶或不太常见的磷酸转丁酰酶和丁酸激酶来催化途径的最终步骤,从而产生丁酸(图1)。 使用丁酰辅酶A:乙酸酯辅酶A转移酶途径的物种包括健康肠道菌群中最丰富的几种物种(包括法氏杆菌,罗斯伯氏菌,直肠真细菌,哈氏杆菌和厌氧菌) ,它们通常是乙酸盐 的净使用者,因此肠腔中乙酸盐的浓度取决于生产,使用和粘膜摄取的平衡。
- Lachnospiraceae的一个子集,包括哈氏肠杆菌和厌氧消化菌,可以使用乳酸和乙酸盐生成丁酸酯。 因此,这些生物可通过防止乳酸的积累在稳定微生物生态系统中发挥重要作用 。 已知只有少数厌氧菌可同时产生丙酸和丁酸,并且它们是从不同的底物产生的:菊糖R. inulinivorans由葡萄糖产生丁酸,由岩藻糖产生丙酸酯,而猫肠球菌由果糖产生丁酸酯,并由乳酸产生丙酸酯(通过丙烯酸酯途径)。
SCFA对宿主细胞的影响。
- 乙酸,丙酸和丁酸从肠腔中迅速吸收,但是它们随后的分布,命运以及对宿主细胞代谢的影响不同。 丁酸盐优选被肠上皮细胞用作能量来源,并且其在全身循环中的浓度低。
·丙酸大部分在肝脏中代谢,只有乙酸盐在外周血中达到相对较高的浓度(0.10–0.15 mM)。 - 细胞内的丁酸和丙酸(而不是乙酸盐)抑制结肠细胞和免疫细胞中的组蛋白脱乙酰基酶(HDAC)的活性,并促进组蛋白的超乙酰化,此外还涉及信号转导中涉及的某些转录因子和蛋白质。 这对基因表达和细胞分化具有多种后果48,包括结肠巨噬细胞中促炎性细胞因子(如白介素-6(IL-6)和IL-12)的下调49(图2)。 SCFA具有潜在的重要抗炎作用,并且已显示出可调节小鼠 中的结肠调节性T细胞(cTReg细胞)(图2)。
·最近的证据表明,丁酸酯和丙酸酯可诱导表达转录因子FOXP3的调节性T细胞分化,该因子在控制肠道炎症中具有至关重要的作用50,51,57。 提出丁酸引起FOXP3基因座的启动子和增强子区域中组蛋白H3的乙酰化增加,这导致FOXP3的表达增加(参考文献51)。 丙酸酯可能通过相同的机制起作用,但这需要进一步的研究 。 乳酸也有抑制HDAC的作用,尽管所需的高浓度可能不是生理性的。 有趣的是,转运蛋白SLC5A8是一种抑癌蛋白,参与了丙酸,丁酸和乳酸的转运。 尽管Slc5a8-/-小鼠未显示出致癌物诱导的肿瘤形成的增加 ,但当其浓度足够高时,可能会发生SCFA的替代转运机制(包括被动扩散) 。
图2:结肠菌及其代谢产物的抗炎和抗凋亡作用被认为可减轻结肠直肠癌的发生
细菌的主要发酵产物是丁酸酯,丙酸酯和乙酸酯的短链脂肪酸(SCFA),它们可以被受体表面上的受体(例如G蛋白偶联受体(GPCR)GPR41,GPR43和GPR109A)识别。
·结肠细胞(如图所示)和免疫细胞(未显示)。 SCFA也被转运到宿主细胞中,导致丁酸酯和丙酸酯随后抑制组蛋白脱乙酰基酶(HDAC)活性,从而导致组蛋白超乙酰化。
·多项研究表明,SCFA和GPCR之间的相互作用以及SCFA对HDAC的抑制作用还发生在结肠细胞以外的细胞类型中,包括巨噬细胞和T细胞。 HDAC抑制和GPCR信号传导导致总结肠调节性T细胞(cTReg)数量增加,并产生抗炎性细胞因子白介素10(IL-10)和转化生长因子β(TGFβ)。 还认为抑制HDAC可以促进结直肠癌(CRC)细胞凋亡。
·虚线还指示了其他潜在的抗炎分子,尚需为其建立机制。 例如,已证明通过微生物转化形成的几种植物化学物质具有抗炎作用,并且体外和体内模型表明它们抑制促炎性介质(包括肿瘤坏死因子(TNF),IL-6和前列腺素) 。最后,一些共生细菌的微生物相关分子模式(MAMPS)被认为有助于抗炎信号传导。
细胞外SCFA参与了与宿主细胞表面暴露受体的几种潜在的重要相互作用(图2)。·G蛋白偶联受体41(GPR41;也称为FFA3),GPR43(也称为FFA2)和GPR109A在包括结肠细胞在内的各种宿主细胞中表达。·GPR43识别所有三个主要的SCFAs61,但对 GPR41的亲和力依次为丙酸>丁酸>>乙酸盐45,而GPR109A仅与丁酸62相互作用。·涉及GPR109A的丁酸盐驱动的信号相互作用可能通过促进调节性T细胞(TReg细胞)和产生IL-10-的T细胞的分化,以及通过阻断核因子的激活而参与丁酸盐的抗炎作用 。·
κB(NF-κB)和细胞凋亡的诱导机制与HDAC抑制无关 。·乙酸盐和丙酸盐与GPR43的相互作用被认为在通过调节TReg细胞诱导其抗炎作用中具有重要作用50,64。·GPR43和GPR109A是肿瘤抑制基因,可能介导与高纤维摄入相关的丙酸和丁酸的某些癌症保护作用59。·丁酸酯的其他重要的抗肿瘤发生作用包括抑制CRC细胞的增殖并选择性诱导其凋亡[46,48,65,66]。·所涉及的机制仍有待充分阐明,但凋亡的促进涉及由于HDAC抑制47和可能的G蛋白偶联受体相互作用而导致的转录调控变化,如上所述。·作为HDAC抑制的可能结果,已证明丁酸酯和丙酸酯(在较小程度上)可激活上皮细胞系中的AP-1信号通路,这在控制细胞增殖和凋亡中具有重要作用67。·相比之下,最近一项使用对CRC遗传敏感的小鼠品系的最新研究表明,低浓度的丁酸酯可能会通过刺激结肠上皮细胞的增殖来促进CRC。·但是,不能排除微生物群组成同时发生变化的影响68。·SCFAs(图2)的抗炎作用不仅很重要,因为它们对宿主细胞有影响,而且还可能有助于肠道菌群的体内平衡。·一个有趣的假设提出,高丁酸盐水平的抗炎作用往往会限制对肠道菌群的免疫反应,而低丁酸盐浓度会触发促炎状态,从而通过抑制潜在病原体和恢复肠道微生物群的重塑。·丁酸盐生产种49。·植物化学物质和异种生物的生物转化。·水果,蔬菜,谷物,种子,坚果,香料和饮料中存在的许多不同饮食化合物已被建议可以预防不同类型的癌症5,69。·大多数研究都对多酚进行了研究,但是非酚类化合物(如芥子油苷(得自芸苔属蔬菜)也具有保护作用70。·植物化学物质具有多种作用,包括抗氧化作用,外源生物解毒途径的调控以及细胞增殖,凋亡和炎症的调控69(图2)。·抗氧化剂可以中和活性氧(ROS),后者是能量代谢的副产物,可以破坏包括DNA在内的细胞结构,从而导致产生突变,使细胞易于患上癌症。
目前尚不清楚直接的抗氧化剂作用是否在体内预防癌症中起重要作用,因为有人质疑能否达到足够的全身浓度 。·此外,一些研究报告说,由于补充了一些抗氧化剂,某些癌症的发生率增加了72。·
饮食中的植物化学物质通常以糖苷形式存在或与纤维结合,在小肠中的摄取量有限。·高达95%的饮食植物化学物质到达大肠,并通过肠道微生物群释放并转化为其他代谢物73,74,75。·发生的转化包括氢化,脱羟基和脱甲基,它们可以改变代谢物的生物活性。·通过微生物转化形成的几种酚类代谢物已显示出抑制促炎性介质(包括肿瘤坏死因子(TNF),NF-κB和类前列腺素)75、76、77(图2)。
由于不同的细菌种类显示出不同的敏感性水平,许多酚类化合物已显示出可以改变肠道菌群组成的抗菌作用 。·
微生物组成的变化可能会产生连锁反应,例如,通过改变SCFA分布图或抑制病原微生物。·在肠道中吸收后,植物化学物质与肝脏中的甲基,硫酸盐和葡萄糖醛酸基团结合,从而促进它们通过胆汁排泄到肠道中。·在肠道中,细菌性β-葡萄糖醛酸苷酶将葡糖醛酸苷转化回相应的糖苷配基,然后可以将其重新吸收。·因此,细菌β-葡萄糖醛酸苷酶活性和肝肠循环延长了植物化学物质在体内的保留时间。·但是,微生物β-葡萄糖醛酸苷酶的活性也会干扰有毒异种生物(如药物和环境污染物)的排毒和排泄,据报道,β-葡萄糖醛酸苷酶的高活性与患癌风险增加相关79。
此外,富含蛋白质的饮食会输送有毒的化合物,例如杂环胺,这些化合物也会受到葡萄糖醛酸化作用 ,而富含蛋白质的饮食与粪便中的β-葡萄糖醛酸苷酶活性较高有关。
肠道微生物的β-葡萄糖醛酸苷酶活性也会干扰癌症的治疗;·例如,伊利替康(一种常用于治疗结肠癌的药物)的毒性在小鼠模型中通过共同施用特异性靶向细菌β-葡萄糖醛酸苷酶82的β-葡萄糖醛酸苷酶抑制剂而得到缓解。
最近的一项研究使用了β-葡萄糖醛酸苷酶基因的系统发育分析来鉴定表达β-葡萄糖醛酸苷酶的细菌,这表明一个主要的β-葡萄糖醛酸酶基因(gus,也称为uidA,最初在大肠杆菌中表征)似乎是·存在于属于Firmicutes81的几种物种中。·第二个β-葡糖醛酸糖苷酶基因(在拟杆菌中更为普遍)的功能作用尚待确定。
图3:结肠菌及其代谢产物的促炎和破坏DNA的作用,据认为有助于结肠直肠癌的发生
- 几种细菌代谢物,包括硫化氢,仲胆汁酸,多胺和活性氧(ROS),有可能引起直接DNA损伤或引起炎症(通过白介素6(IL-6)和肿瘤坏死因子(TNF)产生) ,从而促进癌变。 N-亚硝基化合物(NOC)可以通过DNA烷基化产生突变来促进癌症。 尤其是,致病细菌还通过Toll样受体(TLR)识别与微生物相关的分子模式(MAMP)来发挥促炎作用,从而导致树突状细胞进行检测并激活T辅助物17(TH17) 细胞。 TH17细胞促进促炎性介质IL-23的表达,并阻断抗炎性介质IL-10的表达。 由MAMPs介导的与肿瘤相关的屏障功能丧失也可导致细菌易位增加,并且这进一步驱动促炎途径,从而增加肿瘤发生。
- 多胺参与一系列基本的生理功能,例如维持膜和核酸的结构完整性,基因调节和翻译 。 精氨酸主要生成于宿主组织中的腐胺,亚精胺和亚精胺,但肠道细菌中也会发生多胺的合成90。高含量的多胺具有毒性,并与多种疾病(包括癌症)有关,多胺分解代谢产生的氧化应激被认为是毒性的潜在机制。 ·除了通过合成这些化合物直接对多胺库作出贡献外,某些肠道细菌(例如易产肠毒素的拟杆菌)也会上调宿主细胞的多胺生成量。 确实,几种病原体包括弗氏志贺氏菌,肺炎链球菌,肠炎沙门氏菌亚种。 ·肠衣原体鼠伤寒和幽门螺杆菌利用多胺来增加其毒性 。
- 人类模型和动物模型都有证据表明,膳食中添加不易消化的碳水化合物可以减少大肠中的蛋白质发酵,这与粪便水的遗传毒性降低相吻合。 包含抗性淀粉的饮食可减少大鼠模型中DNA损伤和肿瘤形成 ,并可减轻高水平饮食蛋白的有害作用。
- 但是,高蛋白饮食对人患CRC风险的影响仍然是一个复杂的问题,因为它受蛋白质的特定来源和其他饮食成分摄入量变化的强烈影响。因此,红色和加工肉类对癌症风险的贡献可能部分归因于蛋白质代谢产物以外的因素,例如血红素,它促进亚硝化作用。
硫化氢
- 硫化氢是通过减少饮食中的硫酸盐和其他化合物(包括硫氨基酸94和牛磺酸)的代谢而产生的(见下文)。 与Desulfovibrio spp有关的专业减少硫酸盐细菌。 在大多数个体中可检出的乳酸数量很少,并且能够将乳酸用作生长和硫化物形成的共底物 。硫化物对结肠细胞有毒,并抑制丁酸盐氧化,从而导致结肠细胞屏障的破坏。 在结肠腔 中可检测到的浓度(0.25-2 mM)下,它对未转化的人类细胞系也具有遗传毒性,DNA损伤的机制被认为与ROS98有关(图3)。
- 与健康对照组相比,CRC患者的粪便硫化物水平更高,但Desulfovibrio spp有所增加。 迄今为止,在进行的少数研究中,尚未从CRC患者的粪便样本中发现 。 因此,硫化氢水平可能主要是由细菌活性的变化而不是由细菌的丰度驱动的。
胆汁酸代谢
- 饮食,胆汁酸和肠道菌群之间的相互作用很复杂。 与CRC发生率呈正相关的高脂饮食会导致胆汁分泌增加,并且已报道CRC 患者的粪便中胆汁酸浓度升高。 此外,与非洲农村地区的人相比,非裔美国人中较高的脂肪摄入量与粪便中次要胆汁酸浓度较高相关,最近的证据表明,次要胆汁酸脱氧胆酸会促进肝癌。 胆汁酸由于具有两亲性而破坏细菌细胞膜,因此具有很强的抗菌活性,因此很可能会改变肠道菌群的组成。
- 饮食中补充脱氧胆酸的大鼠表现出SCFA的减少和微生物群组成的重大变化,而丙酸杆菌和某些硬毛菌则相对增加,而拟杆菌属的损失却与之相似。 观察到小鼠对高脂饮食的反应103。
- 胆汁酸胆酸和鹅去氧胆酸是在肝脏中由胆固醇产生的,与甘氨酸或牛磺酸结合(使胆汁酸更具亲水性并促进其作为乳化剂的作用),并排入十二指肠以促进脂肪消化。 肠道菌群对伯胆汁酸的有限生物转化发生在小肠中,然后再在回肠末端被肠肝循环重新吸收104。 但是,在小肠中逃逸的胆汁酸部分(约占总池的5%)会被大肠中的微生物群广泛转化 。 胆汁盐水解酶(在所有主要细菌区和产甲烷的古细菌中都发现)可裂解伯胆汁酸 的甘氨酸和牛磺酸残基,从而通过脱氢和脱羟基反应将它们转化为几种不同的仲胆汁酸。 产生的主要仲胆汁酸是脱氧胆酸和石胆酸,两者均通过7α-脱羟基化104产生。 ·梭菌(Clostridium scindens) 中已经详细研究了负责这种转化的基因(在bai操纵子中编码),但在人类肠道菌群中,它们似乎不如胆盐水解酶广泛。 ·胆汁酸与肠道和相关器官不同区域的致癌作用有关,这是由于产生了ROS和活性氮物质(RNS),两者均引起DNA损伤。 ·
- 此外,动物研究表明,胆汁酸的施用会导致肠道中肿瘤的发生率更高。 介导胆汁酸细胞毒性作用的分子机制很复杂。 仲胆汁酸更具疏水性,因此在破坏细胞膜时更有效,这可能通过激活膜相关蛋白(例如NAD(P)H氧化酶和磷脂酶A2)而导致ROS的产生,但其他机制也可能 参与 。 例如,胆汁酸起着与核受体相互作用并激活促进细胞凋亡的细胞信号通路的激素的作用。 但是,持续暴露于高浓度的胆汁酸会导致对细胞凋亡的抵抗力99。 ·此外,某些胆汁酸似乎可以抵消其他胆汁酸的细胞毒性作用。 **例如,由Ruminococcus gnavus产生的熊去氧胆酸似乎抑制了ROS的产生,并保护细胞免受脱氧胆酸的细胞毒性作用 **。
- 富含肉类饮食的个体中的牛磺酸结合增加,在胆汁酸去结合后,牛磺酸的磺酸部分被还原为硫化氢。 ·促进高水平牛磺酸结合的饮食会导致减少亚硫酸盐的细菌Bilophila wadsworthia,这与病理性肠道疾病相关 。
乙醇
- 过量摄入乙醇被认为是几种癌症的重要危险因素,微生物代谢可能会导致其毒性,特别是在上消化道 。乙醇是由许多厌氧细菌产生的,这些细菌在纯培养物中生长时会在结肠中栖息,但是在体内结肠微生物群产生内源性乙醇的水平尚不清楚。 尽管乙醇本身不被认为是致癌物,但其直接氧化产物乙醛具有剧毒和致癌性,其作用范围从DNA损伤到维生素叶酸的降解。 ·有趣的是,对口腔微生物群的研究表明,微生物有助于从乙醇生产乙醛,这表明肠道微生物群也可能对这一过程有贡献 。 ·
微生物群和炎症
- 越来越清楚的是,微生物群对免疫反应具有重要影响,而慢性炎症是公认的CRC危险因素。 由于结肠粘膜不断暴露于肠道菌群及其代谢产物(图2,3),细菌对免疫反应的刺激有可能引起持续的低度炎症。 ·肿瘤微环境包含几种不同的免疫细胞类型,包括组织相关巨噬细胞(TAM)和其他先天免疫细胞,以及T细胞和B细胞,它们通过直接接触或 ·通过细胞因子和/或趋化因子信号传导来控制肿瘤的生长 。 TAM主要促进肿瘤生长,并且高数量的TAM通常与癌症进展相关 。 在TAM之后,T细胞是肿瘤微环境中数量最多的免疫细胞,可以同时发挥促肿瘤和抑癌作用。 CD4 + T辅助细胞1(TH1)和CD8 +细胞毒性T细胞数量的增加与癌细胞的直接裂解以及限制CRC进展的细胞毒性细胞因子的产生有关。
- 但是,其他T细胞亚群,例如产生干扰素-γ(IFNγ)的TH1细胞,则通过细胞因子的产生和细胞毒性机制促进肿瘤发生112。 ·有趣的是,在缺乏肠道菌群或微生物产物的情况下,炎症不足以诱导CRC114。 ·也有明确的证据表明小鼠的肠道菌群会影响腺瘤的形成。 ·在一个抑癌基因Apc的一个拷贝中发生突变的腺瘤性息肉病大肠杆菌(ApcMin)小鼠自发地在小肠中形成许多良性腺瘤,并且ApcMin小鼠中形成的结肠肿瘤数量大于野生型 ·C57BL / 6小鼠。 ·但是,与具有常规菌群的ApcMin小鼠相比,无菌ApcMin小鼠的小肠腺瘤减少了两倍。
- 另外,先天性免疫受体信号转导对微生物感测的破坏也导致减少的肿瘤发生116,117。 ·微生物群的宿主识别是通过各种模式识别受体(PRR;例如Toll样受体(TLR))进行的,这些受体控制对微生物相关分子模式(MAMP;例如脂多糖(LPS),鞭毛蛋白和核酸)的炎症反应。 ·9(图3)。
- PRR在维持粘膜稳态和控制结肠环境中的炎症中起关键作用。 特别是,作为LPS的主要受体的TLR4信号的变化与CRC118的进展有关。 ·特定病原体在CRC中的作用。 ·在前面的部分中,我们描述了微生物群(作为一个整合的社区)及其代谢产物在CRC病因中的作用。 ·话虽如此,几种细菌病原体似乎与促进CRC直接相关并具有特异性。 例如,已经证明,产肠毒素的脆弱类芽孢杆菌和粘附侵袭性大肠杆菌菌株NC101可以在遗传易感小鼠中促进CAC 。 产肠毒素的脆弱脆弱芽孢杆菌的促炎作用导致诱导结肠细胞中的精胺氧化酶,从而导致ROS的产生和随之而来的DNA损伤121。 但是,大多数CRC病例不是由结肠炎引起的,这表明其他微生物物种与CRC的发病机理有关。 最近的研究表明,镰刀菌属和弯曲杆菌属。 在CRC组织中过高; 因此,这些属可能构成宏基因组CRC 的一部分。 核梭状芽胞杆菌的侵袭性菌株会加速结肠肿瘤的发作,并推动向促炎性微环境的过渡,有利于结直肠肿瘤的发生 。 F.A核酸核粘附素与E-cadherin的结合诱导其肿瘤抑制活性并激活β-catenin,从而进一步促进肿瘤细胞的生长 。
- 然而,尽管存在这些关联,但仍然难以确定是否与特定病原体有因果关系(专栏3)。 ·但是,很明显,这些单个病原体促进癌变的机制,包括诱导炎症级联反应,ROS的产生,DNA损伤和DNA修复过程的破坏,都与微生物活性相关的机制相似 代谢产物 。
- 几条证据表明,炎症会导致某些具有致癌性的细菌群的富集,包括梭菌属,解链球菌亚种。 没食子菌(以前称为牛链球菌生物型1),肠毒性的脆弱脆弱芽孢杆菌和粘附侵袭性大肠杆菌 。 炎症通过减少保护性粘蛋白和抗菌肽的产生 ,为某些细菌(例如大肠杆菌)创造了粘附到结肠粘膜的机会。 减少的屏障功能使细菌更容易与上皮相互作用,从而导致诱变代谢物(包括大肠菌素)的递送增加,大肠菌素是肠杆菌科产生的一种假定的杂合肽-聚酮化合物,会造成DNA损伤 。 产生colibactin的大肠杆菌菌株可以诱导宿主细胞中的DNA双链断裂,从而激活DNA损伤信号传导级联,从而导致慢性有丝分裂和染色体畸变,以及基因突变和不依赖锚定的生长频率增加125。
- 在IBD患者的肠道菌群中发现了升高的变形杆菌水平,特别是肠杆菌科(包括大肠杆菌),IBD是CRC 的已知危险因素。 CRC发病机理中的早期遗传事件,例如β-catenin激活和APC基因突变,似乎导致结肠上皮的屏障功能丧失,从而导致微生物产物转移到肿瘤微环境中 。 ·该过程通过激活产生IL-23的髓样细胞的活化而导致下游产生促肿瘤细胞因子的产生,从而促进肿瘤的生长 。 尽管有缺陷的屏障功能使微生物产品易位,但也使侵袭性粘附细菌在肿瘤部位定居。
Box3:与CRC相关的微生物群变化
- 最近有研究将结肠直肠癌(CRC)患者与健康受试者的微生物群落组成进行比较的研究激增 ,目的是确定肠道菌群的变化是否是该病的原因。 然而,随着CRC的发展,确定肠道微生物群的相关变化是饮食变化或生理的结果还是它们的致病性是一个挑战。 在一篇文章中,提出了CRC的“驾驶员-乘客”模型,以试图区分致病性生物和对疾病进展有反应的生物 。 使用16S核糖体RNA基因测序分析了CRC患者的粪便样本,结果表明,与健康对照组相比,脆弱的拟杆菌和几个肠杆菌操作分类单位(OTU)含量较高,而对应于生产丁酸盐的Lachnospiraceae的五个OTU的水平则降低了肿瘤相关菌群也发生变化,其中梭菌属种增加。 研究之间似乎是一致的 。 最近的深度转录组测序已显示出Leptotrichia spp。 和弯曲杆菌属。 与Fusobacterium spp 同时出现。 据报道,在使用致癌剂诱导肿瘤的小鼠中,肠道菌群的组成存在明显差异:与未经处理的小鼠相比,拟杆菌属,阿克曼虫属 和恶臭菌 增加,而普氏杆菌属 和卟啉单胞菌属 减少 。 越来越多的潜在致癌细菌为以下假设提供了支持:肿瘤发生是由许多细菌群体而非单个生物体共有的机制和/或途径驱动的。
展望
- 本综述中讨论的研究突出表明,CRC的发展不仅受特定病原体的存在的影响,而且还受整个微生物群的代谢输出的影响(图4)。 除了较高的微生物多样性和较低的病原体丰度外,微生物SCFA在维持肠道稳态方面也起着重要作用。 它们抑制革兰氏阴性病原体的生长,用作能源和抗炎药,并促进癌细胞的凋亡。 因此,正如最近的研究所表明的那样,杰出的产生丁酸盐的物种不仅是多样化,健康的微生物群的指标,而且似乎在积极地参与维持一个稳定,健康的肠道群落。 相比之下,营养不良的特征是微生物多样性的减少和促炎性病原体物种的增加,这可能是由不健康的饮食,抗微生物疗法或遗传易感性(克罗恩氏病所例证)引起的。
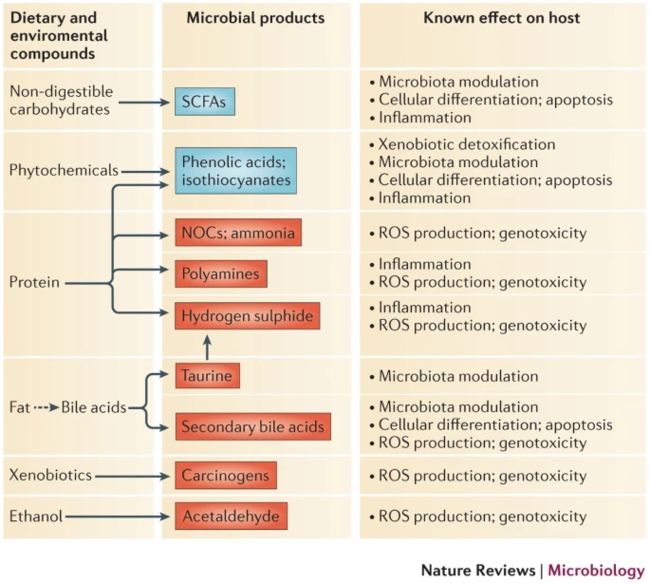
图4:由饮食和环境化合物形成的主要微生物代谢产物,它们参与了结直肠癌的发生和/或发展
- 被认为主要发挥抗癌作用的代谢物以蓝色显示,而主要具有促癌作用的代谢物以红色显示。·仅指示主机中明确建立的动作模式。·NOC,N-亚硝基化合物;·ROS,活性氧;·SCFA,短链脂肪酸。
- 越来越多的证据表明,纤维含量低,脂肪和糖含量高的饮食会导致肠道菌群多样性降低,再加上这些饮食的饮食成分和微生物代谢产物介导的有害作用,有可能增加肠道菌群 CRC的风险。·
- 代谢组学正在提供有关微生物代谢产物概况以及对显示出不同的CRC风险的患者群体中控制饮食操作的反应性的新信息。·但是,我们需要对饮食对个体微生物代谢组的影响有更好的基本了解和预测的能力。 对培养分离物和宏基因组学数据的分析有助于确定哪些细菌负责不同的代谢活动,但是,尚未充分利用已定义的财团来研究代谢物交叉喂养和重建涉及多种生物的途径。
- 最终,这些工作可以解释个体之间和饮食引起的变化对微生物群组成和代谢物谱的影响。·然而,至关重要的是,我们不仅要考虑代谢物通量,还要考虑肠道内的转运,吸收和体内组织分布,从而解决不同代谢物的定量贡献。
- 因此,理论模型以及对肠道中微生物生态学和生理学的研究,对于整合微生物群落内部以及微生物群与宿主之间发生的复杂相互作用,在未来做出的重大贡献。