非因解读| Reverse Phase Protein Array(RPPA)蛋白组学技术在外泌体分析中的应用
Reverse Phase Protein Array(RPPA)
蛋白组学技术在外泌体分析中的应用
外泌体(Exosome)是一种能被大多数细胞分泌的微小膜泡,也是细胞外囊泡(EV)的一种主要类型,直径大约40-160 nm,具有脂质双层膜结构,能很好的保护其包被的物质,内含大量的核酸,包括DNA、RNA以及蛋白质和其它小分子代谢产物。在最近的癌症研究中,外泌体已被发现与肿瘤免疫中的抗原呈递、肿瘤细胞的生长与迁移、组织损伤修复等调控机制都息息相关,也是肿瘤液态活检研究的热门方向,与肿瘤标志物有着不可分割的关系。
外泌体的胞膜和胞浆内富含高度活化的细胞信号蛋白及磷酸化蛋白,可作为疾病诊断、监测预后的生物标志物。外泌体本身结构的稳定性赋予了它特有的在蛋白分析中的优势,相较于低丰度血浆游离蛋白的检测,更容易分析纯化,稳定性更高,尤其适用于修饰蛋白的定性定量分析。外泌体的富集是研究的一大技术方向,目前已经有基于超速离心、尺寸排阻、微流控技术以及成品试剂盒化的外泌体分离纯化方法得到不同程度的应用。外泌体蛋白在大量富集后主要通过蛋白质谱技术等手段进行分析,而质谱技术在一些中低丰度的外泌体蛋白分析中,难以突破灵敏度的瓶颈,实现不了高质量的定量分析;在靶向蛋白组分析中,往往也因为复杂的样本前处理等客观因素的影响,较难获得可靠的研究数据,因此外泌体蛋白组学研究发展并不十分顺利。
非因生物的RPPA靶向蛋白组学技术则弥补了这个空缺。作为一种高通量的多重蛋白靶点分析技术,可实现大规模样本的几百种靶点平行分析;同时RPPA具有其它高通量蛋白组学所无可比拟的超高灵敏度,可在10-15毫克组织中(半个米粒大小)或者60-80微克总蛋白中分析多达500种以上低丰度蛋白,包括大量细胞信号蛋白、免疫通路蛋白、修饰蛋白(磷酸化,乙酰基化,甲基化)等。RPPA技术在定量能力、重复性、大样本分析比对能力上的优势,是其它蛋白组学技术手段所不具备的。
非因生物的RPPA蛋白组学技术可针对少量的外泌体样本进行大规模蛋白组学分析,尤其是对外泌体内富集的信号通路蛋白、磷酸化蛋白的定量分析有着独特的优势,为外泌体蛋白组研究开辟新的途径。本次介绍的两篇文章就是充分发挥RPPA技术对外泌体蛋白组进行高通量分析的经典案例,从而得出重要的结论,为外泌体的生物标志物应用和转化医学奠定了重要的技术基础。
案例一
2018年8月,Gang Chen和Alexander C. Huang等人在Nature上发表题为:Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response的文章(图1),该文章利用Gordon Mills 教授实验室的RPPA技术对转移性黑色素瘤患者的外泌体蛋白组进行靶向分析研究,发现PD-L1在转移性黑色素瘤外泌体中高表达。
图1
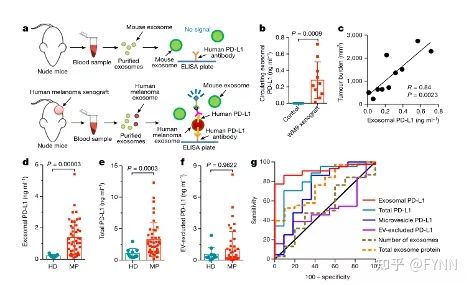
研究团队想实现外泌体的靶向蛋白研究,运用分层离心法将原发性和转移性黑色素瘤患者的外泌体提取后,仅使用50微克总蛋白结合反相蛋白微阵列技术(RPPA)和免疫印迹实验(Western blot)发现PD-L1在外泌体上有明显表达且转移性黑色素瘤外泌体的PD-L1表达远高于原发性黑色素瘤(图2)。在ELISA结果中,作者发现黑色素瘤细胞分泌的外泌体上PD-L1的表达量在干扰素IFN-γ刺激后增高且外泌体PD-L1与PD-1受体的结合作用增加。
图2
为了更好地研究黑色素瘤细胞分泌外泌体PD-L1的机理,作者团队构建了人黑色素瘤异种移植小鼠与对照组,将外泌体提取后,用ELISA法检测到PD-L1在人黑色素瘤异种移植小鼠中的循环外泌体中有表达,且在对照组中没有表达(图3a,3b),并发现外泌体PD-L1的表达量与肿瘤大小呈正相关(图3c)。接着作者团队在黑色素瘤患者中的血浆中提取了细胞外囊泡,实验发现,转移性黑色素瘤患者循环外泌体上PD-L1的表达远高于健康人群(图3d,3g),从而得出结论循环外泌体PD-L1的表达量可用于有效的区分转移性黑色素瘤患者与健康人群。
图3
当前PD-L1介导的免疫抑制模型是基于肿瘤细胞表面PD-L1配体与CD8 T细胞上PD-1受体的相互作用。研究团队为了验证外泌体PD-L1对CD8 T细胞的作用,通过研究发现表达外源PD-L1的MEL624细胞中的外泌体抑制了CD8 T细胞的细胞增殖,细胞因子的增加与细胞毒性(图4a)。通过构建敲除PD-L1的同源黑色素瘤小鼠模型发现,注射表达PD-L1的外泌体后,促进了肿瘤增长,注射抗PD-LA抗体预处理的外泌体后,抑制了肿瘤生长(图4b)。并且,研究发现注射了表达PD-L1的外泌体后,肿瘤浸润CD T淋巴细胞数量减少且PD-1+ CD T细胞增殖降低(图4c),揭示了外泌体PD-L1对抗肿瘤免疫系统有抑制作用。
图4
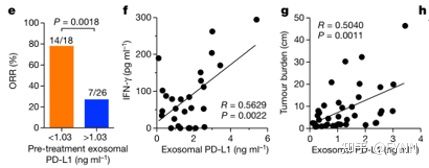
作者团队接着对采取抗PD-1疗法的黑色素瘤患者的循环细胞外囊泡上PD-L1的表达量进行研究。发现对于抗PD-1治疗的非响应者,循环外泌体PD-L1的表达量明显高于药物响应者。但总循环PD-L1,循环微囊泡与非细胞外囊泡的PD-L1 对于两种响应者没有显著差异(图5)。且治疗前高表达的循环外泌体PD-L1与不良的预后结果相关联且与循环IFN-γ表达水平和肿瘤大小呈正相关,进而可作为不良预后的预测标准(图6)。
图5
图6
最后作者团队对于采取pembrolizumab药物疗法的黑色素瘤患者的循环外泌体PD-L1进行分析,发现临床响应者在治疗的六周内,循环外泌体PD-L1表达量,相较于总循环PD-L1、微囊泡PD-L1与非细胞外囊泡PD-L1显著升高。因此,循环外泌体PD-L1表达水平可用来区分药物响应者与非药物响应者(图7)。
图7
非因小结
这篇文章讲述了转移性黑色素瘤主要以外泌体的形式,释放表面携带PD-L1的细胞外囊泡,对这些细胞外囊泡进行干扰素IFN-γ刺激后,通过 RPPA技术研究外泌体蛋白组发现,外泌体表面的PD-L1增加,从而抑制CD8 T细胞的功能且促进肿瘤生长。该研究揭示了肿瘤细胞抑制免疫系统的机理,且为循环外泌体PD-L1预测抗PD-1疗法的应用提供了理论依据。
案例二
乳腺癌的早期发现对于癌症治疗和患者生存具有重要的临床意义。越来越多的数据表明细胞外小囊泡中的蛋白质信息可用于评估肿瘤预后及治疗响应情况。2020年10月,Yaron Vinik等人通过一种低价、高效的方法从乳腺癌患者血浆中分离出小细胞外囊泡(sEVs),并与Gordon Mills 教授的RPPA技术团队进行合作,对富集的sEVs进行蛋白质组学分析比对,发现了一些可用于区分乳腺癌患者和健康人的特定蛋白标志物,其中FAK和纤连蛋白表现出较高的诊断准确性,并在Science Advances上发表“Proteomic analysis of circulating extracellular vesicles identifies potential markers of breast cancer progression, recurrence, and response”的文章(图8)。
图8
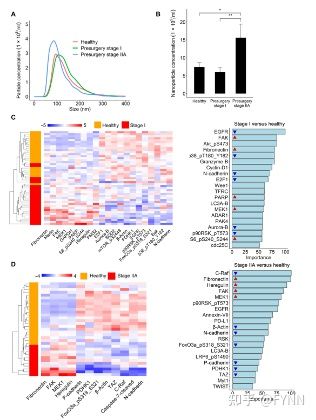
研究团队首先采用尺寸排阻色谱法SEC(Size exclusion Chromatography)和过滤相结合的分离-纯化技术,仅用2ml血浆即可得到高纯度的小细胞外囊泡(sEVs)(图9左)。然后将从52例乳腺癌患者和22个健康对照者的血浆中分离出sEVs的蛋白提取物进行RPPA分析,得到了与癌症信号通路相关的约276种细胞蛋白的总表达及其磷酸化表达水平,总结出在术前乳腺癌患者与健康对照组中有显著表达差异的蛋白信息(图9A),并通过KNN法(k-Nearest neighbor)确定了10种有效区分乳腺癌患者与健康人群的蛋白标志物(图9B,9C)。
图9 从血浆中提取sEV流程图(左) sEVs的RPPA分析(右A-F)
为了进一步提高标志物分类的准确性与特异性,研究团队对数据构建了弹性网络回归模型(logistic regression with elastic net penalty.),最终确定了7种用于区分乳腺癌患者与健康人群的蛋白标志物,其中三种蛋白上调(FAK, MEK1, and fibronectin),其余蛋白下调(β-actin, C-Raf, and N-cadherin,p90RSK_pT573)(图9D,9F)。
此外研究人员对不同时期的乳腺癌患者(Stage I and Stage IIA)的sEVs进行分析, 发现晚期乳腺癌与早期乳腺癌相比,sEVs体积较小,数量显著增多(图10A,10B)。并且通过对stage I, stage II 乳腺癌患者和健康对照组蛋白标志物的聚类分析发现主要的蛋白标志物可用来区分乳腺癌发展的不同阶段。从而得出结论外泌体及其蛋白质特征与乳腺癌分期密切相关(图10C,10D)。
图10
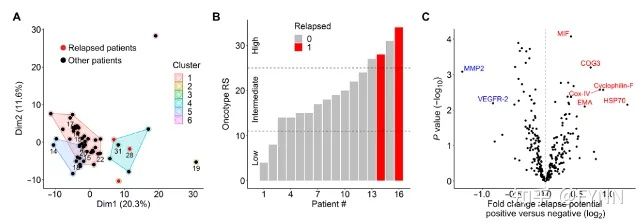
为了确定复发高风险的蛋白标志物,作者团队对复发乳腺癌病人进行了术前样本RPPA分析并聚类,发现蛋白标志物可作为复发的潜在预测因子(图11A)。在对复发患者的RPPA数据与其他患者相比较分析发现存在蛋白表达差异,其中HSP70差异性最显著且与肿瘤复发相关(图11B,11C)。因此,细胞外小囊泡对于预测肿瘤复发风险具有重要临床意义。
图11
接着作者团队对27例术后患者的细胞外囊泡进行分析,并将患者样本分为化疗组和其他治疗组。研究发现将术后和术前及健康对照组相比,术后患者细胞外囊泡直径主要在150nm,且小于100nm的数量明显较少(图12A,12B)。聚类分析发现,采取不同治疗方法的术后患者蛋白标志物表达有明显差异(图12C,12D)。化疗患者的细胞外囊泡富集一些促进因子如转铁蛋白受体(TFRC)且E-cadherin明显下调;而放疗患者的过氧化物歧化酶(SOD2)明显上调(图12E)。最后,研究人员对术前、术后和健康人群蛋白表达进行对比发现,在术后患者细胞外囊泡样本中生物标志物FAK,MEK1和fibronectin仍旧呈现上调,与之前研究结果一致。
图12
非因小结
本研究介绍了一种低成本,高效且可靠的细胞外囊泡提取方法,通过半定量蛋白质组学分析不同阶段乳腺癌患者治疗前后与健康对照人群的血浆中蛋白信息。并通过RPPA技术分析出用于区分乳腺癌患者与健康对照组的蛋白标志物以及发现癌症复发高风险的预测因子,为乳腺癌诊断及研究发展奠定基础。
总结
反向蛋白微阵列(RPPA)技术,相比于其他蛋白组学分析技术,可高效地分析样本集群,围绕肿瘤生物学,覆盖了多个重要信号通路、磷酸化蛋白,打开了外泌体蛋白组学研究的新途径,同时为各种癌症临床生物标志物的分析和癌症复发风险的预测奠定了坚实的基础。